Results
Figure 1
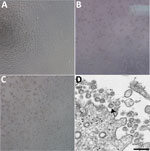
Figure 1. Cytopathisch effect veroorzaakt door severe acute respiratory syndrome coronavirus 2 van patiënt met coronavirusziekte, Verenigde Staten, 2020. A-C) Fase-contrast microscopie van Vero cel monolagen op 3 dagen postinoculatie: A) Mock,…
Een patiënt werd geïdentificeerd met bevestigd COVID-19 in de staat Washington op 22 januari 2020. CPE werd niet waargenomen in mock-geïnfecteerde cellen (figuur 1, paneel A). Cyclusdrempelwaarden (Ct) waren 18-20 voor NP-specimens en 21-22 voor OP-specimens (1). De positieve klinische specimens werden aliquoted en opnieuw ingevroren geënt in celkweek op 22 januari 2020. We observeerden CPE 2 dagen postinoculatie en oogstten viraal lysaat op dag 3 postinoculatie (figuur 1, panelen B, C). We gebruikten 50 pi van passage 1 virale lysaten voor nucleïnezuurextractie om de aanwezigheid van SARS-CoV-2 met behulp van de CDC moleculaire diagnostische assay (1) te bevestigen. De Ct-waarden van 3 nucleïnezuurextracties waren 16,0-17,1 voor nucleocapsidegedeelte 1, 15,9-17,1 voor nucleocapsidegedeelte 2, en 16,2-17,3 voor nucleocapsidegedeelte 3, wat de isolatie van SARS-CoV-2 bevestigde (Ct <40 wordt als een positief resultaat beschouwd). We hebben ook extracten getest op 33 andere respiratoire pathogenen met behulp van de Fast Track 33 Assay. Er werden geen andere pathogenen gedetecteerd. De identiteit werd bovendien ondersteund door elektronenmicroscopie van dunne doorsnede (figuur 1, paneel D). We observeerden een morfologie en morfogenese kenmerkend voor coronavirussen.
We gebruikten isolaten van de eerste passage van een OP- en een NP-specimen voor whole-genome sequencing. De genomen van het NP specimen (GenBank toetreding MT020880) en OP specimen (GenBank toetreding no. MT020881) toonden 100% identiteit met elkaar. De isolaten toonden ook 100% identiteit met het corresponderende klinische specimen (GenBank toetreding nr. MN985325).
Na de tweede passage kweekten we de OP en NP specimens niet meer afzonderlijk. We hebben het virusisolaat nog twee keer gepasseerd in Vero CCL-81 cellen en getitreerd door de 50% weefselkweek infectieuze dosis (TCID50) te bepalen. De titers bedroegen 8,65 × 106 TCID50/mL voor de derde passage en 7,65 × 106 TCID50/mL voor de vierde passage.
We hebben dit virus gepassaged in afwezigheid van trypsine. De spike proteïne sequentie van SARS-CoV-2 heeft een RRAR insertie op het S1-S2 raakvlak dat mogelijk door furine gesplitst kan worden (16). Hoogpathogene aviaire influenzavirussen hebben zeer basale furinesplitsingsplaatsen bij het hemagglutinine-eiwit HA1-HA2-interface, die intracellulaire maturatie van virionen en efficiëntere virale replicatie mogelijk maken (17). De RRAR insertie in SARS-CoV-2 zou een gelijkaardige functie kunnen hebben.
Figuur 2
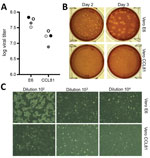
Figuur 2. Virale vermeerdering en kwantificering van severe acute respiratory syndrome coronavirus 2 van patiënt met coronavirusziekte, Verenigde Staten, 2020. A) Twee virus passage 4 voorraden (zwarte en grijze cirkels) werden gekwantificeerd…
We genereerden vervolgens een vierde passage voorraad van SARS-CoV-2 op VeroE6 cellen, een andere foetale resusaap niercellijn. We hebben het viraal RNA van SARS-CoV-2 passage 4 gesequeneerd en bevestigd dat het geen nucleotidemutaties bevat in vergelijking met de oorspronkelijke referentiesequentie (GenBank accession no. MN985325). SARS-CoV is goed gebleken te groeien op VeroE6-cellen en MERS-CoV op Vero CCL81-cellen (18,19). Om een plaque-test uit te voeren en het Vero celtype te bepalen dat de voorkeur geniet voor kwantificering, titerden wij onze stam van passage 4 op VeroE6- en VeroCCL81-cellen. Na infectie met een verdunningsreeks repliceerde SARS-CoV-2 in beide Vero-celtypes; de virale titers waren echter iets hoger in VeroE6-cellen dan in Vero CCL81-cellen (figuur 2, paneel A). Bovendien waren de plaques duidelijker en zichtbaarder op Vero E6-cellen (figuur 2, paneel B). Reeds 2 dagen na de inoculatie produceerden VeroE6-cellen duidelijke plaques die zichtbaar werden gemaakt door kleuring met neutraalrood. In tegenstelling, Vero CCL81 cellen minder duidelijke plaques geproduceerd en werd het gemakkelijkst gekwantificeerd door kleuring met neutraal rood 3 dagen postinoculatie. Op de individuele plaque monolayers, SARS-CoV-2 infectie van Vero E6 cellen geproduceerd CPE met gebieden van cel klaring (figuur 2, paneel C). Vero CCL81-cellen daarentegen vertoonden gebieden met dode cellen die tot plaques waren samengesmolten, maar de cellen werden niet geklaard. Samen suggereren deze resultaten dat VeroE6-cellen misschien de beste keuze zijn voor amplificatie en kwantificering, maar beide Vero-celtypen ondersteunen amplificatie en replicatie van SARS-CoV-2.
Figuur 3
Figuur 3. Cellijnen van patiënt met coronavirusziekte, Verenigde Staten, 2020, vatbaar voor SARS-coronavirus 2 (SARS-CoV-2). De cellijnen werden geïnfecteerd met een hoge multipliciteit van infectie (>5), gewassen na adsorptie, en…
Omdat onderzoek is gestart om SARS-CoV-2 te bestuderen en erop te reageren, is informatie nodig over cellijnen en typen die gevoelig zijn voor infectie. Daarom onderzochten we de capaciteit van SARS-CoV-2 om te infecteren en te repliceren in verschillende gangbare primaten- en menselijke cellijnen, waaronder menselijke adenocarcinoomcellen (A549), menselijke levercellen (HUH7.0), en menselijke embryonale niercellen (HEK-293T), naast Vero E6- en Vero CCL81-cellen. We onderzochten ook een beschikbare grote bruine vleermuisniercellijn (EFK3B) op SARS-CoV-2 replicatiecapaciteit. Elke cellijn werd geïnoculeerd bij een hoge multipliciteit van infectie en 24 uur na infectie onderzocht (figuur 3, paneel A). Geen CPE werd waargenomen in een van de cellijnen, behalve in Vero cellen, die groeide tot >107 PFU op 24 uur na infectie. HUH7.0- en 293T-cellen daarentegen vertoonden slechts een bescheiden virale replicatie, en A549-cellen waren niet compatibel met SARS-CoV-2-infectie. Deze resultaten zijn consistent met eerdere vatbaarheidsbevindingen voor SARS-CoV en suggereren dat andere gangbare kweeksystemen, waaronder MDCK, HeLa, HEP-2, MRC-5-cellen en geëmbryoneerde eieren, waarschijnlijk geen ondersteuning bieden voor de replicatie van SARS-CoV-2 (20-22). Bovendien repliceerde SARS-CoV-2 zich niet in vleermuis-EFK3B-cellen, die gevoelig zijn voor MERS-CoV. Samen geven de resultaten aan dat SARS-CoV-2 een vergelijkbaar profiel behoudt als SARS-CoV in termen van vatbare cellijnen.
Na het vaststellen van robuuste infectie met SARS-CoV-2 in verschillende celtypen, evalueerden we vervolgens de kruisreactiviteit van SARS-CoV-antilichamen tegen het SARS-CoV-2. Cellysaten van geïnfecteerde cellijnen werden gesondeerd voor eiwitanalyse; we vonden dat polyklonaal serum tegen het SARS-CoV spike-eiwit en nucleocapsid eiwitten SARS-CoV-2 herkennen (figuur 3, panelen B, C). Het nucleocapside-eiwit, dat sterk geconserveerd is in de groep 2B-familie, behoudt >90% aminozuuridentiteit tussen SARS-CoV en SARS-CoV-2. In overeenstemming met de replicatieresultaten (figuur 3, paneel A), vertoonde SARS-CoV-2 een robuust nucleocapsideproteïne in beide Vero-celtypes, minder eiwit in HUH7.0- en 293T-cellen, en een minimaal eiwit in A549- en EFK3B-cellen (figuur 3, paneel B). Het SARS-CoV spike-eiwit antilichaam herkende ook SARS-CoV-2 spike-eiwit, wat wijst op kruisreactiviteit (figuur 3, paneel C). In overeenstemming met SARS-CoV werden verschillende gekloofde en niet-gekloofde vormen van het SARS-CoV-2-spike-eiwit waargenomen. Het splitsingspatroon van de positieve SARS-spikecontrole van Calu3-cellen, een respiratoire cellijn, varieert enigszins en zou kunnen wijzen op verschillen tussen de proteolytische splitsing van de spike-eiwitten tussen de 2 virussen als gevolg van een voorspelde invoeging van een furinesplitsingsplaats in SARS-CoV-2 (16). Verschillen in celtype en omstandigheden bemoeilijken echter deze interpretatie en wijzen op de noodzaak van verdere studie in equivalente systemen. Over het algemeen recapituleren de eiwitexpressiegegevens van SARS-CoV nucleocapsid en spike-eiwitantilichamen de replicatiebevindingen en geven aan dat SARS-CoV-reagentia kunnen worden gebruikt om SARS-CoV-2-infectie te karakteriseren.
Figuur 4
Figuur 4. Multistaps groeicurve voor severe acute respiratory syndrome coronavirus 2 van patiënt met coronavirusziekte, Verenigde Staten, 2020. Vero CCL81 (zwart) en HUH7.0 cellen (groen) werden geïnfecteerd bij een multipliciteit van…
Ten slotte evalueerden we de replicatiekinetiek van SARS-CoV-2 in een meerstaps-groeicurve. In het kort, we geïnfecteerd Vero CCL-81 en HUH7.0 cellen met SARS-CoV-2 bij een lage multipliciteit van infectie (0,1) en geëvalueerd virale replicatie om de 6 uur gedurende 72 h postinoculatie, met afzonderlijke oogsten in de cel-geassocieerde en supernatant compartimenten (figuur 4). Net als bij SARS-CoV repliceerde SARS-CoV-2 zich snel in Vero-cellen na een initiële eclipsfase, waarbij 105 TCID50/mL werd bereikt tegen 24 uur na infectie en een piek bereikte van >106 TCID50/mL. We zagen vergelijkbare titers in cel-geassocieerde en supernatant compartimenten, wat wijst op een efficiënte egress. Ondanks piek virale titers bij 48 h postinoculatie, werd grote CPE niet waargenomen tot 60 h postinoculatie en piekte bij 72 h postinoculatie, wat aangeeft dat geïnfecteerde monolayers geoogst moeten worden voordat piek CPE wordt waargenomen. Replicatie in HUH7.0 cellen nam ook snel toe na een initiële eclipse fase, maar plateau bereikte na 24 uur postinoculatie in het intracellulaire compartiment 2 × 103 TCID50/mL en nam af na 66 uur postinoculatie. Virus werd niet gedetecteerd in het supernatant van geïnfecteerde HUH7-cellen tot 36 h postinoculatie en vertoonde lagere titers op alle tijdstippen (Figuur 4). Belangrijke CPE werd nooit waargenomen in HUH7.0-cellen. Deze resultaten zijn consistent met eerdere rapporten voor SARS-CoV en MERS-CoV, die een vergelijkbare replicatiedynamiek tussen de zoönotische CoV-stammen suggereerden (23,24).
