- o-Xyleen Chemische Eigenschappen, Gebruiken, Productie
- Xyleen
- Precisiedestillatie voor de scheiding van O-xyleen en p-xyleen
- Chemische eigenschappen
- Toepassingen
- Productiemethode
- Categorie
- Geschiktheidsklasse
- Aute toxiciteit
- EXPLOSIVEN en GEVAARLIJKE KENMERKEN
- Vlambaarheid en gevaarlijke eigenschappen
- Opslag- en transportkenmerken
- Brandblusmiddel
- Bedrijfsnorm
- Chemische eigenschappen
- Fysische eigenschappen
- Toepassingen
- Definitie
- Syntheseverwijzing(en)
- Algemene beschrijving
- Air & Waterreacties
- Reactiviteitsprofiel
- Gezondheidsrisico
- Gevaar bij brand
- Chemische reactiviteit
- Veiligheidsprofiel
- Bron
- Milieu lot
- Verwijderingsmethoden
o-Xyleen Chemische Eigenschappen, Gebruiken, Productie
Xyleen
Xyleen verwijst naar de aromatische koolwaterstof waarbij de twee waterstofatomen aan de benzeenring gesubstitueerd zijn door twee methylgroepen. Het heeft drie isomeren o-xyleen (1,2-dimethylbenzeen), m-xyleen en p-xyleen. De industriële producten zijn de mengsels van de drie isomeren met 10% o-10%, 70% m-, en 20% p-. In de cokesindustrie, is het één van ruwe benzeen geraffineerde producten.
Xyleen is een soort kleurloze brandbare vloeistof; het smeltpunt van o-, m- en p-xyleen is-25.2 ℃,-47.9 ℃ en 13.3 ℃; de kookpunten zijn respectievelijk 144.4 ℃, 139.1 ℃ en 138.3 ℃ terwijl de relatieve dichtheid 0.8802, 0.8642 en 0.8611, respectievelijk is; Het is niet oplosbaar in water maar mengbaar met vele soorten organische oplosmiddelen onmengbaarheid. Bij katalytische oxidatie ontstaan respectievelijk ftaalzuuranhydride, isoftaalzuur en tereftaalzuur.
Xyleen is een soort belangrijke grondstof voor organische chemicaliën, die van nature voorkomt in koolteer en sommige soorten aardolie. Het kan worden verkregen door fractionering van het lichte oliegedeelte van de koolteer of door katalytische reforming van lichte benzine. De industrie wint het voornamelijk uit de C8-fractie in de nafta reformaten. Het kan ook worden vervaardigd door de disproportioneringsreactie van tolueen in aanwezigheid van een katalysator en bij hoge temperatuur en onder hoge druk. Momenteel past de industrie hoofdzakelijk de methode van cryogene kristallisatie, adsorptie en vorming van complexen of moleculaire zeven toe om ze te scheiden. O-xyleen heeft een betrekkelijk hoog kookpunt en kan met behulp van destillatie worden gescheiden. Ook p-xyleen heeft een hoog smeltpunt en kan worden gezuiverd door gefractioneerde kristallisatiezuivering. Gemengd xyleen kan zonder afscheiding rechtstreeks als oplosmiddel worden gebruikt, terwijl toevoeging aan de benzine de explosiewerende eigenschappen kan verbeteren. Het zijn bestanddelen van vliegtuigbenzine. O-xyleen wordt hoofdzakelijk gebruikt voor de bereiding van ftaalzuuranhydride, dat een belangrijke grondstof is voor de vervaardiging van een reeks kleurstoffen en indicatoren (zoals fenolftaleïne). Daarnaast kan o-xyleen ook worden gebruikt voor de bereiding van polyesterhars, insectenafweermiddel, weekmakers en kleurstoffen. M-xyleen kan door nitratie en reductie 4,6-dimethyl-1,3-fenyleendiamine genereren dat het tussenproduct is voor synthetische kleurstoffen. M-xyleen kan ook worden gebruikt als grondstof voor synthetische geurstoffen (zoals xyleenmuskus). P-xyleen wordt voornamelijk gebruikt bij de vervaardiging van tereftaalzuur, dat een belangrijke grondstof is voor synthetische polyestervezel (polyester).
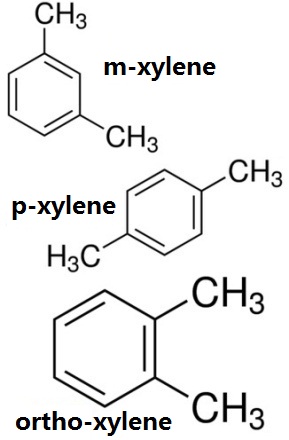
Figuur 1 de chemische structuur van de drie isomeren van xyleen, ortho-xyleen, m-xyleen, p-xyleen chemische structuur.
De bovenstaande informatie is bewerkt door Chemicalbook.
Precisiedestillatie voor de scheiding van O-xyleen en p-xyleen
Xyleen komt voor in gekookte ruwe benzeen en in aardolie gekraakte olie. Ruwe benzeen, na initiële destillatie, wassen met zwavelzuur en destillatie voor de scheiding van benzeen en tolueen, gevolgd door destillatie, kunnen we xyleen verkrijgen, ook bekend als coking xyleen. De kwaliteit van het cokesxyleen hangt af van het scheidingsvermogen van de distillatiekolom, de temperatuur aan de top van de kolom en de refluxverhouding. China heeft de cokesxyleenproducten in drie niveaus ingedeeld. Het cokesxyleen bevat over het algemeen 16% o-xyleen, 50% m-xyleen, 21% p-xyleen en 7% ethylbenzeen. Het in de aardolie-industrie geproduceerde xyleen heeft een laag gehalte aan m-xyleen en een hoog gehalte aan ethylbenzeen. Industrieel xyleen is niet alleen het oplosmiddel en additief van de rubber- en coatingsindustrie, maar ook de additieven van vliegtuig- en energiebrandstof. O-xyleen, m-xyleen en p-xyleen, afgescheiden van industrieel xyleen, zijn de grondstoffen van respectievelijk ftaalzuur, isoftaalzuur en tereftaalzuur. Ftaalzuur en tereftaalzuur worden gebruikt bij de produktie van weekmakers, polyesterharsen en polyestervezels. M-xyleen kan alleen worden gebruikt als oplosmiddel en als brandstofadditief. Het o-xyleen in het industriële xyleen heeft een verschil van meer dan 5,2 ℃ met andere isomeren. Met precisiedistillatie kunnen we o-xyleen verkrijgen met een zuiverheid van meer dan 95%, gevolgd door het gebruik van sulfonatie en distillatie voor zuivering, zodat we nog zuiverder o-xyleen kunnen krijgen.
Xyleen behoort tot de Lewisbasen, die een polair complex kunnen vormen met HF-BF3 (Lewiszuur). De alkaliteit van M-xyleen is ongeveer 100 keer zo sterk als die van andere C8 aromaten. Wanneer het isomeermengsel van xyleen in contact komt met HF-BF3 oplosmiddel, kan m-xyleen een complex vormen met fluoride en wordt het bij voorkeur geëxtraheerd in de fluoridefase. De m-xyleen-bevattende fluoridefase wordt bij lagere druk verhit om het complex te ontbinden, waardoor mxyleen van het mengsel wordt afgescheiden. HF-BF3 oplosmiddel kan door destillatie worden teruggewonnen voor recycling. Als de grondstof een mengsel is van ortho-xyleen, m-xyleen en p-xyleen, kunnen we, nadat het m-xyleen is geëxtraheerd, verder gebruik maken van precisiedistillatie om het o-xyleen en p-xyleen te scheiden.
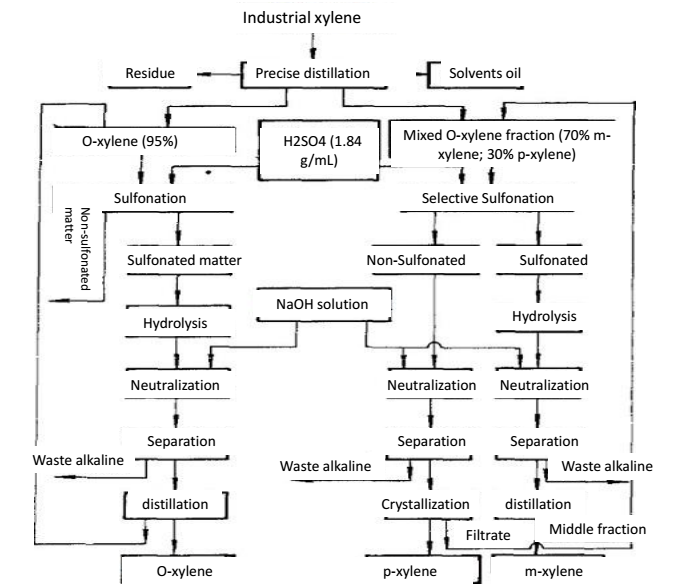
Figuur 2 de precisiedistillatiemethode voor de scheiding van o-xyleen en p-xyleen.
Chemische eigenschappen
Het verschijnt als kleurloze transparante vloeistof met aromatische geur. Het is mengbaar met ethanol, ethylether, aceton en benzeen, maar onoplosbaar in water.
Toepassingen
(1) Het wordt hoofdzakelijk gebruikt bij de productie van ftaalzuuranhydride
(2) O-xyleen is de grondstof voor de productie van kiemdodend fenramine, tetrachloorfenylpeptide en het herbicide bensulfuron-methyl. Het wordt gebruikt als tussenproduct voor de vervaardiging van o-methylbenzoëzuur.
(3) Het wordt voornamelijk gebruikt als chemische grondstof en oplosmiddel. Het kan worden gebruikt voor de productie van ftaalzuuranhydride, kleurstoffen, pesticiden en geneesmiddelen, zoals vitamines. Het kan ook worden gebruikt als additief voor vliegtuigbenzine.
(4) Gebruikt als chromatografische standaarden en oplosmiddelen
(5) Als grondstof voor de synthese van anhydride en andere organische synthese;
Productiemethode
De industrie paste super-distillatiemethode toe om het o-xyleen van het gemengde xyleen te scheiden. O-xyleen heeft een meer dan 5 ℃ verschil in het kookpunt vergeleken met andere componenten in de gemengde xyleen. Voor de destillatie is ongeveer 150 platen nodig; de refluxverhouding is 5-8 en verbruikt relatief veel energie.
O-xyleen werd oorspronkelijk voornamelijk uit koolteer geproduceerd. Momenteel vindt het grootste deel van de binnen- en buitenlandse produktie van o-xyleen plaats via extractie uit oliekatalytische reforming en thermisch kraken van aromatische koolwaterstof. Aangezien de structuren van o-xyleen, p-xyleen en m-xyleen in het xyleen sterk op elkaar lijken, zijn hun fysische parameters ook vrij gelijklopend. De industriële o-xyleenscheiding keurt hoofdzakelijk super-distillatiemethode goed; scheidt eerst o-xyleen en ethylbenzeen van gemengd xyleen dat het gebruik van 100~150 dienbladdestillatietoren vereist; gevolgd door scheiding van o-xyleen en ethylbenzeen om zuiver o-xyleen te verkrijgen.
Categorie
Brandbare vloeistoffen
Geschiktheidsklasse
Vergiftiging
Aute toxiciteit
LDL0 voor orale toediening bij ratten: 5000 mg/kg; LD50 voor buikinjectie bij muizen: 1364 mg/kg
EXPLOSIVEN en GEVAARLIJKE KENMERKEN
ontplofbaar bij menging met lucht
Vlambaarheid en gevaarlijke eigenschappen
ontvlambaar bij vlam, hitte, oxidant Ontvlambaar bij verbranding waarbij irriterende rook vrijkomt
Opslag- en transportkenmerken
magazijn: geventileerd, lage temperatuur en droog; voorzichtig laden en lossen; gescheiden opslaan van oxidanten en zuren.
Brandblusmiddel
nevel water, schuim, zand, kooldioxide, 1211 blusmiddel
Bedrijfsnorm
TLV-TWA 100 PPM (440 mg/m 3); STEL 150; PPM (655 mg/m 3)
Chemische eigenschappen
kleurloze vloeistof
Fysische eigenschappen
Heldere, kleurloze vloeistof met een aromatische geur. Een geurdrempelconcentratie van 380 ppbv werd gerapporteerd door Nagata en Takeuchi (1990).
Toepassingen
Voorbereiding van ftaalzuur, ftaalzuuranhydride, tereftaalzuur, isoftaalzuur; oplosmiddel voor alkydharsen, lakken, emaillakken, rubbercement; vervaardiging van kleurstoffen, geneesmiddelen en insecticiden; motorbrandstoffen.
Definitie
ChEBI: Een xyleen gesubstitueerd door methylgroepen op posities 1 en 3.
Syntheseverwijzing(en)
Journal of the American Chemical Society, 97, p. 7262, 1975 DOI: 10.1021/ja00858a011
The Journal of Organic Chemistry, 44, p. 2185, 1979 DOI: 10.1021/jo01327a032
Algemene beschrijving
Een kleurloze waterige vloeistof met een zoete geur. Minder dicht dan water. Onoplosbaar in water. Irriterende damp.
Air & Waterreacties
Licht ontvlambaar. Onoplosbaar in water.
Reactiviteitsprofiel
1,2-Dimethylbenzeen kan reageren met oxiderende stoffen. .
Gezondheidsrisico
Dampen veroorzaken hoofdpijn en duizeligheid. Vloeistof irriteert ogen en huid. Indien opgenomen in longen, veroorzaakt ernstige hoest, benauwdheid, en zich snel ontwikkelend longoedeem. Bij inslikken veroorzaakt het misselijkheid, braken, krampen, hoofdpijn en coma. Kan dodelijk zijn. Nier- en leverbeschadiging kan optreden.
Gevaar bij brand
Gedrag bij brand: Damp is zwaarder dan lucht en kan een aanzienlijke afstand afleggen naar een ontstekingsbron en terugslaan.
Chemische reactiviteit
Reactiviteit met water Geen reactie; Reactiviteit met gewone materialen: Geen reactie; Stabiliteit tijdens transport: Stabiel; Neutralisatiemiddelen voor Zuren en Bijtende Stoffen: Niet van toepassing; Polymerisatie: Niet van toepassing; Polymerisatieremmer: Niet van toepassing.
Veiligheidsprofiel
Matig giftig bj7intraperitoneale route. Matig giftig bij opname door de mond en bij inademing. Een experimenteel teratogeen. Een gemeenschappelijke luchtverontreinigende stof. Zeer gevaarlijk brandgevaar bij blootstelling aan hitte of vlammen. Ontplofbaar in de vorm van damp bij blootstelling aan hitte of vlammen. Gebruik voor brandbestrijding schuim, CO2, droog chemisch product. Onverenigbaar met oxiderende materialen. Bij verhitting tot ontleding komt een scherpe rook en irriterende dampen vrij. Afkomstig uit moderne bouwmaterialen (CENEAR69,22,91). Zie ook andere xyleenvermeldingen.
Bron
Aangetroffen in in gedestilleerd water oplosbare fracties van 87-octaanbenzine (3,83 mg/L), 94-octaanbenzine (11,4 mg/L), Gasohol (8,49 mg/L), nr. 2 stookolie (1,73 mg/L), reactiemotorbrandstof A (0,87 mg/L), dieselolie (8,49 mg/L).87 mg/L), dieselbrandstof (1,75 mg/L), militaire JP-4-straalbrandstof (1,99 mg/L) (Potter, 1996), nieuwe motorolie (16,2-17,5 μg/L), en gebruikte motorolie (294-308 μg/L) (Chen et al., 1994). Het gemiddelde volumepercentage en de geschatte molfractie in benzine PS-6 van het American Petroleum Institute zijn respectievelijk 2,088 en 0,01959 (Poulsen et al., 1992). Schauer et al. (1999) rapporteerden een o-xyleenemissie van 830 μg/km in de uitlaatgassen van een diesel aangedreven middelzware vrachtwagen. Dieselolie verkregen van een servicestation in Schlieren, Zwitserland, bevatte o-xyleen in een concentratie van 223 mg/L (Schluep et al., 2001).
California Phase II reformulated gasoline bevatte o-xyleen in een concentratie van 19,7 g/kg.Gasfase-emissies uit uitlaatgassen van door benzine aangedreven auto’s met en zonder katalysator bedroegen respectievelijk 5,41 en 562 mg/km (Schauer et al., 2002).
Thomas en Delfino (1991) hebben verontreinigingsvrij grondwater uit Gainesville, FL, gedurende 24 uur bij 24-25 °C geëquilibreerd met afzonderlijke fracties van drie afzonderlijke aardolieproducten. De waterige fase werd geanalyseerd op organische verbindingen volgens de door de U.S. EPA goedgekeurde testmethode602. De gemiddelde m+p-xyleenconcentraties die werden gerapporteerd in de in water oplosbare fracties van loodvrije benzine, kerosine en dieselolie bedroegen respectievelijk 8,611, 0,658 en 0,228 mg/L. Toen de auteurs de waterfase analyseerden volgens de door de U.S. EPA goedgekeurde testmethode 610, waren de gemiddelde m+p-xyleenconcentraties in de in water oplosbare fracties van loodvrije benzine, kerosine en diesel lager, namelijk respectievelijk 6,068, 0,360 en 0,222 mg/l. Gebaseerd op laboratoriumanalyse van 7 koolteermonsters varieerden de o-xyleenconcentraties van 2 tot 2.000 ppm (EPRI, 1990). Een hoge-temperatuur-steenkoolteer bevatte o-xyleen met een gemiddelde concentratie van 0,04 gew.% (McNeil, 1983).
Schauer et al. (2001) maten de emissie van organische verbindingen voor vluchtige organische verbindingen, semi-vluchtige organische verbindingen in de gasfase, en organische verbindingen in de deeltjesfase uit de verbranding van dennen, eiken en eucalyptus in woningen (open haard). De gasfase-emissiesnelheid van o-xyleen was 18,1 mg/kg verbrand dennenhout. Emissies van o-xyleen werden niet gemeten tijdens de verbranding van eik en eucalyptus.
Drinkwaternorm (definitief): Voor alle xylenen zijn de MCLG en de MCL beide 10 mg/L. Daarnaast werd een DWEL van 70 mg/L aanbevolen (U.S. EPA, 2000).
Milieu lot
Biologisch. Gerapporteerde biologische afbraakproducten van het commerciële product dat xyleen bevat, omvatten α-hydroxy-p-toluïnezuur, p-methylbenzylalcohol, benzylalcohol, 4-methylcatechol, mandp-toluïnezuren (Fishbein, 1985). o-Xyleen werd ook gecometaboliseerd wat resulteerde in de vorming van o-toluïnezuur (Pitter en Chudoba, 1990). In anoxisch grondwater nabij Bemidji, MI, werd o-xyleenanaeroob biologisch afgebroken tot het tussenproduct o-toluïnezuur (Cozzarelli et al., 1990). In met benzine verontreinigd grondwater werd methylbenzylbarnsteenzuur geïdentificeerd als het eerste tussenproduct tijdens de anaerobe afbraak van xylenen (Reusser en Field, 2002).
Photolytisch. Cox et al. (1980) meldden een snelheidsconstante van 1,33 x 10-11 cm3/molecule?sec voor de reactie van gasvormig o-xyleen met OH-radicalen, gebaseerd op een waarde van 8 x 10-12 cm3/molecule?sec voor de reactie van ethyleen met OH-radicalen.
Oppervlaktewater. De verdampingshalveringstijd van o-xyleen in oppervlaktewater (1 m diepte) bij 25 °C wordt geschat op 5,18 uur (Mackay en Leinonen, 1975).
Grondwater. Nielsen et al. (1996) bestudeerden de afbraak van o-xyleen in een ondiepe, glaciofluviale, niet-ingesloten zandige aquifer in Jutland, Denemarken. Als onderdeel van de in situ microkosmos studie werd een cilinder, die open was aan de onderkant en afgeschermd aan de bovenkant, geïnstalleerd in een boorgat ongeveer 5 m onder de grond. Vijf liter water werd belucht met atmosferische lucht om ervoor te zorgen dat de aërobe omstandigheden gehandhaafd bleven. Het grondwater werd gedurende ongeveer 3 maanden wekelijks geanalyseerd om de o-xyleenconcentratie in de tijd te bepalen. De experimenteel bepaalde eerste-ordebiodegradatiesnelheidsconstante en de overeenkomstige halfwaardetijd na een vertragingsfase van 7 dagen bedroegen respectievelijk 0,1/d en 6,93 d.
Fotolytisch. Wanneer synthetische lucht met gasvormig salpeterzuur en o-xyleen werd blootgesteld aan kunstmatig zonlicht (λ = 300-450 nm) vormden biacetyl, peroxyacetaalnitraat en methylnitraat als producten (Cox et al., 1980). Een n-hexaanoplossing die o-xyleen bevatte en als een dunne film (4 mm) op koud water (10 °C) was uitgesmeerd, werd bestraald met een kwikmediumdruklamp. In 3 uur tijd fotooxideerde 13,6% van het o-xyleen in o-methylbenzaldehyde, o-benzylalcohol, o-benzoëzuur en omethylacetofenon (Moza en Feicht, 1989). Bestraling van o-xyleen bij ≈ 2537 ? bij 35 °C en 6 mmHg isomeriseert tot m-xyleen (Calvert en Pitts, 1966). Glyoxal, methylglyoxal, en biacetyl werden geproduceerd uit de fotooxidatie van o-xyleen door OH-radicalen in lucht bij 25 °C (Tuazon et al.,1986a).
Chemisch/fysisch. Onder atmosferische omstandigheden resulteerde de gasfase-reactie van o-xyleen met OH-radicalen en stikstofoxiden in de vorming van o-tolualdehyde, o-methylbenzylnitraat, nitro-o-xylenen, 2,3- en 3,4-dimethylfenol (Atkinson, 1990). Kanno et al. (1982) bestudeerden de waterige reactie van o-xyleen en andere aromatische koolwaterstoffen (benzeen, tolueen, m- en p-xyleen, en naftaleen) met hypochlorig zuur in aanwezigheid van ammoniumion. Zij meldden dat de aromatische ring niet werd gechloreerd zoals verwacht, maar werd gesplitst door chloramine waarbij cyanogeenchloride werd gevormd. De hoeveelheid gevormde cyanogeenchloride nam toe bij lagere pH’s (Kanno et al., 1982). In de gasfase reageerde o-xyleen met nitraatradicalen in gezuiverde lucht waarbij de volgende producten werden gevormd: 5-nitro-2-methyltolueen en 6-nitro-2-methyltolueen, o-methylbenzaldehyde, en een arylnitraat (Chiodini et al., 1993).
Verwijderingsmethoden
o-Xyleen (4,4Kg) wordt gesulfoneerd door 4 uur te roeren met 2,5L conc H2SO4 bij 95o. Na afkoeling en afscheiding van het ongesulfoneerde materiaal wordt het product verdund met 3 liter water en geneutraliseerd met 40% NaOH. Na afkoelen wordt natrium-oxyleensulfonaat afgescheiden en geherkristalliseerd uit de helft van zijn gewicht aan water. Het zout wordt opgelost in de minimale hoeveelheid koud water, vervolgens gemengd met dezelfde hoeveelheid koud water en met hetzelfde volume van conc H2SO4 en verwarmd tot 110o. O-xyleen wordt geregenereerd en stoomdestilleert. Het destillaat wordt verzadigd met NaCl, de organische laag wordt afgescheiden, gedroogd en opnieuw gedestilleerd.
