Generieke naam: lidocaine hydrochloride
Doseringsvorm: topische gelei
Medisch beoordeeld door Drugs.com. Laatst bijgewerkt op 1 okt 2020.
- Overzicht
- Bijwerkingen
- Dosering
- Professioneel
- Interacties
- Meer
Rx only
- Beschrijving
- CLINISCHE FARMACOLOGIE
- INDICATIES EN GEBRUIK
- CONTRAINDICATIES
- WAARSCHUWINGEN
- PRECAUTIONS
- Gebruik tijdens de zwangerschap:
- Bijwerkingen
- OVERDOSERING
- DOSAGE EN ADMINISTRATIE
- MAXIMUM DOSAGE
- Hoe VERSTREKT
- Meer over lidocaïne topical
- Consumer resources
- Professional resources
- Gerelateerde behandelingsgidsen
Beschrijving
Lidocaine HCI 2% Jelly is een steriel, waterig product dat een lokaal verdovingsmiddel bevat en plaatselijk wordt toegediend. (Zie INDICATIES voor specifiek gebruik.)
Lidocaine HCI 2% Jelly bevat lidocaine HCI dat chemisch wordt aangeduid als acetamide, 2-(diethylamino)-N-(2,6-dimethylfenyl)-,monohydrochloride en heeft de volgende structuurformule:
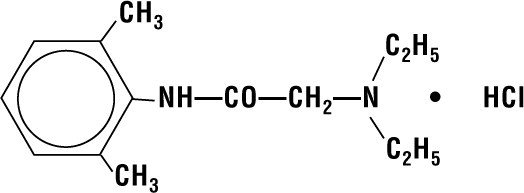
Zijn molecuulformule is C14H22N2O – HCI en zijn molecuulgewicht is 270.80.
Lidocaine HCI 2% Jelly bevat ook hypromellose, en het resulterende mengsel maximaliseert het contact met mucosa en biedt smering voor instrumentatie. Het ongebruikte deel moet na het eerste gebruik worden weggegooid.
Samenstelling van Lidocaine HCI 2% Jelly tubes van 30 ml en 5 ml: Elke mL bevat 20 mg lidocaïne HCI. De formulering bevat ook methylparaben, propylparaben, hypromellose, en natriumhydroxide en/of zoutzuur om de pH aan te passen tussen 6,0 en 7,0.
CLINISCHE FARMACOLOGIE
Werkingsmechanisme: Lidocaine stabiliseert het neuronale membraan door het remmen van de ionische stromen die nodig zijn voor de initiatie en geleiding van impulsen, waardoor lokale verdovingswerking wordt bewerkstelligd.
Aanvang van de werking: Het begin van de werking is 3 tot 5 minuten. Het is niet werkzaam wanneer het op de intacte huid wordt aangebracht.
Hemodynamica: Een te hoge bloedspiegel kan veranderingen veroorzaken in de cardiale output, de totale perifere weerstand en de gemiddelde arteriële druk. Deze veranderingen kunnen worden toegeschreven aan een direct deprimerend effect van het plaatselijke verdovingsmiddel op diverse componenten van het cardiovasculaire systeem.
Farmacokinetiek en Metabolisme: Lidocaïne kan worden geabsorbeerd na plaatselijke toediening aan slijmvliezen, waarbij de snelheid en de mate van absorptie afhankelijk zijn van de concentratie en de totale toegediende dosis, de specifieke plaats van toepassing en de duur van de blootstelling. In het algemeen is de absorptiesnelheid van plaatselijke verdovingsmiddelen na plaatselijke toediening het snelst na intratracheale toediening. Lidocaïne wordt ook goed geabsorbeerd uit het maagdarmkanaal, maar er kan weinig intact geneesmiddel in de circulatie verschijnen als gevolg van biotransformatie in de lever.
Lidocaïne wordt snel gemetaboliseerd door de lever en metabolieten en onveranderd geneesmiddel worden door de nieren uitgescheiden. De biotransformatie omvat oxidatieve N-dealkylering, ringhydroxylering, splitsing van de amidebinding, en conjugatie. N-dealkylering, een belangrijke route van de biotransformatie, levert de metabolieten monoethylglycinexylidide en glycinexylidide op. De farmacologische/toxicologische werking van deze metabolieten is vergelijkbaar met, maar minder krachtig dan, die van lidocaïne. Ongeveer 90% van de toegediende lidocaïne wordt uitgescheiden in de vorm van verschillende metabolieten, en minder dan 10% wordt onveranderd uitgescheiden. De primaire metaboliet in de urine is een conjugaat van 4-hydroxy-2, 6-dimethylaniline.
De plasmabinding van lidocaïne is afhankelijk van de geneesmiddelconcentratie, en de gebonden fractie neemt af met toenemende concentratie. Bij concentraties van 1 tot 4 mcg vrije base per ml, is 60 tot 80 procent van lidocaïne eiwitgebonden. Binding is ook afhankelijk van de plasmaconcentratie van het alfa-I-zuur-glycoproteïne.
Lidocaïne passeert de bloed-hersen- en placentabarrières, vermoedelijk door passieve diffusie.
Studies naar het metabolisme van lidocaïne na intraveneuze bolusinjecties hebben aangetoond dat de eliminatiehalfwaardetijd van dit middel typisch 1,5 tot 2,0 uur bedraagt. Vanwege de snelle snelheid waarmee lidocaïne wordt gemetaboliseerd, kan elke aandoening die de leverfunctie beïnvloedt, de kinetiek van lidocaïne veranderen. De halfwaardetijd kan bij patiënten met leverdysfunctie twee-voudig of meer worden verlengd. Nierdisfunctie heeft geen invloed op de lidocaïnekinetiek, maar kan de accumulatie van metabolieten verhogen.
Factoren zoals acidose en het gebruik van CNS-stimulantia en depressantia beïnvloeden de CNS-niveaus van lidocaïne die nodig zijn om openlijke systemische effecten te produceren. Objectieve nadelige verschijnselen worden steeds duidelijker bij stijgende veneuze plasmaniveaus boven 6 mcg vrije base per ml. Bij de resusaap zijn arteriële bloedspiegels van 18 tot 21 mcg/mL aangetoond als drempel voor convulsieve activiteit.
INDICATIES EN GEBRUIK
Lidocaïne HCI 2% Jelly is geïndiceerd voor de preventie en bestrijding van pijn bij procedures waarbij de mannelijke en vrouwelijke urethra betrokken is, voor plaatselijke behandeling van pijnlijke urethritis, en als verdovingsmiddel bij endotracheale intubatie (oraal en nasaal).
CONTRAINDICATIES
Lidocaïne is gecontra-indiceerd bij patiënten met een bekende geschiedenis van overgevoeligheid voor lokale anesthetica van het amidetype of voor andere bestanddelen van Lidocaine HCI 2% Jelly.
WAARSCHUWINGEN
ExtENSIEVE DOSERING, OF KORTE INTERVALS TUSSEN DE DOSERING, KUNNEN VEROORZAKEN IN HOGE PLASMA NIVEAU’S EN ERNSTIGE AVERSE EFFECTEN. PATIËNTEN MOETEN WORDEN GEÏNSTRUEERD OM ZICH STRIKT TE HOUDEN AAN DE AANBEVOLEN DOSERING EN TOEDIENINGSRICHTLIJNEN ZOALS UITEENGEZET IN DEZE BIJSLUITER. HET BEHEER VAN ERNSTIGE BIJWERKINGEN KAN HET GEBRUIK VAN RESUSCITATIEVE APPARATUUR, OXYGEN EN ANDERE RESUSCITATIEVE DRUGS VERGENOMEN.
Lidocaïne HCI 2% gelei dient met uiterste voorzichtigheid te worden gebruikt in aanwezigheid van sepsis of ernstig getraumatiseerde mucosa in het gebied van toepassing, aangezien onder dergelijke omstandigheden de mogelijkheid bestaat van snelle systemische absorptie.
Bij gebruik voor het smeren van endotracheale tubes dient men erop te letten dat het product niet in het lumen van de tube terechtkomt. Gebruik de gelei niet om de endotracheale stylettes te smeren. Als de gelei in het inwendige lumen terechtkomt, kan het aan de binnenkant opdrogen en een residu achterlaten dat de neiging heeft te klonteren bij flexie, waardoor het lumen vernauwt. Er zijn zeldzame meldingen waarbij dit residu tot afsluiting van het lumen heeft geleid. (Zie ook ADVERSE REACTIES en DOSAGE AND ADMINISTRATION.)
PRECAUTIONS
Algemeen: De veiligheid en werkzaamheid van lidocaïne zijn afhankelijk van een juiste dosering, een juiste techniek, adequate voorzorgsmaatregelen en paraatheid voor noodgevallen. (Zie WAARSCHUWINGEN en BIJWERKINGEN.) De laagste dosering die resulteert in effectieve anesthesie moet worden gebruikt om hoge plasmaspiegels en ernstige bijwerkingen te voorkomen. Herhaalde doses lidocaïne kunnen bij elke herhaalde dosis aanzienlijke verhogingen van de bloedspiegels veroorzaken als gevolg van langzame accumulatie van het geneesmiddel of zijn metabolieten. De tolerantie voor verhoogde bloedspiegels varieert met de status van de patiënt. De verzwakte, oudere patiënten, acuut zieke patiënten, en kinderen zouden verminderde dosissen moeten worden gegeven evenredig met hun leeftijd en fysieke status. Lidocaine zou ook met voorzichtigheid in patiënten met strenge schok of hart block.
Lidocaine HCI 2% Gelei zou met voorzichtigheid in patiënten met bekende drugovergevoeligheden moeten worden gebruikt. Patiënten die allergisch zijn voor para-aminobenzoëzuurderivaten (procaïne, tetracaïne, benzocaïne, enz.) hebben geen kruisgevoeligheid voor lidocaïne aangetoond.
Veel geneesmiddelen die tijdens de uitvoering van anesthesie worden gebruikt, worden beschouwd als potentiële triggers voor familiaire maligne hyperthermie. Aangezien niet bekend is of lokale anesthetica van het amidetype deze reactie kunnen uitlokken en aangezien de noodzaak van aanvullende algemene anesthesie niet van tevoren kan worden voorspeld, wordt gesuggereerd dat er een standaardprotocol voor de behandeling beschikbaar moet zijn. Vroegtijdige onverklaarbare tekenen van tachycardie, tachypneu, labiele bloeddruk en metabole acidose kunnen voorafgaan aan temperatuurstijging. Een succesvol resultaat is afhankelijk van een vroege diagnose, onmiddellijke stopzetting van de vermoedelijke veroorzaker(s) en instelling van behandeling, waaronder zuurstoftherapie, geïndiceerde ondersteunende maatregelen en dantroleen (raadpleeg voor gebruik de bijsluiter van dantroleennatrium intraveneus).
Informatie voor patiënten: Wanneer topische anesthetica in de mond worden gebruikt, moet de patiënt zich ervan bewust zijn dat de productie van topische anesthesie het slikken kan belemmeren en zo het gevaar van aspiratie kan vergroten. Om deze reden mag gedurende 60 minuten na gebruik van lokale verdovingspreparaten in de mond of keel geen voedsel worden genuttigd. Dit is vooral belangrijk bij kinderen omdat zij zo vaak eten.
Numbositas van de tong of buccale mucosa kan het gevaar van onbedoeld bijttrauma vergroten. Voedsel of kauwgom mag niet worden ingenomen terwijl het mond- of keelgebied verdoofd is.
Carcinogenese – Langetermijnstudies bij dieren zijn niet uitgevoerd om het carcinogene potentieel van lidocaïne te beoordelen.
Mutagenese – Het mutagene potentieel van lidocaïne is getest in de Ames Salmonella omgekeerde mutatietest, en in vitro chromosoomafwijkingen assay in menselijke lymfocyten en in een in vivo micronucleus assay in muizen. Er waren geen aanwijzingen voor enig mutageen effect in deze onderzoeken.
Aantasting van de vruchtbaarheid – Het effect van lidocaïne op de vruchtbaarheid werd onderzocht in het rattenmodel. Toediening van 30 mg/kg, s.c. (180 mg/m2) aan het paringspaar leidde niet tot veranderingen in de vruchtbaarheid of de algemene voortplantingsprestaties van ratten. Er zijn geen studies die het effect van lidocaïne op spermaparameters onderzoeken. Er waren geen aanwijzingen voor veranderde vruchtbaarheid.
Gebruik tijdens de zwangerschap:
Teratogene effecten: Zwangerschapscategorie B.
Reproductiestudies voor lidocaïne zijn uitgevoerd bij zowel ratten als konijnen. Er was geen bewijs van schade aan de foetus bij subcutane doses tot 50 mg/kg lidocaïne (300 mg/m2 op basis van lichaamsoppervlak) in het rattenmodel. In het konijnenmodel was er geen bewijs van schade aan de foetus bij een dosis van 5 mg/kg, s.c. (60 mg/m2 op basis van lichaamsoppervlak). Behandeling van konijnen met 25 mg/kg (300 mg/m2) leverde aanwijzingen op voor toxiciteit bij de moeder en voor vertraagde ontwikkeling van de foetus, waaronder een niet-significante afname van het foetale gewicht (7%) en een toename van kleine skeletafwijkingen (schedel- en sternebrale defecten, verminderde verbening van de vingerkootjes). Het effect van lidocaïne op de postnatale ontwikkeling werd onderzocht bij ratten door zwangere vrouwelijke ratten dagelijks subcutaan te behandelen in doses van 2, 10 en 50 mg/kg (12, 60 en 300 mg/m2) vanaf dag 15 van de zwangerschap en tot 20 dagen post partum. Tot en met de dosis van 10 mg/kg (60 mg/m2) werden noch bij de moederdieren noch bij de jongen tekenen van schadelijke effecten waargenomen; bij 50 mg/kg (300 mg/m2) was het aantal overlevende jongen echter verminderd, zowel bij de geboorte als tijdens de lactatieperiode, waarbij het effect hoogstwaarschijnlijk secundair was aan de toxiciteit voor de moeder. In deze studie werden geen andere effecten op de worpgrootte, het gewicht van de worp, afwijkingen bij de pups en lichamelijke ontwikkelingen van de pups waargenomen.
Een tweede studie onderzocht de effecten van lidocaïne op de postnatale ontwikkeling bij de rat, waarbij de pups werden beoordeeld vanaf het spenen tot aan de geslachtsrijpheid. Ratten werden gedurende 8 maanden behandeld met 10 of 30 mg/kg, s.c. lidocaïne (respectievelijk 60 mg/m2 en 180 mg/m2 op basis van lichaamsoppervlak). Deze periode omvatte 3 paringsperioden. Er waren geen aanwijzingen voor een veranderde postnatale ontwikkeling bij de nakomelingen; beide doses lidocaïne verminderden echter significant het gemiddelde aantal pups per worp dat overleefde tot het spenen van de nakomelingen uit de eerste 2 paringsperioden.
Er zijn echter geen adequate en goed gecontroleerde studies bij zwangere vrouwen. Omdat voortplantingsstudies bij dieren niet altijd voorspellend zijn voor de reactie bij de mens, mag dit middel tijdens de zwangerschap alleen worden gebruikt als dit duidelijk nodig is.
Labor and Delivery: Lidocaïne is niet gecontra-indiceerd bij arbeid en bevalling. Indien Lidocaine HCl 2% Jelly gelijktijdig wordt gebruikt met andere producten die lidocaïne bevatten, moet de totale dosis die door alle formuleringen wordt bijgedragen in gedachten worden gehouden.
Nursing Mothers: Lidocaïne wordt uitgescheiden in menselijke melk. De klinische betekenis van deze waarneming is onbekend. Voorzichtigheid is geboden wanneer lidocaïne wordt toegediend aan een zogende vrouw.
Pediatrisch gebruik: Hoewel, de veiligheid en doeltreffendheid van Lidocaine 2% Jelly bij pediatrische patiënten niet zijn vastgesteld, werd in een studie van 19 premature neonaten (zwangerschapsduur <33 weken) geen correlatie gevonden tussen de plasmaconcentratie van lidocaïne of monoethylglycinexylidide en het lichaamsgewicht van de zuigeling wanneer gematigde hoeveelheden lidocaïne (d.w.z. 0,3 ml/kg lidocaïne gel 20 mg/mL) werden gebruikt voor het smeren van zowel intranasale als endotracheale tubes. Geen enkele neonaat had een plasmaspiegel van lidocaïne hoger dan 750 mcg/L. Doseringen bij kinderen dienen te worden verlaagd, in overeenstemming met leeftijd, lichaamsgewicht en lichamelijke conditie. (Zie dosering en toediening.)
Bijwerkingen
Bijwerkingen na toediening van lidocaïne zijn vergelijkbaar met die bij andere amide lokale anesthetica. Deze bijwerkingen zijn in het algemeen dosisgerelateerd en kunnen het gevolg zijn van hoge plasmaspiegels veroorzaakt door overmatige dosering of snelle absorptie, of kunnen het gevolg zijn van overgevoeligheid, idiosyncrasie, of verminderde tolerantie van de patiënt. Ernstige bijwerkingen zijn over het algemeen systemisch van aard. De volgende typen zijn het meest gemeld:
Er zijn zeldzame meldingen geweest van occlusie van de endotracheale buis in verband met de aanwezigheid van gedroogde geleiresten in het binnenlumen van de buis. (Zie ook WAARSCHUWINGEN en BIJSLUITING EN TOEDIENING.)
Centraal Zenuwstelsel: De manifestaties van het CZS zijn prikkelend en/of depressief en kunnen worden gekenmerkt door licht gevoel in het hoofd, nervositeit, ongerustheid, euforie, verwardheid, duizeligheid, slaperigheid, oorsuizen, wazig of dubbelzien, braken, warmte-, koude- of gevoelssensaties, stuiptrekkingen, trillen, stuiptrekkingen, bewusteloosheid, ademhalingsdepressie en ademstilstand. De opwindende manifestaties kunnen zeer kort zijn of helemaal niet optreden, in welk geval de eerste manifestatie van toxiciteit slaperigheid kan zijn die overgaat in bewusteloosheid en ademhalingsstilstand.
Slaperigheid na de toediening van lidocaïne is gewoonlijk een vroeg teken van een hoge bloedspiegel van het geneesmiddel en kan optreden als gevolg van snelle absorptie.
Cardiovasculair systeem: Cardiovasculaire manifestaties zijn meestal depressief en worden gekenmerkt door bradycardie, hypotensie en cardiovasculaire collaps die tot hartstilstand kan leiden.
Allergisch: Allergische reacties worden gekenmerkt door cutane laesies, urticaria, oedeem, of anafylactoïde reacties. Allergische reacties kunnen optreden als gevolg van gevoeligheid hetzij voor het lokaal anestheticum of voor andere componenten in de formulering. Allergische reacties als gevolg van gevoeligheid voor lidocaïne zijn uiterst zeldzaam en dienen, indien zij zich voordoen, met conventionele middelen te worden behandeld. Het opsporen van gevoeligheid door huidtesten is van twijfelachtige waarde.
OVERDOSERING
Acute noodsituaties als gevolg van lokale anesthetica zijn over het algemeen gerelateerd aan hoge plasmaspiegels die optreden tijdens therapeutisch gebruik van lokale anesthetica. (Zie BIJWERKINGEN, WAARSCHUWINGEN en VOORZORGSMAATREGELEN.)
Hantering van plaatselijke verdovingsnoodgevallen: De eerste overweging is preventie, wat het best kan worden bereikt door zorgvuldige en constante controle van de cardiovasculaire en respiratoire vitale tekenen en de bewustzijnstoestand van de patiënt na elke lokale anesthesietoediening. Bij het eerste teken van verandering moet zuurstof worden toegediend.
De eerste stap in de behandeling van convulsies bestaat uit onmiddellijke aandacht voor het handhaven van een open luchtweg en geassisteerde of gecontroleerde beademing met zuurstof en een toedieningssysteem dat onmiddellijke positieve luchtwegdruk met een masker mogelijk maakt. Onmiddellijk na het instellen van deze beademingsmaatregelen dient de toereikendheid van de circulatie te worden geëvalueerd, rekening houdend met het feit dat geneesmiddelen die worden gebruikt om convulsies te behandelen soms de circulatie onderdrukken wanneer zij intraveneus worden toegediend. Mochten de convulsies aanhouden ondanks adequate ademhalingsondersteuning, en als de toestand van de circulatie het toelaat, kunnen kleine hoeveelheden van een ultrakortwerkend barbituraat (zoals thiopental of thiamylal) of een benzodiazepine (zoals diazepam) intraveneus worden toegediend. De clinicus dient vertrouwd te zijn met deze anti-epileptica alvorens lokale anesthetica te gebruiken. Ondersteunende behandeling van circulatiedepressie kan toediening van intraveneuze vloeistoffen vereisen en, indien van toepassing, een vasopressor zoals voorgeschreven door de klinische situatie (bijv. efedrine).
Als ze niet onmiddellijk worden behandeld, kunnen zowel convulsies als cardiovasculaire depressie leiden tot hypoxie, acidose, bradycardie, aritmie en hartstilstand. Indien een hartstilstand optreedt, moeten standaard cardiopulmonale reanimatiemaatregelen worden ingesteld.
Dialyse is van verwaarloosbare waarde bij de behandeling van acute overdosering met lidocaïne.
De orale LD50 van lidocaïne HCI bij niet-gespoelde vrouwelijke ratten is 459 (346 tot 773) mg/kg (als het zout) en 214 (159 tot 324) mg/kg (als het zout) bij nuchtere vrouwelijke ratten.
DOSAGE EN ADMINISTRATIE
Wanneer Lidocaine HCI 2% Gelei gelijktijdig met andere producten wordt gebruikt die lidocaïne bevatten, moet de totale dosis die door alle formuleringen wordt bijgedragen in gedachten worden gehouden.
De dosering varieert en hangt van het te verdoven gebied, vasculariteit van de weefsels, individuele tolerantie, en de techniek van anesthesie af. De laagste dosering die nodig is voor een effectieve anesthesie moet worden toegediend. Doseringen moeten worden verlaagd voor kinderen en voor oudere en verzwakte patiënten. Hoewel de weerslag van nadelige gevolgen met Lidocaine HCI 2% Gelei vrij laag is, zou de voorzichtigheid moeten worden betracht, vooral wanneer het gebruiken van grote hoeveelheden, aangezien de weerslag van nadelige gevolgen aan de totale dosis van lokale toegediende verdovingsmiddelenagent recht evenredig is: Bij gebruik van Lidocaine 2% Jelly 30 mL tubes, steriliseer de plastic kegel gedurende 5 minuten in kokend water, koel af, en bevestig aan de tube. De kegel kan gas worden gesteriliseerd of koud worden gesteriliseerd, zoals aangewezen. Breng langzaam ongeveer 15 ml (300 mg lidocaïne HCI) in de urethra of totdat de patiënt een gevoel van spanning heeft. Vervolgens wordt gedurende enkele minuten een penisklem op de corona aangebracht. Een extra dosis van niet meer dan 15 ml (300 mg) kan worden toegediend voor een adequate verdoving.
Voordat een sonde of cystoscopie wordt verricht, moet gedurende 5 tot 10 minuten een penisklem worden aangebracht om een adequate verdoving te verkrijgen. Een totale dosis van 30 ml (600 mg) is gewoonlijk vereist om de mannelijke urethra te vullen en te verwijden.
Voor katheterisatie zijn kleinere volumes van 5 tot 10 ml (100 tot 200 mg) gewoonlijk voldoende voor smering.
Voor oppervlakte-anesthesie van de vrouwelijke volwassen urethra: Bij gebruik van Lidocaine 2% Jelly 30 mL tubes, steriliseer de plastic kegel gedurende 5 minuten in kokend water, koel af, en bevestig aan de tube. Het kegeltje kan gasgesteriliseerd of koud gesteriliseerd zijn, zoals de voorkeur verdient. Breng langzaam 3 tot 5 ml (60 tot 100 mg lidocaïne HCI) van de gelei in de urethra. Indien gewenst kan wat gelei op een wattenstaafje worden aangebracht en in de plasbuis worden gebracht. Om een adequate anesthesie te verkrijgen, moet men enkele minuten wachten alvorens urologische ingrepen uit te voeren.
Smering voor Endotracheale Intubatie: Breng een matige hoeveelheid gelei aan op het buitenoppervlak van de endotracheale buis kort voor gebruik. Zorg ervoor dat het product niet in het lumen van de buis terechtkomt. Gebruik de gelei niet voor het smeren van endotracheale stylettes. Zie de WAARSCHUWINGEN en BIJNA GEACTIVEERDE REACTIES voor zeldzame meldingen van occlusie van het inwendige lumen. Tevens wordt aanbevolen het gebruik van endotracheale tubes met opgedroogde gelei op het uitwendige oppervlak te vermijden wegens gebrek aan smerende werking.
MAXIMUM DOSAGE
Er mag niet meer dan 600 mg lidocaïne HCI worden gegeven in een periode van 12 uur.
Kinderen: Het is moeilijk om een maximale dosering van enig geneesmiddel voor kinderen aan te bevelen, aangezien deze varieert als functie van leeftijd en gewicht. Voor kinderen jonger dan tien jaar die een normale magere lichaamsmassa en een normale magere lichaamsontwikkeling hebben, kan de maximumdosis worden bepaald door toepassing van een van de standaardformules voor pediatrische geneesmiddelen (bv. Clark’s regel). Bijvoorbeeld, bij een kind van vijf jaar dat 50 pond weegt, mag de dosis lidocaïnehydrochloride niet meer dan 75 tot 100 mg bedragen wanneer deze wordt berekend volgens de regel van Clark. In elk geval zou de maximum toegediende hoeveelheid Lidocaine HCI niet 4,5 mg/kg (2 mg/lb) lichaamsgewicht mogen overschrijden.
Hoe VERSTREKT
Lidocaine HCI 2% Jelly wordt geleverd in de vermelde doseringsvormen.
NDC 17478-840-30 aluminium tube van 30 ml
NDC 17478-840-05 aluminium tube van 5 ml
In de doos van 30 ml is een afneembaar applicatorkegeltje en een sleutel voor het uitdrukken van de inhoud bijgesloten.
Opbergen: Bewaren bij 20° tot 25°C (68° tot 77°F).
PREMIERProRx®
Gemaakt door:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® is een gedeponeerd handelsmerk van Premier Inc., gebruikt onder licentie.
PLD00N Rev. 10/15
Principal Display Panel Text for Container Label:
NDC 17478-840-05 Premier Logo
Lidocaine Hydrochloride Jelly USP, 2%
Rx only
Steriel 5 mL

Principal Display Panel Text for Carton Label:
NDC 17478-840-05 Steriel 5 ml
Lidocaine Hydrochloride Gelei USP, 2%
Rx only
Premier Logo

| LIDOCAINE lidocaine hydrochloride jelly |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Etiketteraar – Akorn, Inc. (117696770)
Registrant – Akorn Operating Company LLC (117693100)
| Inrichting | |||
| Naam | Adres | ID/FEI | Operations |
| Akorn, Inc | 117696840 | MANUFACTURE(17478-840), ANALYSIS(17478-840), STERILIZE(17478-840), PACK(17478-840), LABEL(17478-840) | |
Meer over lidocaïne topical
- Bijwerkingen
- Tijdens zwangerschap of borstvoeding
- Doseringsinformatie
- Gewrichtsinteracties
- Vergelijk alternatieven
- Prijzen & Coupons
- En Español
- 208 Beoordelingen
- Gedragsklasse: topische anesthetica
- FDA Alerts (5)
Consumer resources
- Patient information
- Lidocaine Topical application (Advanced Reading)
Professional resources
- Voorschrijfinformatie
- Lidocaïne (topisch) (Professioneel patiëntenadvies)
- Lidocaïne Crème (FDA)
- Lidocaïne Gel (FDA)
- Lidocaïne Laryngotracheale Oplossing (FDA)
- … +9 meer
Andere merken Lidocaine Visous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 meer
Gerelateerde behandelingsgidsen
- Anale jeuk
- Gastro-intestinale chirurgie
- Anesthesie
- Burns, External
- … +9 meer
Medische disclaimer
