15.4 Fysische eigenschappen van carbonzuren
Leerdoelen
- Vergelijk de kookpunten van carbonzuren met die van alcoholen met een vergelijkbare molaire massa.
- Vergelijk de oplosbaarheid van carbonzuren in water met de oplosbaarheid van vergelijkbare alkanen en alcoholen in water.
Vele carbonzuren zijn kleurloze vloeistoffen met onaangename geuren. De carbonzuren met 5 tot 10 koolstofatomen hebben allemaal een “geitengeur” (dit verklaart de geur van Limburger kaas). Deze zuren worden ook geproduceerd door de inwerking van huidbacteriën op menselijke talg (huidoliën), wat de geur verklaart van slecht geventileerde kleedkamers. De zuren met meer dan 10 koolstofatomen zijn wasachtige vaste stoffen, en hun geur vermindert met toenemende molaire massa en de daaruit voortvloeiende afnemende vluchtigheid.
Carboxylic zuren vertonen een sterke waterstofbinding tussen moleculen. Daarom hebben zij een hoog kookpunt in vergelijking met andere stoffen met een vergelijkbare molaire massa.
De carboxylgroep gaat gemakkelijk een waterstofbrug aan met watermoleculen (figuur 15.3 “Waterstofbruggen tussen een azijnzuurmolecuul en watermoleculen”). De zuren met één tot vier koolstofatomen zijn volledig mengbaar met water. De oplosbaarheid neemt af naarmate de lengte van de koolstofketen toeneemt, omdat de dipoolkrachten minder belangrijk worden en de dispersiekrachten meer gaan overheersen. Hexaanzuur is nauwelijks oplosbaar in water (ongeveer 1,0 g/100 g water). Palmitinezuur, met zijn grote apolaire koolwaterstofcomponent, is in wezen onoplosbaar in water. De carbonzuren zijn over het algemeen wel oplosbaar in organische oplosmiddelen als ethanol, tolueen en diethylether.
Figuur 15.3 Waterstofbruggen tussen een azijnzuurmolecuul en watermoleculen
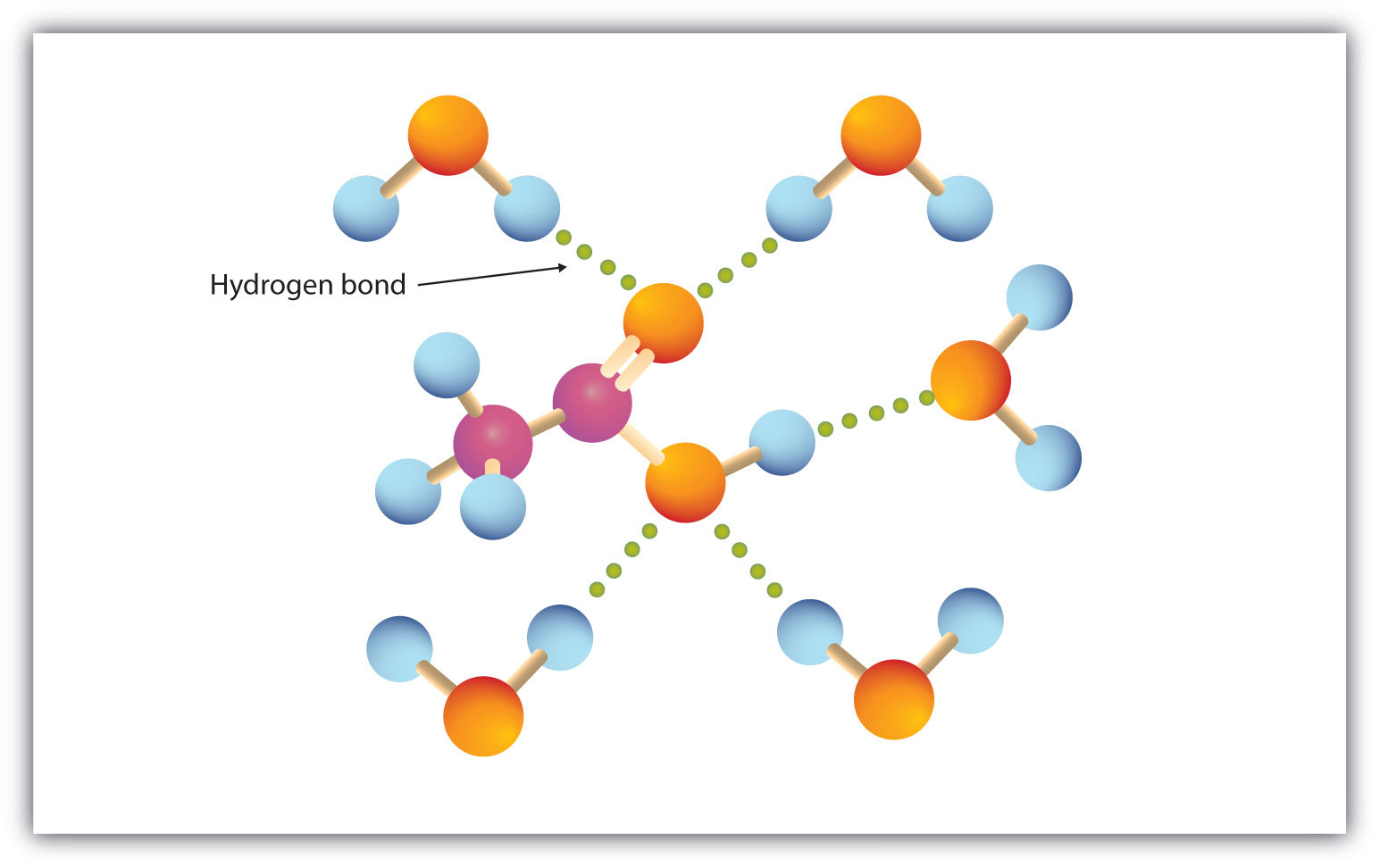
Carboxylzuren met een lage molaire massa zijn goed oplosbaar in water.
Tabel 15.2 “Fysische Constanten van Carboxylzuren” somt enkele fysische eigenschappen op voor geselecteerde carboxylzuren. De eerste zes zijn homologen. Merk op dat de kookpunten toenemen met toenemende molaire massa, maar de smeltpunten vertonen geen regelmatig patroon.
Tabel 15.2 Fysische Constanten van Carboxylzuren
| Gesamenvoegde structuurformule | Naam van het zuur | Smeltpunt (°C) | Kookpunt (°C) | Oplosbaarheid (g/100 g water) |
|---|---|---|---|---|
| HCOOH | forminezuur | 8 | 100 | mengbaar |
| CH3COOH | azijnzuur | 17 | 118 | mengbaar |
| CH3CH2COOH | propionzuur | -22 | 141 | mengbaar |
| CH3(CH2)2COOH | boterzuur | -5 | 163 | mengbaar |
| CH3(CH2)3COOH | valeriaanzuur | -35 | 187 | 5 |
| CH3(CH2)4COOH | caproïnezuur | -3 | 205 | 1.1 |
| C6H5COOH | benzoëzuur | 122 | 249 | 0.29 |
Oefeningen voor begripsherziening
-
Welke verbinding heeft het hogere kookpunt-butaanzuur (molaire massa 88) of 2-pentanon (molaire massa 86)? Leg uit.
-
Zou je verwachten dat boterzuur (butaanzuur) beter of minder goed oplosbaar is dan 1-butanol in water? Leg uit.
Antwoorden
-
boterzuur vanwege waterstofbinding (Er is geen intermoleculaire waterstofbinding in 2-pentanon.)
-
beter oplosbaar omdat er een uitgebreidere waterstofbrug is
Key Takeaways
- Carbonzuren hebben hoge kookpunten in vergelijking met andere stoffen van vergelijkbare molaire massa. Het kookpunt neemt toe met de molaire massa.
- Carboxylzuren met één tot vier koolstofatomen zijn volledig mengbaar met water. De oplosbaarheid neemt af met de molaire massa.
Oefeningen
-
Welke verbinding heeft het hogere kookpunt-CH3CH2CH2OCH2CH3 of CH3CH2CH2COOH? Leg uit.
-
Welke verbinding heeft het hogere kookpunt-CH3CH2CH2CH2OCH2OH of CH3CH2CH2COOH? Leg uit.
-
Welke verbinding is beter oplosbaar in water-CH3COOH of CH3CH2CH2CH3? Leg uit.
-
Welke verbinding is beter oplosbaar in water-CH3CH2COOH of CH3CH2CH2CH2COOH? Leg uit.
Antwoorden
-
CH3CH2CH2COOH vanwege waterstofbinding (Er is geen intermoleculaire waterstofbinding met CH3CH2CH2OCH2CH3.)
-
CH3COOH omdat het een waterstofbrug aangaat met water (Er is geen intermoleculaire waterstofbrug met CH3CH2CH2CH3.)
