De artsen zijn al lange tijd gefrustreerd over de onevenredige rol die intraoculaire druk (IOP) speelt bij de behandeling van glaucoom. Aangezien IOP de enige factor is die medisch of chirurgisch kan worden behandeld, is de rol ervan van vitaal belang. Maar tonometrie is van nature beperkt: Een enkele meting om de paar maanden geeft geen goed beeld van de dagelijkse eb en vloed van IOP. Zelfs het bijbrengen van patiënten voor meerdere tonometriemetingen geeft geen ideaal beeld van de IOP-kenmerken van de patiënt.

|
|
| Deze implanteerbare microfluïdische 24-uurs IOP-monitoringsensor wordt momenteel ontwikkeld aan de Stanford University. Foto: Ishmail E. Araci |
Deskundigen denken dat je patiënten uiteindelijk een piepkleine sensor kunt geven die op een contactlens of bril zit, of dat je ze naar een oogarts kunt sturen om er een in het oog te laten implanteren. Deze sensor zou continu de IOP meten, waardoor de hoeveelheid – en hopelijk ook de waarde – van de gegevens die u ontvangt, exponentieel zou toenemen. Als de huidige benadering van IOP-documentatie neerkomt op het maken van een momentopname, dan lijkt continue 24-uurs IOP-monitoring meer op het maken van een video die veranderingen in de loop van de tijd registreert in plaats van slechts één statische meting te geven.
Deze gadgets zijn nog in ontwikkeling. Zijn ze klaar voor prime time? Laten we eens kijken hoe IOP fluctueert, welke klinische uitdagingen dit met zich meebrengt en welke geavanceerde technologieën er momenteel zijn die IOP beter proberen te volgen om een beter klinisch begrip mogelijk te maken.
Een bewegend doel
Het opzetten van een behandelplan op basis van het bereiken van een IOP-doel is lastig als het doel zelf beweegt. IOP fluctueert in de loop van de dag – van uur tot uur, van minuut tot minuut en zelfs van seconde tot seconde – als gevolg van allerlei endogene en exogene factoren.
Binnen het oculaire systeem kan IOP afhangen van de balans van de productie van waterig vocht, uitstroomfaciliteit (hoe gemakkelijk waterig vocht het oog verlaat), episclerale veneuze druk (de druk in de aderen aan het oppervlak van het oog) en uveosclerale uitstroom (een secundaire route voor waterig vocht om het oog te verlaten).
Een toename van de uitstroomfaciliteit of een afname van de productie van kamervocht zou bijvoorbeeld de IOP verlagen, zegt Arthur J. Sit, MD, een glaucoomonderzoeker aan de Mayo Clinic in Rochester, Minn. Kortdurende sprongen in IOP kunnen ook optreden door druk op het oog als gevolg van knipperen of wrijven met het oog of zelfs tijdens oogbewegingen of bloeddrukpulsaties.
Intraoculaire druk schommelt ook als gevolg van lichaamshouding, tijdstip van de dag (pieken ’s nachts, dalen overdag), bloeddruk en het daarmee samenhangende begrip oculaire perfusiedruk (OPP), stress- of pijnniveaus, water- en cafeïneconsumptie.
Verder kunnen krachtige activiteit en stress de bloeddruk, IOP en OPP doen pieken, zegt Kaweh Mansouri, MD, MPH, een oogarts aan de Universiteit van Genève en de Universiteit van Colorado Denver. Het meten van de bloeddruk in combinatie met de IOP heeft waarde om te bepalen hoe de bloeddruk de IOP beïnvloedt, aldus Dr. Mansouri. Onderzoekers gebruiken momenteel 24-uurs IOP-monitoringapparatuur om deze effecten op de progressie van glaucoom te onderzoeken.
|
Dos and Don’ts of IOP Measurement Stel geen diagnose en behandel niet na slechts één meting. Dr. Sowka adviseert optometristen om niet meteen met behandelen te beginnen, tenzij de druk buitensporig hoog is of de oogzenuwen al ernstig beschadigd en kwetsbaar zijn; meet in plaats daarvan de druk meerdere keren. Het is ook een goed idee om na het begin van de behandeling een aantal drukmetingen te doen om te bepalen of de medicatie werkt, aldus Dr. Sowka. Eén IOP-meting na het starten van een medicijn is echt niet genoeg om de echte werkzaamheid te beoordelen. Leg patiënten uit dat ze zich moeten ontspannen. Zoals eerder gezegd, kunnen patiënten zich tijdens de tonometrie inspannen of hun adem inhouden. Vertel hen regelmatig om te ontspannen en normaal te ademen tijdens het proces, dringt Dr. Mansouri aan. Laat uw argwaan niet varen. Als de IOP-metingen van de patiënt niet lijken te kloppen met uw gezichtsveld- en oogzenuwbeoordelingen, is er misschien meer aan de hand met de IOP van de patiënt dan u zich realiseert, zegt Dr. Hartwick. Laat ze terugkomen en hun IOP op een ander moment van de dag meten, voegt hij eraan toe. Ontdek een dagcurve bij geselecteerde patiënten. Een dagcurve tonometrisch opnemen is voor de meeste patiënten onpraktisch en vervelend. Maar als het niveau van de IOP en de omvang van de schade ongerijmd lijken – bijvoorbeeld wanneer u normaal spanningsglaucoom vermoedt – kunt u de mogelijkheid overwegen, aldus Dr. Davey. Als de patiënt ermee instemt, kunt u hem ’s morgens vroeg binnenbrengen en acht tot tien uur lang elk uur de IOP registreren. “Dat geeft je de dagcurve van het kantoor, die misschien niet helemaal representatief is voor de dag/nachtwaarden, maar het geeft je in ieder geval meer dan één meting”, zegt hij. |
Hier ziet u hoe deze variabelen IOP beïnvloeden:
– Lichaamspositie. Afhankelijk van de positie van de patiënt in de stoel, kan de druk toe- of afnemen. De IOP is bijvoorbeeld het laagst wanneer de patiënt in een neutrale houding zit. “Bijna alles zorgt ervoor dat de IOP toeneemt, zoals het naar voren buigen van de nek, het hoofd naar achteren buigen, het hoofd opzij draaien, gaan liggen, voorover buigen, knipperen of in de ogen wrijven”, aldus dr. Sit.
– Waterconsumptie. Het drinken van een grote hoeveelheid water zorgt ervoor dat het bloedvolume van de patiënt voor korte tijd toeneemt. De veneuze druk gaat ook omhoog als de patiënt meer water consumeert. “Het enige wat ze hoeven te doen is 16 tot 32oz drinken, wat neerkomt op een of twee kleine flessen water, en binnen vijf minuten is de druk met 6 mm Hg gestegen,” zegt Pinakin Gunvant Davey, PhD, OD, professor en glaucoomdeskundige aan het College of Optometry van de Western University of Health Sciences in Pomona, Calif.
– Tijdstip van de dag. Uit de literatuur blijkt dat bij tweederde van de patiënten de IOP-piek ’s nachts optreedt. De reden: ’s nachts wordt er te weinig waterachtig vocht afgescheiden, zegt Joseph Sowka, OD, professor in de optometrie aan de Nova Southeastern University College of Optometry in Ft. Lauderdale, Fla.
Zo observeerde dr. Mansouri patiënten 24 uur lang in slaaplaboratoria en ontdekte dat de IOP’s ’s nachts het hoogst waren. Ook al worden uw patiënten niet onderworpen aan slaaponderzoeken, toch kunnen ze ’s avonds naar uw praktijk komen – en als dat het geval is, verwacht dan dat ze verhoogde IOP’s zien in vergelijking met andere tijdstippen van de dag.
– Bloeddruk. De basislijn IOP is gebaseerd op de hartcyclus, de systolische en de diastolische bloeddruk. De kracht die wordt gebruikt om bloed in het oog te brengen is de oogperfusiedruk, legt James L. Fanelli, OD, van het Cape Fear Eye Institute in Wilmington, NC uit.
Als de bloeddruk laag is, is er minder kracht om bloed in het oog te “duwen”, en dus minder perfusiedruk voor het oog. Factoren die de IOP doen stijgen, hebben een effect op de verlaging van de perfusiedruk, en factoren die de bloeddruk verlagen, resulteren ook in een lagere perfusiedruk – of een combinatie van al deze factoren kan een rol spelen, aldus Dr. Fanelli. De bloeddruk heeft de neiging om te dalen tijdens de slaapuren in de vroege ochtend, wat ook het moment van de dag is waarop IOP de neiging heeft het hoogst te zijn.1 Deze twee tegengestelde factoren kunnen een dubbel effect hebben in het verlagen van de OPP tijdens de nachtelijke uren, waardoor verhoogde schade aan de oogzenuwkop mogelijk is.
– Stress. Een toename of afname van stress veroorzaakt hormonale veranderingen die het IOP-niveau omhoog of omlaag duwen. Bij een van de patiënten van Dr. Mansouri, die werd onderzocht met behulp van een 24-uurs IOP-monitoring sensor op een contactlens, traden drukpieken op wanneer haar hond ’s nachts epileptische aanvallen had.
– Algemene “zenuwen.” Het is mogelijk dat bij sommige patiënten de stress van het oogonderzoek zelf – bijvoorbeeld als ze zich zorgen maken over de diagnose glaucoom – hun IOP doet stijgen, zegt Andrew Hartwick, OD, PhD, universitair hoofddocent aan de Ohio State University College of Optometry in Columbus. Ze kunnen bijvoorbeeld hun ogen dichtknijpen omdat ze gestrest zijn over het onderzoek, waardoor de IOP-metingen een piek vertonen.
– Pijn veroorzaakt ook pieken in de IOP, omdat het stress veroorzaakt. Een patiënte van dr. Mansouri stootte haar been op een parkeerplaats. Er was een piek in haar IOP-niveau precies op het moment dat ze zich herinnerde dat haar ongeluk plaatsvond, volgens de 24-uurs monitoringgegevens.
Gevolgen van onnauwkeurige IOP-metingen
Uit onderzoek is gebleken dat pieken in IOP kunnen bijdragen aan de progressie van glaucoom.2,3 Maar als u een patiënt onderzoekt wanneer IOP het laagst of het hoogst is, kunt u de diagnose glaucoom of de behandeling die voor de patiënt nodig is, overschatten of onderschatten.
“Als we een patiënt op een dieptepunt pakken, waar de IOP het laagst is, kan dat ons ervan afbrengen om glaucoom te overwegen,” vooral als de meting binnen een statistisch normaal bereik valt, zegt Dr. Sowka. “Andere keren krijgen we ze op een IOP-piek, waarbij de IOP iets boven normaal is – een scenario dat artsen de neiging geeft zich nodeloos zorgen te maken.”
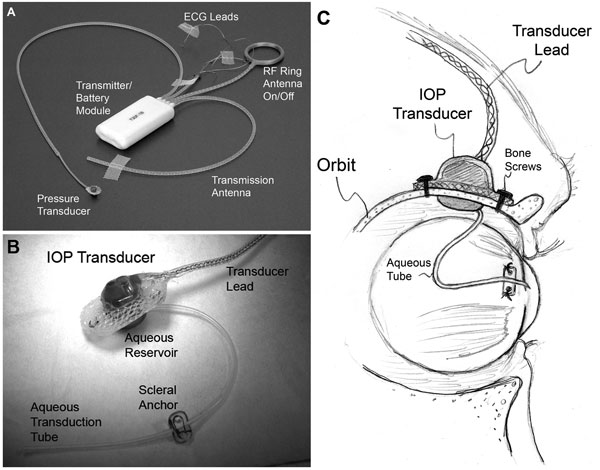
|
|
| (A) Een typisch T30F totaal implantaatsysteem (Konigsberg Instruments). (B) Het extraorbitale oppervlak van de aangepaste IOP-transducerbehuizing. (C) Een 23-gauge siliconen slangetje levert water uit de voorste oogkamer aan een vloeistofreservoir aan de intraorbitale zijde van de transducer (gedeeltelijk aan het oog onttrokken in B); het slangetje (met de nodige speling om oogbewegingen mogelijk te maken) werd bijgesneden en in de voorste oogkamer ingebracht. |
Het registreren van een IOP-bereik zou mogelijk verbetering kunnen brengen in glaucoomdiagnose en -beheer. “Als onderzoekers kunnen aantonen dat specifieke 24-uurs IOP-patronen verband houden met de progressie van glaucoom, dan is er hoop dat het detecteren van deze patronen zou kunnen helpen bij het identificeren van patiënten met een verhoogd risico op progressie en ons in staat zou stellen hun behandeling dienovereenkomstig aan te passen”, aldus Dr. Mansouri.
Glaucoom zou eerder kunnen worden geïdentificeerd, waardoor sneller met chirurgie of medicatie zou kunnen worden begonnen, voegt hij eraan toe. Oogartsen zouden ook kunnen bepalen of IOP-verlagende medicijnen effectief zijn ’s nachts of tijdens specifieke activiteiten die de IOP verhogen.
Om een echt IOP-bereik vast te stellen, zou de IOP 24 uur per dag continu in de gaten moeten worden gehouden. Dit is een uitdaging, omdat een enkele IOP-meting tijdens normale kantooruren niet het bereik van de IOP van een patiënt, de pieken of de veranderingen gedurende de dag vastlegt.4
Op dit moment is het mogelijk om het IOP-bereik te bepalen met behulp van Goldman applanatietonometrie (GAT) via een dagspanningscurve (DTC), waarbij de IOP-metingen op verschillende tijdstippen tijdens de kliniekuren worden vastgelegd. Dit is echter problematisch voor zowel de arts als de patiënt. Nachtelijke curven worden niet geregistreerd, en minder dan 1% van de patiënten ondergaat een DTC of IOP-monitoring in een slaaplaboratorium.4
Onderzoekers hebben de IOP gedurende 24 uur gemeten en niet alleen gedocumenteerd dat de IOP ’s nachts pieken vertoont, maar ook dat de IOP-schommelingen veel groter zijn tijdens uren buiten de kantooruren.5 In een onderzoek bij 35 patiënten van wie de IOP gedurende 24 uur met een pneumatonometer in een slaaplaboratorium werd geregistreerd, werden bij oudere glaucoompatiënten de meeste piek IOP’s ’s nachts geregistreerd in vergelijking met gezonde mensen, of ze nu zaten of lagen.6
Meer recent hebben onderzoekers die 24-uurs monitoring gebruikten, geleerd dat de gemiddelde IOP niet alleen ’s nachts stijgt, maar in feite voortdurend piekt – overdag meer dan ’s nachts.7 Onderzoekers van het Devers Eye Institute in Portland, Ore, gebruikten een telemetriesysteem dat in apenogen was geïmplanteerd om 500 IOP-metingen per seconde op te nemen.
Zij ontdekten dat IOP veel meer fluctueert dan eerder werd aangenomen. “Knipperen en oogbewegingen genereren grote IOP-pieken die ongeveer 12.000 keer per uur voorkomen en ongeveer 12% vormen van de totale IOP-energie die het oog tijdens de wakkere uren moet absorberen,” ontdekten de onderzoekers. Zij denken dat deze gegevens bij apen ongeveer hetzelfde zullen zijn bij mensen. “IOP moet nu worden gezien als dynamisch en voortdurend veranderend, en IOP-fluctuaties kunnen een belangrijke factor blijken te zijn bij glaucoom. “8
Zij ontdekten ook dat de dagcyclus zich niet van dag tot dag herhaalt. Vandaar de noodzaak van continue IOP-bewaking. De huidige prototypes omvatten geïmplanteerde sensoren en op contactlenzen gebaseerde apparaten.
Intelligent Implantables
Een aantal startende bedrijven heeft telemetrische druksensoren ontwikkeld die tijdens cataract- of glaucoomchirurgie kunnen worden geïmplanteerd. “Telemetrisch betekent dat de drukwaarden op afstand worden gemeten (d.w.z. van binnen het oog) en draadloos worden doorgegeven aan een externe lezer”, zegt Dr. Sit.
Implanteerbare apparaten die momenteel worden bestudeerd zijn onder meer:

|
|
|
De Pro-IOP Sensor is een telemetrisch apparaat dat wordt geïmplanteerd als een IOL. Foto: Implandata Ophthalmic Products GmbH |
– Pro-IOP. Het in Duitsland gevestigde Implandata Ophthalmic Products werkt aan de Pro-IOP, een draadloze intraoculaire drukomvormer (WIT) die telemetrisch wordt gevoed door een met de hand vast te houden apparaat. De WIT lijkt op een piepkleine plastic ring en heeft een diameter van 11,3 mm.9 Hij bevat druksensoren, een temperatuursensor, een identificatie-encoder, een analoog-digitaal-encoder en een telemetrie-eenheid in één enkel micro-elektromechanisch systeem.9
Een RFID-chip met een ingebouwde antenne zendt 24 uur per dag IOP-metingen uit naar een externe handuitleesapparaat. De patiënt en de arts kunnen de gegevens op termijn ook via een smartphone-app ontvangen. De patiënt zou ook met de arts kunnen communiceren over IOP-metingen op de app.
Het apparaat heeft nog geen CE-keurmerk in Europa of FDA-goedkeuring in de VS, maar onderzoekers in Duitsland hebben onlangs de Pro-IOP ingebracht in de eerste menselijke proefpersoon, een vrouw in de 60; er zijn nog geen gegevens gepubliceerd.9
– AcuMEMs. De AcuMEMs, een implantaat dat door een Amerikaans bedrijf met dezelfde naam wordt ontwikkeld, functioneert op soortgelijke wijze als de Pro-IOP. De sensor is een capacitieve druksensor die van vorm verandert bij schommelingen in de IOP. “Wanneer hij van vorm verandert, verandert de elektrische capaciteit en dit kan extern worden gedetecteerd met de lezer,” zegt Dr. Sit.
De sensor kan worden geïmplanteerd in de voorste kamer als een op zichzelf staande procedure of als onderdeel van glaucoomchirurgie; het kan ook worden ingebracht in de capsulaire zak tijdens cataractchirurgie.
– Microfluïdisch IOL implantaat. Onderzoekers van de Stanford University en de Bar-Ilan University in Israël werken samen aan de ontwikkeling van een implanteerbare microfluïdische sensor. IOP zou worden gemeten “op basis van een vastgestelde evenwichtsdrukinterface tussen een intraoculaire vloeistof en gas” die zich in kamers in de sensor bevinden, aldus het octrooi op het apparaat. Patiënten en artsen zouden hun smartphones of een externe lezer kunnen gebruiken om hun IOP te controleren.10 De uitvinders wachten op octrooi-goedkeuring voor de sensor.
Het signaal dat wordt uitgezonden door apparaten die in het oog zijn geïmplanteerd, kan in theorie nauwkeuriger zijn dan die welke aan contactlenzen zijn bevestigd, zegt Dr. Davey. De sterkte van het signaal hangt af van de hoeveelheid energie die het apparaat afgeeft. “We hebben beide apparaten geïmplanteerd (Pro-IOP en AcuMEMs) en ze werkten niet zo goed,” zegt Dr. Davey.
Zowel de Pro-IOP- als de AcuMEMs-lezers zouden mogelijk aan een bril kunnen worden bevestigd, en de gegevens zouden op dezelfde manier worden verzameld, zegt Dr. Sit.
Clever Contactlenzen
Onderzoekers onderzochten voor het eerst contactlenssensoren in de jaren zeventig, maar de beschikbare harde contactlenzen waren te ongemakkelijk en veranderden de structurele integriteit van het oog van de patiënt, volgens Dr. Davey.
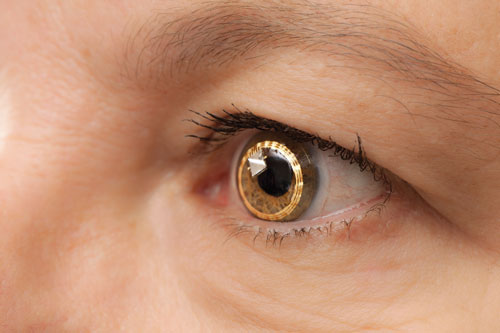
|
|
| De Sensimed Triggerfish op het oog. Het wordt nog steeds klinisch getest in de VS. |
De sensoren waren ook niet gevoelig genoeg. “De persoon met een ‘zachter’ oog had nauwkeurigere metingen dan een persoon met een stijver oog,” zegt Dr. Davey. “De technologie was niet goed genoeg om IOP-waarden te verkrijgen.” Een dikker hoornvlies reageert minder snel op IOP-veranderingen, waardoor tonometrie (en contactlenssensoren) minder nauwkeurig zijn.
Contactlensgebaseerde IOP-sensoren zijn onder andere:
– De Triggerfish (Sensimed). Aan de Universiteit van Genève in Zwitserland hebben oogartsen onder leiding van dr. Mansouri en anderen een eerste onderzoek verricht naar een contactlens met de naam Triggerfish.
De Triggerfish is een hydrofiele zachte contactlens voorzien van een contactlenssensor (CLS). De CLS heeft twee rekstrookjes rond de limbus die veranderingen in de omtrek van de oogbol detecteren. “Er wordt aangenomen dat deze veranderingen in de omtrek van de oogbol verband houden met veranderingen in IOP en intraoculair volume, en dit is bewezen in geënucleerde ogen,” zegt Dr. Mansouri. Het apparaat meet een mengsel van IOP, intraoculair volume en veranderingen in biomechanische eigenschappen (een combinatie van hoornvlies- en sclerale hysterese en stijfheid) die correleren met schommelingen in IOP. Een externe lezer registreert de gegevens over een periode van 24 uur.
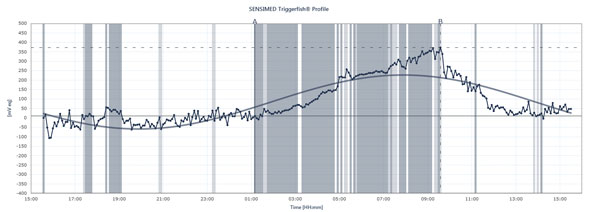
Het stroomdiagram toont de pieken en dalen van de IOP bij een patiënt die de Sensimed Triggerfish gedurende een periode van 24 uur draagt.
De Triggerfish is in Europa goedgekeurd met een CE-markering. In de VS is nog geen goedkeuring van de FDA verkregen en het apparaat wordt nog steeds klinisch getest.
|
Triggerfish traceert IOP anders De gegevens die worden weergegeven op de externe lezer zijn een combinatie van intraoculaire druk, intraoculair volume en biomechanische eigenschappen van het oog, legt Dr. Mansouri uit. “Het is nuttig om u een idee te geven van de kwalitatieve veranderingen gedurende 24 uur, meer dan de kwantitatieve veranderingen, omdat we ze niet kunnen vertalen in millimeters kwik,” zegt hij. De Triggerfish biedt niettemin waardevolle informatie. Toekomstige studies met behulp van het apparaat zouden kunnen helpen verklaren hoe instabiel of stabiel de druk gedurende 24 uur is geweest, wanneer nachtelijke IOP-pieken optreden, hoe het invoeren van behandeling of veranderingen in de behandeling 24-uurs IOP-patronen beïnvloedt en hoe specifieke activiteiten 24-uurs IOP-patronen beïnvloeden, zoals yogahoudingen, cafeïne-inname, stressvolle situaties en andere oorzaken van IOP-pieken die hierboven zijn beschreven. Dr. Mansouri laat ook normale of glaucoompatiënten met lage spanning gelijktijdig 24-uurs bloeddruk- en 24-uurs IOP-monitoring ondergaan, omdat pieken van invloed kunnen zijn op de OPP. Maar zal de Triggerfish een correlatie aantonen tussen 24-uurs IOP-patronen en glaucoomprogressie? Er zijn veel studies aan de gang om deze essentiële vraag te beantwoorden.
|
– Resonantiecircuitsensor contactlens. Een ander slim CLS-apparaat in ontwikkeling is een resonantiecircuit dat bestaat uit een condensator met dunne film in combinatie met een sensorspoel die vervorming van de corneale kromming detecteert. Het is in de vroege stadia van ontwikkeling onder David C.C. Lam aan het Department of Mechanical and Aerospace Engineering aan de Hong Kong University of Science and Technology.
In een studie van september 2014 werd de CLS getest op een siliconenrubber oogmodel. De sensor bleek fluctuerende IOP nauwkeurig te volgen.11
Zoals het eenmaal per dag meten van glucosespiegels voor patiënten met diabetes of de bloeddruk eenmaal per dag voor hartpatiënten, kan het vertrouwen op één IOP-meting leiden tot foutieve IOP-gegevens. Maar misschien kunt u in de niet al te verre toekomst met apparaten die zo uit een sciencefictionfilm komen – contactlenzen en implanteerbare sensoren – de IOP beter in de gaten houden, met meer inzicht en minder gedoe voor u en uw patiënten.
1. Liu JH1, Gokhale PA, Loving RT, Kripke DF, Weinreb RN. Laboratory assessment of diurnal and nocturnal ocular perfusion pressures in humans. J Ocul Pharmacol Ther. 2003 Aug;19(4):291-7.
2. Zeimer RC, Wilensky JT, Gieser DK, Viana MA. Association between intraocular pressure peaks and progression of visual field loss. Ophthalmology. 1991 Jan;98(1):64-69.
3. Konstas AG, Quaranta L, Mikropoulos DG, et al. Peak Intraocular Pressure and Glaucomatous Progression in Primary Open-Angle Glaucoma. J Ocul Pharmacol Ther. 2012 Feb;28(1):26-32.
4. Mansouri K, Weinreb RN, Medeiros FA. Is 24-uurs intraoculaire drukcontrole noodzakelijk bij glaucoom? Semin Opthalmol. Mei 2013: 28(3):157-164.
5. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Clinical utility of intraocular pressure monitoring outside of normal office hours in patients with glaucoma. Arch Ophthalmol. 2006 Jun;124(6):793-7.
6. Mosaed S, Liu H, Weinreb RN. Correlation between peak nocturnal intraocular pressures in healthy subjects and glaucoma patients. Am J Ophthalmol. 2005; Feb;139(2):320-4.
7. Downs JC, Burgoyne CF, Seigfreid WP, et al. 24-hour IOP telemetry in the nonhuman primate: implant system performance and initial characterization of IOP at multiple timescales. Invest Ophthalmol Vis Sci. 2011 Sep 21;52(10):7365-75.
8. Association for Research in Vision and Ophthalmology: Opkomende trends en hot topics. Gepresenteerd op maandag 5 mei 2014 tijdens de ARVO Annual Meeting. Beschikbaar op: www.arvo.org/About_ARVO/Press_Room/Emerging_Trends_and_hot_topics__Presented_Monday,_May_5_at_the_ARVO_Annual_Meeting. Accessed Nov 19, 2014.
9. Melki S, Todani A, Cherfan G. An Implantable Intraocular Pressure Transducer Initial Safety Outcomes. JAMA Ophthalmol. 2014 Oct 1;132(10):1221-5.
10. Mandel Y, Araci IE, Quake SR. Google Patents. Implanteerbaar micro-fluïdisch apparaat voor het monitoren van de intra-oculaire druk. Beschikbaar op: www.google.com/patents/WO2014137840A1?cl=en. Accessed October 17, 2014.
11. Chen GZ, Chan IS, Leung LK, Lam DC. Zachte draagbare contactlenssensor voor continue intraoculaire drukmonitoring. Med Eng Phys. 2014 Sep;36(9):1134-9.
12. Mottet B, Aptel F, Romanet JP, et al. 24-hour intraocular pressure rhythm in young healthy subjects evaluated with continuous monitoring using a contact lens sensor. JAMA Ophthalmol. 2013 Dec;131(12):1507-16.
