 |
|
Zuur-base-reacties zijn alomtegenwoordig. In waterige oplossingen verhogen zuren de waterstofionenconcentratie (H+). Aan de andere kant verhogen basen de concentratie hydroxide-ionen (OH-). Wanneer een zuur en een base in een waterige oplossing reageren, vormen de H+ en OH- ionen samen water. Deze ionen “neutraliseren” elkaar dus:
De meeste zuren hebben de algemene formule HA, waarbij A- een anion is, en de meeste basen hebben de vorm BOH, waarbij B+ een geschikt kation is. Zuren en basen kunnen worden ingedeeld in twee algemene typen: sterke en zwakke zuren en basen. Het verschil tussen beide is eenvoudig: een sterk zuur in een wateroplossing ontleedt 100% in een proton (H+) en een anion (A-)
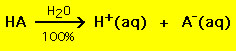
De meeste zwakke zuren daarentegen ontleden aanzienlijk minder dan 100% in een wateroplossing:
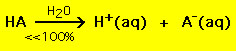 .
.Met andere woorden: de meeste zwakke zuurmoleculen blijven intact in water. Vergelijkbare chemische vergelijkingen gelden voor sterke en zwakke basen.
Er zijn maar een paar zwakke zuren en basen, dat zijn:
| |
|
|
HCl (zoutzuur) HNO3 (salpeterzuur) HClO4 (perchloorzuur) H2SO4 (zwavelzuur) |
NaOH (natriumhydroxide) KOH (kaliumhydroxide) Ca(OH)2 (calciumhydroxide) |
Alle andere zuren en basen zijn zwak. Een zwak zuur ontstaat uit elk anion. Hieronder staan voorbeelden
| |
|
|
F- (fluoride) Br- (bromide) I- (jodide) HCO3- (bicarbonaat) I- (jodide) HCO3- (bicarbonaat) |
Zwak zuur. (bicarbonaat)
C2H3O2- (acetaat)
MnO4- (permanganaat)
PO4-3 (fosfaat)
CrO4-2 (chromaat)
CN- (cyanide)
NO2- (nitriet)
SO3-2 (sulfiet)
HF (fluorwaterstofzuur)
HBr (broomwaterstofzuur)
HI (joodwaterstofzuur)
H2CO3 (koolzuur)
HC2H3O2 (azijnzuur)
HMnO4 (permangaanzuur)
H3PO4 (fosforzuur)
H3PO4 (fosforzuur)
H3PO4 (permangaanzuur)
. fosforzuur)
H2CrO4 (chroomzuur)
HCN (blauwzuur)
HNO2 (salpeterzuur)
H2SO3 (zwavelzuur)
In een typische zuur/base-reactie reageren het zuur en de base om een zout en water te vormen, bijv.g., waterstofcyanide en natriumhydroxide:
