Leerresultaten
- Definieer de octetregel en zijn rol in chemische bindingen
Niet alle elementen hebben genoeg elektronen om hun buitenste schillen te vullen, maar een atoom is het meest stabiel als alle elektronenposities in de buitenste schil gevuld zijn. Vanwege deze lege plekken in de buitenste schillen zien we de vorming van chemische bindingen, of interacties tussen twee of meer van dezelfde of verschillende elementen die resulteren in de vorming van moleculen. Om een grotere stabiliteit te bereiken, zullen atomen de neiging hebben hun buitenste schillen volledig te vullen en zullen zij zich binden met andere elementen om dit doel te bereiken door elektronen te delen, elektronen van een ander atoom aan te nemen of elektronen aan een ander atoom af te staan. Omdat de buitenste schillen van de elementen met lage atoomnummers (tot en met calcium, met atoomnummer 20) acht elektronen kunnen bevatten, wordt dit de octetregel genoemd. Een element kan elektronen afstaan, accepteren of delen met andere elementen om zijn buitenste schil te vullen en aan de octet-regel te voldoen.
Een vroeg model van het atoom werd in 1913 ontwikkeld door de Deense wetenschapper Niels Bohr (1885-1962). Het Bohr-model toont het atoom als een centrale kern met protonen en neutronen, met de elektronen in cirkelvormige elektronenschillen op specifieke afstanden van de kern, vergelijkbaar met planeten die rond de zon draaien. Elke elektronenschil heeft een verschillend energieniveau, waarbij de schillen die zich het dichtst bij de kern bevinden een lagere energie hebben dan de schillen die zich verder van de kern bevinden. Volgens afspraak krijgt elke schil een nummer en het symbool n – de elektronenschil die zich het dichtst bij de kern bevindt, heet bijvoorbeeld 1n. Om van de ene schil naar de andere te gaan, moet een elektron een hoeveelheid energie opnemen of afstaan die precies overeenkomt met het verschil in energie tussen de schillen. Als een elektron bijvoorbeeld energie absorbeert van een foton, kan het geëxciteerd raken en naar een hogere energieschil gaan; omgekeerd, als een geëxciteerd elektron terugvalt naar een lagere energieschil, zal het energie afgeven, vaak in de vorm van warmte.
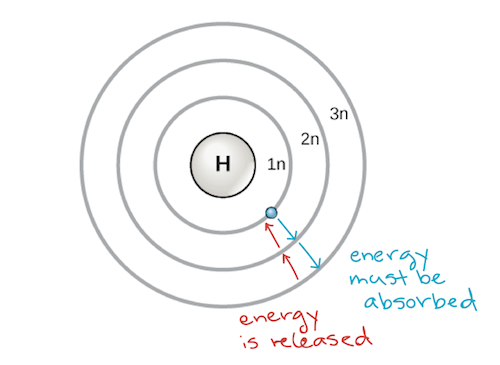
Bohr-model van een atoom, met energieniveaus als concentrische cirkels rond de kern. Er moet energie worden toegevoegd om een elektron naar buiten naar een hoger energieniveau te verplaatsen, en er komt energie vrij wanneer een elektron van een hoger energieniveau naar een lager energieniveau daalt. Beeldcredit: aangepast van OpenStax Biology
Atomen hebben, net als andere dingen die door de wetten van de fysica worden beheerst, de neiging om de meest stabiele configuratie met de laagste energie aan te nemen die ze kunnen aannemen. De elektronenschillen van een atoom worden dus van binnen naar buiten gevuld, waarbij de elektronen de laagenergetische schillen dichter bij de kern vullen voordat zij naar de verder weg gelegen hogere-energetische schillen gaan. De schil het dichtst bij de kern, 1n, kan twee elektronen bevatten, terwijl de volgende schil, 2n, er acht kan bevatten, en de derde schil, 3n, tot achttien.
Het aantal elektronen in de buitenste schil van een bepaald atoom bepaalt zijn reactiviteit, of de neiging om chemische bindingen te vormen met andere atomen. Deze buitenste schil staat bekend als de valentieschil, en de elektronen erin worden valentie-elektronen genoemd. In het algemeen zijn atomen het meest stabiel, het minst reactief, wanneer hun buitenste elektronenschil vol is. De meeste elementen die belangrijk zijn in de biologie hebben acht elektronen in hun buitenste schil nodig om stabiel te zijn, en deze vuistregel staat bekend als de octetregel. Sommige atomen kunnen stabiel zijn met een octet, ook al is hun valentieschil de 3n schil, die tot 18 elektronen kan bevatten. We zullen de reden hiervoor onderzoeken wanneer we hieronder elektronenbanen bespreken.
Voorbeelden van enkele neutrale atomen en hun elektronenconfiguraties staan hieronder. In deze tabel kunt u zien dat helium een volledige valentieschil heeft, met twee elektronen in de eerste en enige schil (1n). Evenzo heeft neon een volledige buitenste 2n schil met acht elektronen. Deze elektronenconfiguraties maken helium en neon zeer stabiel. Hoewel argon technisch gezien geen volledige buitenste schil heeft, omdat de 3n schil tot achttien elektronen kan bevatten, is het net als neon en helium stabiel omdat het acht elektronen in de 3n schil heeft en dus voldoet aan de octet-regel. Chloor daarentegen heeft slechts zeven elektronen in zijn buitenste schil, terwijl natrium er slechts één heeft. Deze patronen vullen de buitenste schil niet en voldoen niet aan de octet-regel, waardoor chloor en natrium reactief zijn en graag elektronen willen winnen of verliezen om een stabielere configuratie te bereiken.
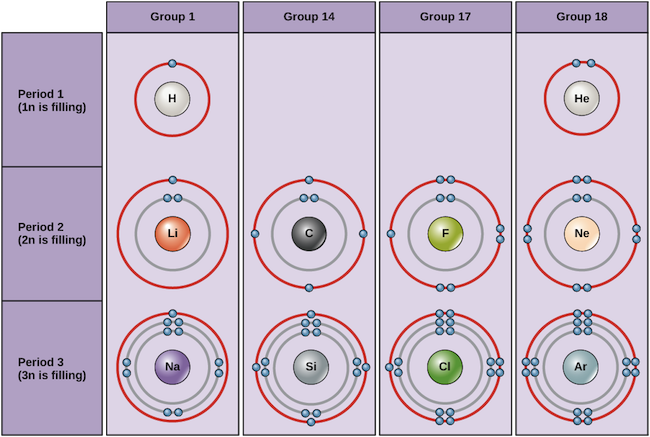
Bohr-diagrammen van verschillende elementen Image credit: OpenStax Biology
Elektronenconfiguraties en het periodiek systeem
Elementen worden in volgorde op het periodiek systeem geplaatst op basis van hun atoomnummer, het aantal protonen dat ze hebben. In een neutraal atoom is het aantal elektronen gelijk aan het aantal protonen, zodat we het aantal elektronen gemakkelijk kunnen bepalen uit het atoomnummer. Bovendien geeft de positie van een element in het periodiek systeem – zijn kolom, of groep, en rij, of periode – nuttige informatie over hoe die elektronen zijn gerangschikt.
Als we alleen naar de eerste drie rijen van de tabel kijken, die de belangrijkste elementen bevatten die belangrijk zijn voor het leven, komt elke rij overeen met de vulling van een andere elektronenschil: helium en waterstof plaatsen hun elektronen in de 1n schil, terwijl elementen van de tweede rij, zoals Li, beginnen met het vullen van de 2n schil, en elementen van de derde rij, zoals Na, verder gaan met de 3n schil. Op dezelfde manier geeft het kolomnummer van een element informatie over het aantal valentie-elektronen en de reactiviteit. In het algemeen is het aantal valentie-elektronen hetzelfde binnen een kolom en neemt het toe van links naar rechts binnen een rij. Elementen van groep 1 hebben slechts één valentie-elektron en elementen van groep 18 hebben er acht, behalve helium, dat in totaal slechts twee elektronen heeft. Het groepnummer is dus een goede voorspeller van hoe reactief elk element zal zijn:
- Helium (He), neon (Ne), en argon (Ar), als groep 18 elementen, hebben buitenste elektronschillen die vol zijn of voldoen aan de octet regel. Dit maakt ze zeer stabiel als afzonderlijke atomen. Omdat ze niet reactief zijn, worden ze de inerte gassen of edelgassen genoemd.
- Waterstof (H), lithium (Li), en natrium (Na), als groep 1 elementen, hebben slechts één elektron in hun buitenste schillen. Zij zijn onstabiel als afzonderlijke atomen, maar kunnen stabiel worden door hun ene valentie-elektron te verliezen of te delen. Als deze elementen volledig een elektron verliezen – zoals Li en Na gewoonlijk doen – worden ze positief geladen ionen: Li+, Na+.
- Fluor (F) en chloor (Cl), als groep 17 elementen, hebben zeven elektronen in hun buitenste schillen. Zij hebben de neiging een stabiel octet te bereiken door een elektron van andere atomen over te nemen, waardoor zij negatief geladen ionen worden: F- en Cl-.
- Koolstof (C), als groep 14-element, heeft vier elektronen in zijn buitenste schil. Koolstof deelt gewoonlijk elektronen om een volledige valentieschil te verkrijgen, en vormt bindingen met meerdere andere atomen.
Dus geven de kolommen van het periodiek systeem het aantal elektronen weer dat in de valentieschil van elk element wordt gevonden, wat op zijn beurt bepaalt hoe het element zal reageren.
Probeer het
Bijdragen!
Verbeter deze paginaLees meer
