Los clínicos llevan mucho tiempo frustrados por el papel desproporcionado que desempeña la presión intraocular (PIO) en el cuidado del glaucoma. Como único factor susceptible de intervención médica o quirúrgica, su papel es vital. Sin embargo, la tonometría es intrínsecamente limitada: Una única lectura tomada cada pocos meses no puede reflejar el flujo y reflujo diurno de la PIO. Ni siquiera el hecho de llevar a los pacientes a varias lecturas de tonometría proporciona una idea ideal de las características de la PIO del paciente.

|
|
| Este sensor implantable de monitorización de la PIO durante las 24 horas del día se está desarrollando actualmente en la Universidad de Stanford. Foto: Ishmail E. Araci |
Los expertos creen que con el tiempo se colocará a los pacientes un diminuto sensor alojado en una lente de contacto o un par de gafas, o se les enviará a un oftalmólogo para que les implante uno en el ojo. Este sensor mediría continuamente la PIO, aumentando exponencialmente la cantidad -y, con suerte, el valor- de los datos que se reciben. Si el enfoque actual de la documentación de la PIO es como tomar una instantánea, la monitorización continua de la PIO durante 24 horas es más parecida a la captura de un vídeo que registra los cambios a lo largo del tiempo en lugar de ofrecer una sola lectura estática.
Estos aparatos están todavía en desarrollo. ¿Están listos para la hora de la verdad? Echemos un vistazo a cómo fluctúa la PIO, a los retos clínicos que crea y a las actuales tecnologías de vanguardia que intentan hacer un mejor seguimiento de la PIO para permitir una mayor comprensión clínica.
Un objetivo en movimiento
Establecer un plan de tratamiento basado en la consecución de una PIO objetivo es complicado cuando el propio objetivo se mueve. La PIO fluctúa a lo largo del día -hora a hora, minuto a minuto, incluso segundo a segundo- en función de diversos factores endógenos y exógenos.
Dentro del sistema ocular, la PIO puede depender del equilibrio de la producción de humor acuoso, la facilidad de salida (la facilidad con la que el humor acuoso sale del ojo), la presión venosa epiescleral (la presión en las venas de la superficie del ojo) y el flujo de salida uveoescleral (una vía secundaria para que el humor acuoso salga del ojo).
Por ejemplo, un aumento del flujo de salida o una disminución de la producción de humor acuoso reduciría la PIO, dice el doctor Arthur J. Sit, investigador de glaucoma en la Clínica Mayo de Rochester, Minnesota. También pueden producirse saltos a corto plazo en la PIO debido a la presión ejercida sobre el ojo por el parpadeo o el frotamiento del mismo, o incluso durante el movimiento ocular o las pulsaciones de la presión arterial.
La presión intraocular también fluctúa debido a la posición del cuerpo, la hora del día (picos por la noche, descensos durante el día), la presión arterial y el concepto relacionado de presión de perfusión ocular (PPO), los niveles de estrés o dolor, el agua y el consumo de cafeína.
Además, la actividad vigorosa y el estrés pueden hacer que la presión arterial, la PIO y la OPP alcancen su punto máximo, dice Kaweh Mansouri, MD, MPH, oftalmólogo de la Universidad de Ginebra y de la Universidad de Colorado Denver. La medición de la presión arterial junto con la PIO tiene valor para determinar cómo afecta la presión arterial a la PIO, dice el Dr. Mansouri. Los investigadores están utilizando actualmente dispositivos de monitorización de la PIO durante 24 horas para explorar estos efectos en la progresión del glaucoma.
|
Qué hacer y qué no hacer en la medición de la PIO No diagnostique ni trate después de una sola medición. El Dr. Sowka aconseja a los optometristas que no inicien el tratamiento inmediatamente a menos que la presión sea excesivamente alta o que los nervios ópticos ya estén gravemente dañados y sean vulnerables; en su lugar, mida la presión varias veces. También es una buena idea obtener varias lecturas de la presión después de iniciar la terapia para determinar si la medicación está funcionando, dice el Dr. Sowka. Una sola lectura de la PIO después de iniciar la medicación no es suficiente para juzgar la verdadera eficacia. Diga a los pacientes que se relajen. Como se ha mencionado anteriormente, los pacientes pueden esforzarse o contener la respiración durante la tonometría. Dígales regularmente que se relajen y respiren normalmente durante el proceso, insta el Dr. Mansouri. No deje de sospechar. Si las mediciones de la PIO del paciente no parecen coincidir con sus evaluaciones del campo visual y del nervio óptico, puede haber algo más en la PIO del paciente de lo que usted cree, dice el Dr. Hartwick. Pídale que vuelva y mida su PIO en otro momento del día, añade. Considere la posibilidad de realizar una curva diurna en determinados pacientes. Registrar una curva diurna tonométricamente es poco práctico y tedioso para la mayoría de los pacientes. Pero si el nivel de la PIO y la extensión del daño parecen incongruentes -por ejemplo, cuando se sospecha de un glaucoma de tensión normal- considere la posibilidad, dice el Dr. Davey. Si el paciente está de acuerdo, llévelo por la mañana temprano y registre la PIO cada hora durante ocho o diez horas. «Eso le da la curva diurna del consultorio, que puede no ser totalmente representativa de los valores diurnos/nocturnos, pero al menos le da más de una medición», dice. |
Así es como estas variables afectan a la PIO:
– Posición del cuerpo. Según la posición del paciente en la silla, la presión puede aumentar o disminuir. Por ejemplo, la PIO es más baja cuando el paciente está sentado en una posición neutral. «Casi cualquier otra cosa hace que la PIO aumente, como doblar el cuello hacia delante, inclinar la cabeza hacia atrás, girar la cabeza hacia un lado, tumbarse, agacharse, parpadear o frotarse los ojos», dice el Dr. Sit.
– Consumo de agua. Beber un gran volumen de agua hace que el volumen sanguíneo del paciente aumente durante un breve periodo de tiempo. La presión venosa también sube cuando el paciente consume más agua. «Todo lo que tienen que hacer es consumir de 16 a 32oz, que es una o dos botellas pequeñas de agua, y en cinco minutos la presión subirá 6mm Hg», dice Pinakin Gunvant Davey, PhD, OD, profesor y experto en glaucoma del Colegio de Optometría de la Universidad Occidental de Ciencias de la Salud en Pomona, California.
– Hora del día. La literatura ha demostrado que el pico de PIO se produce por la noche en dos tercios de los pacientes. La razón: el humor acuoso se segrega menos de lo normal por la noche, dice Joseph Sowka, O.D., profesor de optometría en la Facultad de Optometría de la Universidad Nova Southeastern en Ft. Lauderdale, Florida.
Por ejemplo, el Dr. Mansouri observó a pacientes durante 24 horas en laboratorios de sueño y encontró las PIO más altas por la noche. Aunque sus pacientes no se sometan a estudios del sueño, es posible que acudan a su consulta por la noche; si es así, espere ver las PIO elevadas en relación con otros momentos del día.
– Presión arterial. La PIO de referencia se basa en el ciclo cardíaco, la presión arterial sistólica y diastólica. La fuerza utilizada para llevar la sangre al ojo es la presión de perfusión ocular, explica James L. Fanelli, O.D., del Cape Fear Eye Institute en Wilmington, NC.
Si la presión arterial es baja, hay menos fuerza para «empujar» la sangre hacia el ojo y, por lo tanto, menos presión de perfusión para el ojo. Los factores que hacen que la PIO se eleve tendrán un efecto en la disminución de la presión de perfusión, y los factores que reducen la presión arterial también darán lugar a una menor presión de perfusión, o una combinación de cualquiera de esos factores puede desempeñar un papel, dice el Dr. Fanelli. La presión arterial tiende a bajar durante las horas de sueño en la madrugada, que es también el momento del día en que la PIO tiende a ser más alta.1 Estos dos factores opuestos pueden tener un efecto duplicado en la reducción de la PIO durante las horas nocturnas, lo que puede permitir un mayor daño a la cabeza del nervio ocular.
– El estrés. Un aumento o disminución del estrés provoca cambios hormonales que hacen subir o bajar los niveles de PIO. Una de las pacientes del Dr. Mansouri -estudiada mediante un sensor de monitorización de la PIO durante 24 horas en una lente de contacto- tenía picos de presión cada vez que su perro tenía ataques epilépticos por la noche.
– «Nervios» generales. Es posible que, en algunos pacientes, el estrés del propio examen ocular -por ejemplo, si están preocupados por ser diagnosticados con glaucoma- pueda hacer que su PIO aumente, dice Andrew Hartwick, OD, PhD, profesor asociado de la Facultad de Optometría de la Universidad Estatal de Ohio en Columbus. Por ejemplo, pueden apretar los ojos porque están estresados por el examen, y las lecturas de la PIO se disparan.
– El dolor también provoca aumentos de la PIO porque causa estrés. Una de las pacientes del Dr. Mansouri se golpeó fuertemente la pierna en un aparcamiento. Hubo un pico en su nivel de PIO en el momento exacto en que recordó que había ocurrido su accidente, según los datos de monitorización de 24 horas.
Consecuencias de las lecturas inexactas de la PIO
Los estudios han indicado que los picos de la PIO podrían contribuir a la progresión del glaucoma.2,3 Pero si se examina a un paciente cuando la PIO está en su punto más bajo o más alto, se puede sobrestimar o subestimar el diagnóstico de glaucoma o el tratamiento necesario para el paciente.
«Si cogemos a un paciente en un punto bajo, donde la PIO es la más baja, puede alejarnos de la consideración de glaucoma», especialmente si la lectura está dentro de un rango estadísticamente normal, dice el Dr. Sowka. «Otras veces, podemos obtenerlas en un pico de PIO, donde está un poco por encima de lo normal, un escenario que tiende a hacer que los profesionales se preocupen innecesariamente».»
|
|
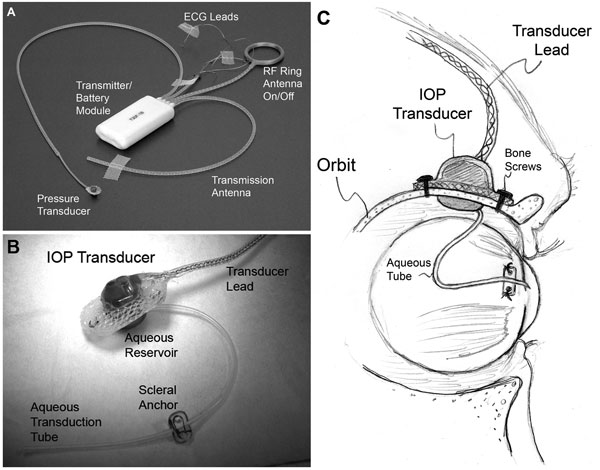
| (A) Un típico sistema de implante total T30F (Konigsberg Instruments). (B) La superficie extraorbitaria del alojamiento del transductor de PIO personalizado. (C) Un tubo de silicona de calibre 23 transporta el humor acuoso desde la cámara anterior hasta un depósito de líquido situado en el lado intraorbital del transductor (parcialmente oculto a la vista en B); el tubo (con la holgura adecuada para permitir el movimiento del ojo) se recortó y se introdujo en la cámara anterior. |
El registro de un rango de PIO permitiría potencialmente mejorar el diagnóstico y el tratamiento del glaucoma. «Si los investigadores pudieran demostrar que los patrones específicos de PIO de 24 horas están relacionados con la progresión del glaucoma, entonces existe la esperanza de que la detección de estos patrones podría ayudar a identificar a los pacientes con mayor riesgo de progresión y permitirnos adaptar su tratamiento en consecuencia», dice el Dr. Mansouri.
El glaucoma podría identificarse antes, lo que permitiría iniciar más rápidamente la cirugía o la medicación, añade. Los oftalmólogos también podrían determinar si los medicamentos para reducir la PIO son eficaces por la noche o durante actividades específicas que aumentan la PIO.
Establecer un rango de PIO real requeriría una monitorización continua de la PIO durante 24 horas. Esto supone un reto, ya que una única medición de la PIO recogida durante las horas normales de consulta no capta el rango de la PIO de un paciente, sus picos o cambios durante el día.4
Ahora mismo, determinar el rango de la PIO es posible utilizando la tonometría de aplanación de Goldman (TAG) a través de una curva de tensión diurna (CTD), en la que las lecturas de la PIO se capturan en diferentes puntos temporales durante las horas de consulta. Pero esto es problemático tanto para el profesional como para el paciente. Las curvas nocturnas no se registran, y menos del 1% de los pacientes se someten a la DTC o a la monitorización de la PIO en un laboratorio del sueño.4
De hecho, los investigadores midieron la PIO durante 24 horas y documentaron no sólo que los picos de PIO eran nocturnos, sino que la fluctuación de la PIO era mucho mayor durante las horas que no eran de consulta.5 En un estudio de 35 pacientes cuya PIO se registró mediante un neumatonómetro en un laboratorio del sueño durante 24 horas, la mayoría de los picos de PIO se registraron por la noche en pacientes con glaucoma de mayor edad en comparación con las personas sanas, tanto si estaban sentados como acostados.6
Más recientemente, los investigadores que utilizan la monitorización de 24 horas han aprendido que la PIO media no sólo aumenta por la noche, sino que en realidad tiene picos constantes, y más durante el día que por la noche.7 Los investigadores del Devers Eye Institute de Portland, Oregón, utilizaron un sistema de telemetría implantado en los ojos de los monos para registrar 500 mediciones de PIO por segundo.
Descubrieron que la PIO fluctúa mucho más de lo que se creía. «Los parpadeos y los movimientos oculares generan grandes picos de PIO que se producen unas 12.000 veces por hora y constituyen aproximadamente el 12% de la energía total de PIO que el ojo debe absorber durante las horas de vigilia», descubrieron los investigadores. Creen que estos datos en los monos serán más o menos los mismos en los humanos. «La PIO debe considerarse ahora como algo dinámico y siempre cambiante, y las fluctuaciones de la PIO pueden ser un factor importante que contribuya al glaucoma».8
También descubrieron que el ciclo diurno no se repite de un día a otro. De ahí la necesidad de una monitorización continua de la PIO. Los prototipos actuales incluyen sensores implantados y dispositivos basados en lentes de contacto.
Intelligent Implantables
Varias empresas de nueva creación han desarrollado sensores de presión telemétricos que pueden implantarse durante la cirugía de cataratas o glaucoma. «Telemétrico significa que las lecturas de presión se captan a distancia (es decir, desde el interior del ojo) y se transmiten de forma inalámbrica a un lector externo», dice el doctor Sit.
Los dispositivos implantables que se están estudiando actualmente son:

|
|
|
El sensor Pro-IOP es un dispositivo telemétrico que se implanta como una LIO. Foto: Implandata Ophthalmic Products GmbH |
– Pro-IOP. La empresa alemana Implandata Ophthalmic Products está trabajando en el Pro-IOP, un transductor de presión intraocular (WIT) inalámbrico que se alimenta telemétricamente mediante un dispositivo manual. El WIT, que parece un diminuto anillo de plástico, mide 11,3 mm de diámetro.9 Incorpora sensores de presión, un sensor de temperatura, un codificador de identificación, un codificador analógico-digital y una unidad de telemetría en un único sistema microelectromecánico.9
Un chip RFID con antena incorporada transmite las lecturas de la PIO durante las 24 horas del día a un lector manual externo. El paciente y el médico también podrían recibir los datos a través de una aplicación para teléfonos inteligentes. El paciente también podría comunicarse con el médico sobre las lecturas de la PIO en la aplicación.
El dispositivo aún no ha recibido la marca CE en Europa ni la aprobación de la FDA en EE.UU., pero investigadores de Alemania han insertado recientemente el Pro-IOP en el primer sujeto humano, una mujer de 60 años; aún no se han publicado datos.9
– AcuMEMs. Un implantable en desarrollo por una empresa estadounidense del mismo nombre, el AcuMEMs funciona de forma similar al Pro-IOP. Se trata de un sensor de presión capacitivo que cambia de forma con las fluctuaciones de la PIO. «Cuando cambia de forma, la capacitancia eléctrica se altera y esto puede detectarse externamente con el lector», dice el Dr. Sit.
El sensor puede implantarse en la cámara anterior como procedimiento independiente o como parte de la cirugía de glaucoma; también puede insertarse en el saco capsular durante la cirugía de cataratas.
– Implante de LIO microfluídica. Investigadores de la Universidad de Stanford y de la Universidad de Bar-Ilan (Israel) están desarrollando conjuntamente un sensor microfluídico implantable. La PIO se mediría «basándose en una interfaz de presión de equilibrio establecida entre un líquido y un gas intraocular» contenidos en cámaras del sensor, según la patente del dispositivo. Los pacientes y los médicos podrían utilizar sus teléfonos inteligentes o un lector externo para comprobar su PIO.10 Los inventores están a la espera de la aprobación de la patente del sensor.
La señal transmitida por los dispositivos implantados en el ojo puede ser más precisa que la de los fijados a las lentes de contacto, en teoría, dice el doctor Davey. La intensidad de la señal depende de la energía que emita el dispositivo. «Implantamos ambos dispositivos (Pro-IOP y AcuMEMs) y no funcionaban tan bien», dice el Dr. Davey.
Tanto el lector Pro-IOP como el AcuMEMs podrían acoplarse potencialmente a un par de gafas, y los datos se recogerían de la misma manera, dice el Dr. Sit.
Lentes de contacto inteligentes
Los investigadores investigaron por primera vez los sensores de las lentes de contacto en la década de 1970, pero las lentes de contacto duras disponibles eran demasiado incómodas y cambiaban la integridad estructural del ojo del paciente, según el Dr. Davey.
|
|
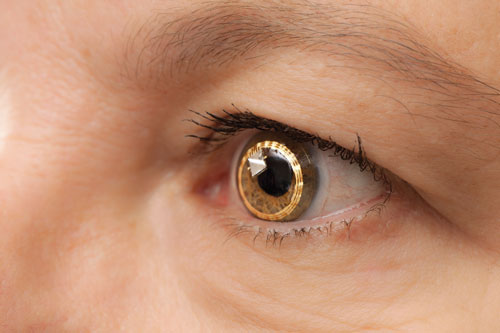
| El Sensimed Triggerfish en el ojo. Todavía está en fase de pruebas clínicas en Estados Unidos. |
Los sensores tampoco eran lo suficientemente sensibles. «La persona con un ojo más «suave» tenía lecturas más precisas que una persona con un ojo más rígido», dice el Dr. Davey. «La tecnología no era lo suficientemente buena para obtener valores de PIO». Una córnea más gruesa responde menos fácilmente a los cambios de la PIO, lo que hace que la tonometría (y los sensores de las lentes de contacto) sean menos precisos.
Los sensores de PIO basados en lentes de contacto incluyen:
– El Triggerfish (Sensimed). En la Universidad de Ginebra (Suiza), los oftalmólogos llevaron a cabo las primeras investigaciones de una lente de contacto denominada Triggerfish, dirigidas por el Dr. Mansouri y otros.
El Triggerfish es una lente de contacto blanda e hidrofílica equipada con un sensor de lente de contacto (CLS). El CLS tiene dos medidores de tensión situados alrededor del limbo que detectan los cambios en la circunferencia ocular. «Se cree que estos cambios en la circunferencia ocular están relacionados con los cambios en la PIO y el volumen intraocular, y esto se ha demostrado en ojos enucleados», dice el Dr. Mansouri. El dispositivo mide una mezcla de PIO, volumen intraocular y cambios en las propiedades biomecánicas (una combinación de histéresis y rigidez corneal y escleral) que se correlacionan con las fluctuaciones de la PIO. Un lector externo captura los datos durante un período de 24 horas.
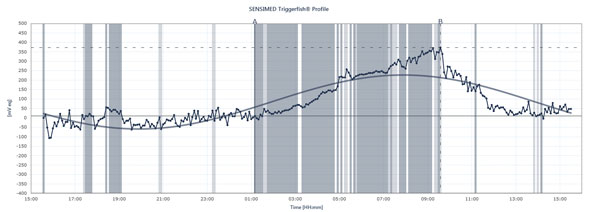
El diagrama de flujo muestra los picos y las caídas de la PIO en un paciente que lleva el Triggerfish de Sensimed durante un período de 24 horas.
El Triggerfish está aprobado por la marca CE en Europa. La aprobación de la FDA no se ha alcanzado en EE.UU. y el dispositivo aún está en fase de ensayos clínicos.
|
Triggerfish realiza un seguimiento diferente de la PIO Los datos mostrados en el lector externo son una combinación de la presión intraocular, el volumen intraocular y las propiedades biomecánicas del ojo, explica el Dr. Mansouri. «Sirve para hacerse una idea de los cambios cualitativos a lo largo de 24 horas más que de los cuantitativos, porque no podemos traducirlos en milímetros de mercurio», dice. El Triggerfish proporciona, no obstante, una información valiosa. Los estudios futuros en los que se utilice el dispositivo podrían ayudar a explicar lo inestable o estable que ha sido la presión a lo largo de 24 horas, cuándo se producen los picos de PIO nocturnos, cómo la introducción de un tratamiento o de cambios en el mismo afecta a los patrones de PIO a lo largo de 24 horas y cómo las actividades específicas afectan a los patrones de PIO a lo largo de 24 horas, como las posturas de yoga, la ingesta de cafeína, las situaciones de estrés y otras causas de picos de PIO descritas anteriormente. El Dr. Mansouri también hace que los pacientes con glaucoma normal o de baja tensión se sometan a una monitorización simultánea de la presión arterial de 24 horas y de la PIO de 24 horas, ya que los picos pueden afectar a la PIO. ¿Pero mostrará el Triggerfish una correlación entre los patrones de PIO de 24 horas y la progresión del glaucoma? Hay muchos estudios en marcha para responder a esta pregunta esencial.
|
– Lente de contacto con sensor de circuito de resonancia. Otro dispositivo CLS inteligente en desarrollo es un circuito de resonancia formado por un condensador de película fina combinado con una bobina sensora que detecta la deformación de la curvatura corneal. Está en las primeras fases de desarrollo bajo la dirección de David C.C. Lam en el Departamento de Ingeniería Mecánica y Aeroespacial de la Universidad de Ciencia y Tecnología de Hong Kong.
En un estudio de septiembre de 2014, el CLS se probó en un modelo de ojo de goma de silicona. Se comprobó que el sensor registraba con precisión las fluctuaciones de la PIO.11
Al igual que la medición de los niveles de glucosa una vez al día para los pacientes con diabetes o de la presión arterial una vez al día para los pacientes con enfermedades cardíacas, la dependencia de una sola medición de la PIO podría dar lugar a datos erróneos sobre la misma. Pero quizás en un futuro no muy lejano, los dispositivos sacados de una película de ciencia ficción -lentes de contacto y sensores implantables- podrían permitirle hacer un seguimiento de la PIO con mayor comprensión y menos molestias para usted y sus pacientes.
1. Liu JH1, Gokhale PA, Loving RT, Kripke DF, Weinreb RN. Evaluación de laboratorio de las presiones de perfusión ocular diurnas y nocturnas en humanos. J Ocul Pharmacol Ther. 2003 Aug;19(4):291-7.
2. Zeimer RC, Wilensky JT, Gieser DK, Viana MA. Asociación entre los picos de presión intraocular y la progresión de la pérdida del campo visual. Ophthalmology. 1991 Jan;98(1):64-69.
3. Konstas AG, Quaranta L, Mikropoulos DG, et al. Peak Intraocular Pressure and Glaucomatous Progression in Primary Open-Angle Glaucoma. J Ocul Pharmacol Ther. 2012 Feb;28(1):26-32.
4. Mansouri K, Weinreb RN, Medeiros FA. Es necesaria la monitorización de la presión intraocular durante 24 horas en el glaucoma? Semin Opthalmol. Mayo 2013: 28(3):157-164.
5. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Utilidad clínica de la monitorización de la presión intraocular fuera del horario habitual de consulta en pacientes con glaucoma. Arch Ophthalmol. 2006 Jun;124(6):793-7.
6. Mosaed S, Liu H, Weinreb RN. Correlación entre las presiones intraoculares nocturnas máximas en sujetos sanos y pacientes con glaucoma. Am J Ophthalmol. 2005; Feb;139(2):320-4.
7. Downs JC, Burgoyne CF, Seigfreid WP, et al. 24-hour IOP telemetry in the nonhuman primate: implant system performance and initial characterization of IOP at multiple timescales. Invest Ophthalmol Vis Sci. 2011 Sep 21;52(10):7365-75.
8. Asociación para la Investigación en Visión y Oftalmología: Tendencias emergentes y temas candentes. Presentado el lunes 5 de mayo de 2014 en la Reunión Anual de la ARVO. Disponible en: www.arvo.org/About_ARVO/Press_Room/Emerging_Trends_and_hot_topics__Presented_Monday,_May_5_at_the_ARVO_Annual_Meeting. Consultado el 19 de noviembre de 2014.
9. Melki S, Todani A, Cherfan G. An Implantable Intraocular Pressure Transducer Initial Safety Outcomes. JAMA Ophthalmol. 2014 Oct 1;132(10):1221-5.
10. Mandel Y, Araci IE, Quake SR. Google Patents. Dispositivo microfluídico implantable para monitorizar la presión intraocular. Disponible en: www.google.com/patents/WO2014137840A1?cl=en. Consultado el 17 de octubre de 2014.
11. Chen GZ, Chan IS, Leung LK, Lam DC. Sensor de lente de contacto blando y ponible para la monitorización continua de la presión intraocular. Med Eng Phys. 2014 Sep;36(9):1134-9.
12. Mottet B, Aptel F, Romanet JP, et al. Ritmo de presión intraocular de 24 horas en sujetos jóvenes sanos evaluados con monitorización continua mediante un sensor de lente de contacto. JAMA Ophthalmol. 2013 Dec;131(12):1507-16.
