- Informe anual sobre la córnea
- ¿Qué es el CXL y cómo funciona?
- ¿Cuál es el papel de la riboflavina durante el CXL?
- ¿Cuál es el propósito de la eliminación del epitelio en el protocolo estándar de CXL?
- ¿Cómo se realiza el protocolo estándar de CXL?
- ¿Cuáles son las recomendaciones para la selección de pacientes?
- ¿Es necesaria la progresión de la KCN para recomendar el CXL?
- ¿Debería considerar el CXL para pacientes mayores de 40 años?
- ¿Cuáles son los resultados y las expectativas generales del postoperatorio de CXL?
- ¿Pueden los pacientes de CXL esperar algún cambio refractivo?
- ¿Es el empañamiento del CXL una preocupación?
- ¿Se puede realizar CXL sin retirar el epitelio?
- 12. Cuándo debo volver a colocar las lentes de contacto después del CXL?
Informe anual sobre la córnea
Siga los enlaces que aparecen a continuación para leer otros artículos de nuestro Informe anual sobre la córnea:
Guía de un Oftalmólogo sobre las opciones de trasplante de córnea
Cómo arreglar un agujero: Cómo curar los defectos epiteliales persistentes
Alerta de intrusos: diagnóstico de la enfermedad infiltrativa de la córnea
Para muchos oftalmólogos y pacientes, el tratamiento del queratocono (KCN) puede parecer el mantenimiento de un status quo indeseable. Debido a los avances en las tecnologías de lentes de contacto especiales, los injertos de córnea ahora sólo son necesarios para el 10% al 20% de los pacientes con queratocono.1 A pesar de ello, estos pacientes siguen obteniendo puntuaciones similares a las de aquellos con degeneración macular avanzada en el cuestionario de función visual del Instituto Nacional del Ojo en el estudio CLEK (Collaborative Longitudinal Evaluation of Keratoconus Study).2-5 Otro informe del mismo grupo descubrió que las puntuaciones de calidad de vida autopercibida de los pacientes con queratocono siguen disminuyendo con el tiempo.6 Dado que se postula que la prevalencia de la KCN es de uno de cada 375 individuos, la estabilización de la enfermedad y la mejora o el mantenimiento de la calidad de vida son las principales prioridades.7
Desde su desarrollo en 2003, el crosslinking corneal (CXL) se ha convertido rápidamente en el tratamiento de elección para el control de la progresión de la KCN.8 Aunque el CXL no recibió la aprobación de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) hasta 2016 (el sistema KXL de Avedro y dos fotoreforzadores, Photrexa y Photrexa viscoso), en el Wills Eye Hospital hemos podido ofrecer tratamientos de CXL a los pacientes durante muchos años bajo el auspicio de ensayos clínicos. Como resultado, comanage muchos de estos pacientes con los clínicos de la comunidad.
Como con cualquier nuevo procedimiento de tratamiento, existe una curva de aprendizaje para los clínicos para refinar la educación del paciente y el proceso de selección, así como otros protocolos relacionados con la gestión perioperatoria. Un canal de comunicación abierto permite a nuestro Servicio de Córnea ayudar a los médicos comanejadores a ganar comodidad clínica con el CXL en sus prácticas de KCN. Aquí hay 12 preguntas comunes que nuestros médicos asociados hacen; las respuestas pueden ayudarle a decidir sobre la mejor manera de educar a sus pacientes de KCN en CXL.
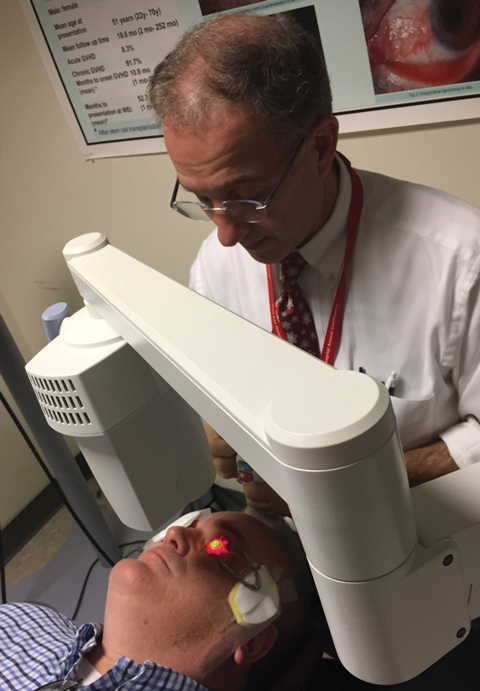
Figura 1. Christopher Rapuano, MD, realiza un protocolo estándar de crosslinking corneal con el sistema KXL aprobado por la FDA.
¿Qué es el CXL y cómo funciona?
El crosslinking es un proceso de polimerización que reordena los monómeros en una red tridimensional de polímeros para aumentar la solidez de una estructura molecular. Este proceso se produce de forma natural en nuestro cuerpo, ya que los tejidos conectivos se endurecen gradualmente con el paso del tiempo. Con la ayuda de la enzima endógena lisil oxidasa para poner en marcha las reacciones oxidativas necesarias, se forman enlaces covalentes adicionales (o «enlaces cruzados» de los tejidos) entre las fibrillas de colágeno y dentro de ellas, lo que aumenta la resistencia biomecánica de los tejidos.9
Típicamente, los efectos acumulativos de las reacciones naturales de enlace cruzado tardan en manifestarse. A finales de la década de 1990, los investigadores de la Universidad de Dresde, en Alemania, determinaron que el proceso de inducción fotoquímica era el método más viable desde el punto de vista clínico para potenciar la inducción de los entrecruzamientos en la córnea, dando lugar al CXL.8 Este estudio utilizó riboflavina al 0,1% (con un 20% de dextrano en solución) como fotosensibilizador para absorber una dosis de energía ultravioleta (UV) cuidadosamente calibrada, convirtiendo así el oxígeno tisular disponible en moléculas de oxígeno singlete. Las especies reactivas de oxígeno resultantes poseen suficiente energía para activar la vía enzimática de la lisil oxidasa, lo que conduce a la formación de nuevos enlaces covalentes dentro del estroma corneal.
El estudio de Dresde informó de que todos los 23 ojos con KCN progresiva tratados se estabilizaron, y el 70% mostró un aplanamiento máximo de la queratometría en 2,01D. Desde entonces, muchos estudios han logrado una eficacia similar con buenos perfiles de seguridad en pacientes con KCN utilizando el mismo protocolo de CXL que implica la eliminación del epitelio (Figura 1).10-13
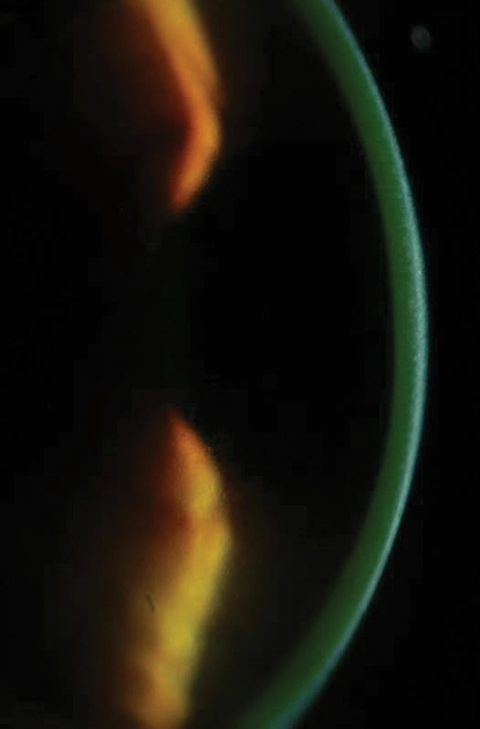
Figs. 2a y 2b. Arriba, saturación de riboflavina observada en el estroma corneal tras la carga de riboflavina. Abajo, tras 30 minutos de carga de riboflavina a intervalos de dos minutos, los clínicos deben comprobar la tinción de riboflavina acuosa. Haga clic en la imagen inferior para ampliarla.
¿Cuál es el papel de la riboflavina durante el CXL?
Dado que las moléculas de oxígeno biodisponibles en la córnea no pueden ser activadas por la luz UV directamente, una sustancia fotosensibilizadora debe actuar como agente intermedio. La riboflavina cataliza las reacciones fotoquímicas del CXL mediante la transferencia de energía UV (concretamente, UVA de 365 nm a 370 nm) a las moléculas de oxígeno del estroma, convirtiendo así las moléculas de oxígeno estables en una forma singlete más reactiva. Estas especies reactivas de oxígeno inician entonces reacciones oxidativas intraestromales.
Suponiendo que la energía UV no sea el recurso limitante, la reposición continua de oxígeno y las moléculas activas de riboflavina son esenciales para mantener la transferencia de energía necesaria para perpetuar el proceso de CXL.
Además, la saturación de la córnea con riboflavina crea un «efecto de blindaje» en el que los respectivos niveles de energía UV que llegan al endotelio, al cristalino y a la retina se titulan a una intensidad mucho menor que los umbrales de daño celular reales. De hecho, si una córnea saturada de riboflavina tiene un grosor mínimo de 400µm, la irradiación UV transmitida al endotelio es sólo de 0,18mW/cm2, mientras que el umbral de daño endotelial real es de aproximadamente 0,35mW/cm2. Posteriormente, el nivel de energía proyectado para alcanzar el cristalino y la retina es aún menor en comparación con los respectivos umbrales de daño de estas capas tisulares.14,15
¿Cuál es el propósito de la eliminación del epitelio en el protocolo estándar de CXL?
La naturaleza lipofílica del epitelio corneal y el pequeño tamaño de los poros de sus uniones estrechas hacen que esta capa sea esencialmente impermeable a las moléculas de riboflavina. Estas características de la barrera epitelial impiden la saturación eficiente y homogénea de la riboflavina en el tejido estromal objetivo.16
El epitelio también contiene enzimas con altas propiedades antioxidantes, como los residuos de ascorbato y triptófano, que pueden impedir la penetración de los rayos UV y eliminar las especies reactivas del oxígeno. Además, la presencia de una barrera epitelial ralentiza la tasa de reposición de oxígeno durante los procedimientos de CXL, reduciendo así la cantidad total de nuevos enlaces cruzados celulares que pueden crearse. En consecuencia, cuando el mismo protocolo de CXL estándar se lleva a cabo con una superficie corneal intacta, la eficacia global del procedimiento será inferior a la prevista. Por otra parte, debido a la saturación no homogénea de riboflavina y a la reducción de los efectos de apantallamiento de la riboflavina, las transmisiones de UV entregadas al endotelio y a los tejidos oculares más profundos pueden ser mayores de lo que se había calculado anteriormente.16,17
Los clínicos no deben asumir que el CXL sólo es eficaz cuando va acompañado de un desbridamiento epitelial. Aunque las aplicaciones de CXL transepitelial (TE-CXL) no tienen actualmente la aprobación de la FDA, se están investigando técnicas de tratamiento modificadas para mejorar la eficacia del TE-CXL.
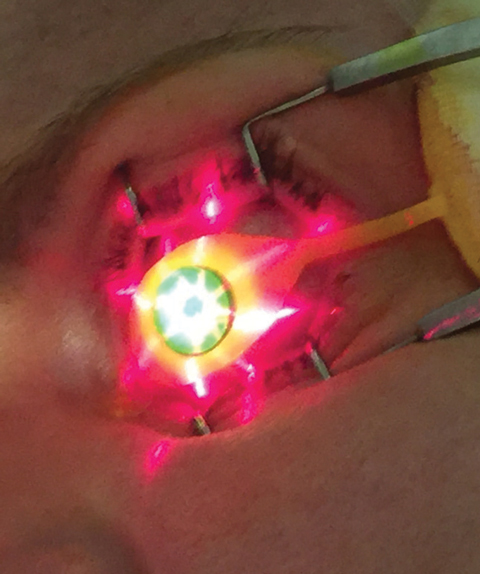
Figura 3. El dispositivo KXL proyecta una guía en forma de cruz en el lugar de tratamiento.
¿Cómo se realiza el protocolo estándar de CXL?
Se utiliza anestesia tópica al retirar los 9 mm centrales de epitelio para garantizar la comodidad del paciente y permitir una saturación estromal más rápida y homogénea de Photrexa viscosa (riboflavina 5′-fosfato en solución oftálmica de dextrano al 20%) durante el CXL. Esta fase dura 30 minutos con la instilación de riboflavina en intervalos de dos minutos.10
Después de 30 minutos, se examina a los pacientes bajo la lámpara de hendidura para asegurarse de que la riboflavina ha saturado la zona de tratamiento prevista y de que está presente en el acuoso (figuras 2a y 2b). Según las indicaciones aprobadas por la FDA, los clínicos deben realizar una paquimetría tras la aplicación de la riboflavina para asegurarse de que el grosor de la córnea es de al menos 400µm. Si es inferior a 400µm, debe administrarse riboflavina Photrexa hipotónica cada cinco o diez segundos hasta que la córnea se rehidrate a 400µm o más.10
Una vez verificado el nivel de paquimetría adecuado, los clínicos utilizan el dispositivo UV KXL (Avedro) para la segunda fase del tratamiento CXL, en la que 30 minutos de irradiación UV (3mW/cm2) producen una dosis total de energía de 5,4J/cm2.8 Durante el periodo de emisión de UV, se instila Photrexa viscous en intervalos de dos minutos mientras el operador mantiene la centración y la distancia dispositivo-ojo adecuadas. La posición adecuada del dispositivo KXL puede ser guiada por las proyecciones de imágenes en forma de cruz (Figura 3), que ayudan a la entrega de un perfil de haz de iluminación óptimo a la córnea tratada.
El exceso de riboflavina puede enjuagarse con una solución salina equilibrada al final de una sesión de tratamiento. Después de la instilación de agentes tópicos antibióticos y corticosteroides se coloca una lente de contacto vendada (BCL). La BCL debe mantenerse en el ojo tratado de tres a cinco días o hasta el cierre epitelial (Figuras 4a y 4b).
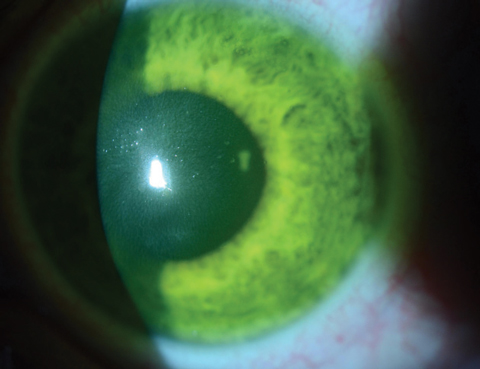
Figura 4a. Aquí, una lente de contacto blanda vendada está en el ojo inmediatamente después del tratamiento de CXL en un paciente en el que la saturación corneal de riboflavina es todavía evidente.
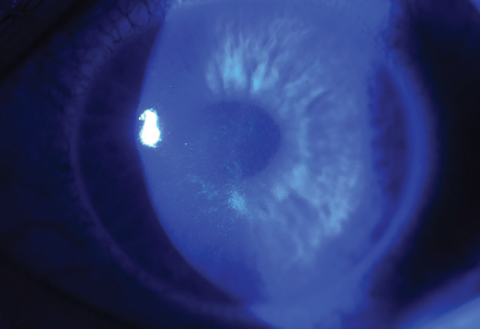
Fig. 4b. El cierre de la herida epitelial es en su mayor parte completo en el mismo paciente sólo tres días después del tratamiento con CXL.
¿Cuáles son las recomendaciones para la selección de pacientes?
En 2016, el protocolo estándar de CXL recibió indicaciones etiquetadas en Estados Unidos para tratar a pacientes de 14 años o más con KCN progresiva o ectasia corneal tras cirugías refractivas. Sin embargo, cuando no se trata, se sabe que la gravedad de la enfermedad y la tasa de progresión son más agresivas en los pacientes más jóvenes. Por lo tanto, el sistema KXL y Photrexa/Photrexa viscous pueden considerarse para su uso fuera de etiqueta en pacientes más jóvenes con un grosor corneal mínimo de 400 µm o superior. En los ensayos clínicos se ha informado de pacientes con KCN de tan solo ocho años, pero en estos casos deben obtenerse consentimientos informados especiales de los pacientes y sus tutores.18
Aunque la FDA no ha especificado ninguna contraindicación, los clínicos deben ejercer su juicio antes de ofrecer el CXL a las madres lactantes y a los pacientes mayores de 65 años. Además, los investigadores recomiendan encarecidamente evitar el CXL durante el curso de un embarazo. En un estudio reciente se encontraron pruebas topográficas, paquimétricas y biomecánicas de la progresión de la KCN en el 100% de su cohorte de pacientes embarazadas.19 Esto llevó a los investigadores a recomendar que se hablara del CXL profiláctico con las pacientes antes de la planificación familiar. Algunos países europeos han comenzado a ofrecer proactivamente el CXL a las pacientes con KCN que están planeando un embarazo a pesar de la falta de progresión de la enfermedad.20
¿Es necesaria la progresión de la KCN para recomendar el CXL?
Aunque la progresión de la KCN es parte de la indicación en la etiqueta para el tratamiento con CXL, ciertas circunstancias no requieren la progresión antes de una consulta de CXL. Las mujeres con KCN que planean quedarse embarazadas y los pacientes con alto riesgo de progresión son sólo dos ejemplos clínicos potenciales.19,21
De acuerdo con el modelo de atención convencional de la KCN, debe manifestarse cierta cantidad de cambios significativos en los parámetros clínicos antes de iniciar un nuevo curso de tratamiento. Sin embargo, es frecuente que se produzca una progresión significativa antes de tomar medidas debido a la falta de consenso sobre el indicador clínico exacto y la correspondiente magnitud del cambio que constituye la progresión de la enfermedad. Muchos estudios de CXL definen la progresión de la KCN como cambios en un periodo de 12 meses en cualquiera de las siguientes mediciones 1D o más en la queratometría máxima; 0,5D o más en la miopía; 1D o más en el astigmatismo; o 10µm o más de pérdida en el punto paquimétrico más delgado.10-12,20,22 Sin embargo, con la limitada precisión de los topógrafos tradicionales al obtener imágenes de la superficie corneal irregular y la variabilidad refractiva de los pacientes con KCN, estas directrices pueden dar lugar a una mayor tasa de falsos positivos.
Alternativamente, un panel de expertos recomendó recientemente que la presencia de al menos dos de tres criterios puede establecer la progresión: aumento de la curvatura corneal anterior; aumento de la curvatura corneal posterior; o adelgazamiento cuando se compara el perfil de distribución paquimétrica desde la periferia hasta el punto más delgado.21 Aunque son útiles, estas directrices requieren el acceso a la tomografía corneal capaz de rastrear los cambios a lo largo del tiempo, lo que supone un posible reto para algunos clínicos comanentes.
Dados estos obstáculos clínicos, el panel de expertos reunido de cuatro sociedades corneales supranacionales concluyó que se pueden hacer recomendaciones de CXL a los pacientes con KCN con perfiles de alto riesgo, incluso si no se ha documentado la progresión.21
¿Debería considerar el CXL para pacientes mayores de 40 años?
La respuesta corta es sí. Los pacientes con KCN tienden a mostrar una tasa de progresión más lenta o incluso una estabilización en su cuarta o quinta década de vida, probablemente un subproducto de la reticulación asociada a la edad. Sin embargo, la expresión de la KCN es muy variable, y la edad por sí sola no siempre es un punto final bien definido para la KCN. Una revisión retrospectiva de las historias clínicas del Wills Eye Hospital descubrió que el 24% de los 186 ojos recién diagnosticados con KCN pertenecían a pacientes de 40 años o más.23
Además, dado que la ectasia posquirúrgica puede producirse en un momento posterior de la vida que el típico paciente con KCN, el consenso clínico no ha definido un rango de edad para el momento en que se produce típicamente la ectasia y cuando la progresión puede ser más lenta. Por lo tanto, los clínicos deben abstenerse de utilizar la edad como una contraindicación absoluta para la candidatura al CXL.
¿Cuáles son los resultados y las expectativas generales del postoperatorio de CXL?
La fase inicial de recuperación del CXL estándar es muy parecida a cualquier procedimiento que implique la eliminación del epitelio corneal. Aunque los BCL ofrecen una protección terapéutica y una mayor comodidad para el paciente, la mayoría de los pacientes siguen experimentando algunas molestias oculares o dolor hasta que se cierra el defecto epitelial, lo que suele ocurrir en tres o cinco días.24
Después del cierre epitelial, la agudeza visual generalmente empeora o fluctúa mucho a lo largo del primer mes antes de volver lentamente a la línea de base hacia el tercer mes. Los pacientes pueden experimentar una leve mejora de la visión entre los meses tres y seis o entre los meses seis y doce. Además, suele surgir una tendencia de estabilización como nueva línea de base entre los meses seis y 12.10-12
Después del CXL estándar, las mediciones de queratometría, paquimetría y neblina transitoria del CXL también siguen un patrón temporal similar, con una mayor inclinación, adelgazamiento y reducción de la transparencia corneal durante el primer mes. Estas tendencias suelen invertirse en los dos meses siguientes, momento en el que los pacientes vuelven lentamente a las características de partida. A veces, estos pacientes experimentan incluso leves mejoras antes de alcanzar una meseta de estabilización (figura 5).10-12
Es importante abstenerse de malinterpretar estas tendencias postoperatorias inmediatas como un empeoramiento de la enfermedad KCN o un fracaso del CXL. En general, a pesar de un protocolo de CXL epi-off, sólo existe un breve período durante la recuperación postoperatoria inmediata en el que los pacientes pueden sentirse visualmente comprometidos. Esto se debe a que los pacientes son readaptados con lentes de contacto o pueden reanudar el uso de lentes de contacto antes de alcanzar la estabilización post-CXL.
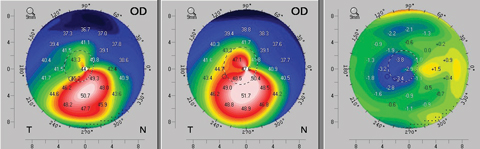
Fig. 5. Un ejemplo de aplanamiento topográfico observado ya tres meses después del protocolo de crosslinking corneal estándar (epi-off). El mapa de la izquierda muestra la topografía axial preoperatoria del paciente. El mapa del centro es la topografía postoperatoria al tercer mes, y el mapa de la derecha proporciona un cálculo de la diferencia que revela la mejora topográfica al tercer mes. Haga clic en la imagen para ampliarla.
¿Pueden los pacientes de CXL esperar algún cambio refractivo?
Los estudios han informado de resultados variables para la esfera, el cilindro y el equivalente esférico a los 12 meses después del tratamiento con CXL. Algunos muestran cambios refractivos estadísticamente significativos, mientras que otros no registran diferencias notables.25-27 Los investigadores han informado de mejoras en la aberración total de alto orden, la aberración esférica y el coma, así como de un aplanamiento topográfico medio de 1,6D.10,28 Aun así, la bibliografía no ofrece correlaciones consistentes entre los cambios en estos parámetros clínicos y el tratamiento con CXL.
En consecuencia, la estabilización del KCN debe seguir siendo el objetivo principal de los protocolos de CXL actualmente disponibles. Antes de recomendar el CXL, debe informarse a los pacientes de que seguirán siendo necesarias las lentes de contacto o las gafas después del CXL, y este enfoque de gestión puede mejorar la calidad de vida de los pacientes al reducir la frustración a menudo asociada a los frecuentes cambios ópticos cuando el KCN se deja sin tratar.
¿Es el empañamiento del CXL una preocupación?
La opacidad transitoria del CXL puede parecer similar a la opacidad corneal posterior a la RPK. Sin embargo, con la experiencia, los clínicos pueden diferenciar las dos entidades bajo la lámpara de hendidura. La opacidad por CXL crea un cambio tisular similar al polvo en los niveles anteriores y medios del estroma, mientras que la opacidad por PRK se manifiesta en un patrón de proliferación fibrótica reticulada que se localiza en las capas subepiteliales y anteriores del estroma. Dada la diferente apariencia anatómica y la naturaleza autorresolutiva de la opacidad de CXL, es poco probable que tenga las mismas implicaciones visuales que la opacidad de PRK.24
Inmediatamente después del tratamiento de CXL, la microscopía confocal revelará la apoptosis de los queratocitos y el edema lacunar en la zona anterior y media del estroma. A medida que las áreas de opacidad de CXL y el edema estromal comienzan a mostrar una mejora al final del primer mes, los médicos verán zonas de discontinuidad óptica -o líneas de demarcación- con una sección óptica durante el examen con lámpara de hendidura (Figura 6).24
Aunque la discapacidad por deslumbramiento es una posibilidad durante las primeras seis a ocho semanas, la opacidad transitoria de CXL y la profundidad de la línea de demarcación se utilizan a menudo como indicadores para reflejar la penetración del tratamiento y la remodelación del colágeno estromal resultante. A medida que los queratocitos se repoblan lentamente, la retrodispersión de la luz comienza a resolverse y las zonas de opacidad de CXL empiezan a desaparecer entre los tres y los seis meses. La opacidad suele ser imperceptible un año después del CXL. Los esteroides tópicos suelen suspenderse tras las primeras semanas después del procedimiento, pero la mayoría de los casos de opacidad por CXL se resuelven por sí solos con el tiempo sin más intervenciones terapéuticas; por lo tanto, los investigadores sugieren que los esteroides tópicos no mitigan la opacidad por CXL y que su uso a largo plazo no es necesario tras el CXL estándar. Sin embargo, un estudio propuso que los esteroides tópicos pueden estar justificados si se observa opacidad persistente o cicatrización estromal después de un año.24,29
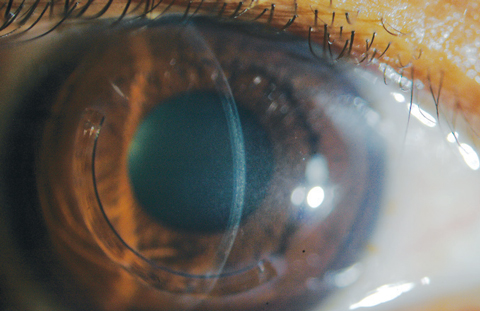
Fig. 6. Las líneas de demarcación se visualizan con sección óptica en un paciente que recibió tratamiento off-label de CXL e implante corneal Intacs (AJL Ophthalmic).
¿Se puede realizar CXL sin retirar el epitelio?
El CXL epi-off estándar es mínimamente invasivo y altamente eficaz para detener la progresión de la KCN. Además, los acontecimientos adversos son infrecuentes después del CXL estándar.10-13 Sin embargo, los investigadores siguen investigando métodos de administración para aumentar la comodidad durante y después del procedimiento, acortar el tiempo de recuperación visual y reducir los riesgos de posibles infecciones.
Mantener el epitelio intacto reduce las tasas de difusión de la riboflavina, la luz UV y el oxígeno, todos ellos esenciales para las reacciones fotoquímicas durante el CXL. Los investigadores han podido evitar la función de barrera epitelial interrumpiendo las uniones estrechas con potenciadores químicos como el cloruro de benzalconio (BAK) y el ácido etilendiaminotetraacético (EDTA). Estos potenciadores corneales se incorporan a la solución de riboflavina para facilitar su penetración en el estroma corneal. Sin embargo, algunos estudios han informado de la existencia de líneas de demarcación menos profundas y de la reducción de los efectos de rigidez de la córnea tras el TE-CXL.30,31
Aunque varios estudios informaron de tasas de regresión más elevadas con el TE-CXL, sus tasas de acontecimientos adversos también son inferiores a las del CXL estándar epi-off. Además, la menor profundidad del tratamiento con CXL puede ser ventajosa en ojos con córneas más finas al inicio. Los pacientes con un bajo riesgo de progresión y los que están preocupados por el tiempo de recuperación visual pueden ser candidatos razonables para el TE-CXL.24,30,31
Hasta que mejore la eficacia del TE-CXL, seguiremos recomendando el CXL epi-off estándar para los pacientes con KCN con una alta probabilidad de progresión o una progresión clínica agresiva.
12. Cuándo debo volver a colocar las lentes de contacto después del CXL?
Un estudio con microscopía confocal demostró que el grosor epitelial vuelve gradualmente a la normalidad entre tres y seis meses después del CXL estándar.24 Sin embargo, muchos pacientes requieren una rehabilitación de las lentes de contacto para funcionar y no pueden esperar seis meses antes de reanudar el uso de lentes de contacto.
Nuestro enfoque personal es adoptar una estrategia de adaptación de la lente que permita una interacción mínima o nula entre la superficie posterior de la lente y el epitelio corneal, dada la posibilidad de que se produzca una neblina persistente con un retraso en la cicatrización epitelial o una remodelación epitelial interrumpida. Varios diseños de lentes pueden ayudar a lograr este objetivo, incluidos los que tienen capacidad de bóveda corneal, como las lentes híbridas, esclerales, piggyback e incluso las lentes blandas personalizadas. A partir de la experiencia clínica, hemos comprobado que el momento ideal para considerar la adaptación de una lente es aproximadamente entre cuatro y seis semanas después del CXL estándar o dos semanas después del TE-CXL. También es prudente recalcar a los pacientes, sobre todo después del CXL estándar, que pueden esperarse frecuentes modificaciones refractivas en sus lentes de contacto durante los siguientes seis a 12 meses.
La aparición del CXL ha dado paso a una nueva era en el manejo de la KCN en la que los clínicos ya no tienen que asumir un enfoque de manejo reactivo pasivo y ofrecer a los pacientes sólo una opción forzada entre las lentes de contacto y los injertos de córnea. Con una intervención temprana de CXL para los candidatos apropiados y un seguimiento continuo después de CXL, los clínicos pueden ayudar a los pacientes a mantener su mejor función visual y aplazar al máximo las posibles necesidades de queratoplastias. El enfoque clínico actual debería ir más allá de la simple reposición de las lentes de contacto a medida que la queratina progresa. Con la detección temprana de la KCN, el acceso al CXL y los avances en los diseños de lentes especiales, los clínicos pueden ayudar a sus pacientes con KCN a vivir plenamente.
El Dr. Chang es director de lentes especiales de córnea en el Wills Eye Hospital-Cornea Service y director de servicios clínicos en TLC Vision. Es miembro del consejo asesor de la Academia Internacional de Queratocono, del Instituto de Lentes Permeables al Gas y de la Sociedad Optométrica de Córnea, Catarata y Refracción.
El Dr. Rapuano es jefe del Servicio de Córnea del Wills Eye Hospital. Ha publicado varios libros, numerosos capítulos de libros y más de 175 artículos revisados por pares, entre los que se incluye el haber sido coautor de The Wills Eye Manual.
1. Godefrooij DA, Gans R, Imhof SM, Wisse RP. Reducción a nivel nacional del número de trasplantes de córnea por queratocono tras la implantación del cross-linking. Acta Ophthalmol. 2016;94(7):675-8.
2. Davidson AE, Hayes S, Hardcastle AJ, et al. La patogénesis del queratocono. Eye (Lond). 2014;28(2):189-95.
3. Tuft SJ, Moodaley LC, Gregory WM, et al. Factores pronósticos de la progresión del queratocono. Ophthalmology. 1994;101(3):439-47.
4. Gordon MO, Steger-May K, Szczotka-Flynn L, et al. Baseline factors predictive of incident penetrating keratoplasty in keratoconus. Am J Ophthalmol. 2006;142(6):923-30.
5. Kymes SM, Walline JJ, Zadnik K, Gordon MO. Quality of life in keratoconus. Am J Ophthalmol. 2004;138(4):527-35.
6. Kymes SM, Walline JJ, Zadnik K, et al. Changes in the quality-of-life of people with keratoconus. Am J Ophthalmol. 2008;145(4):611-7.
7. Godefrooij DA, de Wit GA, Uiterwaal CS, et al. Age-specific incidence and prevalence of keratoconus: a nationwide registration study. Am J Ophthalmol. 2017;175:169-72.
8. Wollensak G, Spoerl E, Seiler T. Reticulación de colágeno inducida por riboflavina/ultravioleta-a para el tratamiento del queratocono. Am J Ophthalmol 2003;135(5):620-7.
9. Schumacher S, Mrochen M, Wernli J, et al. Modelo de optimización para el entrecruzamiento corneal con UV-riboflavina. Invest Ophthalmol Vis Sci. 2012;53(2):762-9.
10. Chang CY, Hersh PS. Enlace cruzado de colágeno corneal: una revisión de los resultados de 1 año. Lente de contacto ocular. 2014;40(6):345-52.
11. Hersh PS, Stulting RD, Muller D, et al. Ensayo clínico multicéntrico en Estados Unidos sobre el entrecruzamiento de colágeno corneal para el tratamiento del queratocono. Ophthalmology. 2017;124(9):1259-70.
12. Hersh PS, Stulting RD, Muller D, et al. Ensayo clínico multicéntrico estadounidense de entrecruzamiento de colágeno corneal para el tratamiento de la ectasia corneal después de la cirugía refractiva. Ophthalmology. 2017;124(10):1475-84.
13. Raiskup F, Theuring A, Pillunat LE, Spoerl E. Crosslinking de colágeno corneal con riboflavina y luz ultravioleta-a en queratocono progresivo: resultados a diez años. J Cataract Refract Surg. 2015;41(1):41-6.
14. Spoerl E, Mrochen M, Sliney D, Trokel S, Seiler T. Seguridad de la reticulación de la córnea con UVA-riboflavina. Cornea. 2007 May;26(4):385-9.
15. Schumacher S, Mrochen M, Wernli J, et al. Optimization model for UV-riboflavin corneal cross-linking. Invest Ophthalmol Vis Sci. 2012;53(2):762-9.
16. Bottós KM, Schor P, Dreyfuss JL, et al. Effect of cornea epithelium on ultraviolet-a and riboflavin absorption. Arq Bras Oftalmol. 2011;74(5):348-51.
17. Richoz O, Hammer A, Tabibian D, et al. The biomechanical effect of corneal collagen cross-Linking (CXL) with riboflavin and UV-A is oxygen dependent. Transl Vis Sci Technol. 2013;2(7):6.
18. Padmanabhan P, Rachapalle Reddi S, Rajagopal R, et al. Corneal collagen cross-linking for keratoconus in pediatric patients-long-term results. Cornea. 2017;36(2):138-43.
19. Naderan M, Jahanrad A. Cambios topográficos, tomográficos y biomecánicos de la córnea durante el embarazo en pacientes con queratocono: un estudio de cohorte. Acta Ophthalmol. 2017;95(4):e291-e296.
20. Sandvik GF, Thorsrud A, Råen M, et al. ¿Reduce el cross-linking de colágeno corneal la necesidad de queratoplastias en pacientes con queratocono? Cornea. 2015;34(9):991-5.
21. Gomes JA, Tan D, Rapuano CJ, et al. Consenso global sobre queratocono y enfermedades ectásicas. Cornea. 2015;34(4):359-69.
22. Nordström M, Schiller M, Fredriksson A, Behndig A. Mejoras refractivas y seguridad con crosslinking corneal guiado por topografía para el queratocono: resultados de 1 año. Br J Ophthalmol. 2017;101(7):920-5.
23. Yildiz EH, Diehl GF, Cohen EJ, et al. Demografía de pacientes mayores de 50 años con queratocono. Eye Contact Lens. 2009;35(6):309-11.
24. Mazzotta C, Hafezi F, Kymionis G, et al. Microscopía confocal in vivo tras el entrecruzamiento de colágeno corneal. Ocul Surf. 2015;13(4):298-314.
25. Cınar Y, Kürs¸at Cingü A, Turkcu FM, et al. Accelerated corneal collagen cross-linking for progressive keratoconus. Cutan Ocul Toxicol. 2014;33:168-71.
26. Kanellopoulos AJ. Resultados a largo plazo de un ensayo prospectivo aleatorizado de comparación de ojos bilaterales de mayor fluencia, menor duración de la radiación ultravioleta a y reticulación de colágeno con riboflavina para el queratocono progresivo. Clin Ophthalmol. 2012;6:97-101.
27. Cummings AB, McQuaid R, Naughton S, et al. Optimización del cross-linking corneal en el tratamiento del queratocono: una comparación de los resultados después de los protocolos estándar y de alta intensidad. Cornea. 2016;35(6):814-22.
28. Vinciguerra P, Albè E, Trazza S, et al. Análisis refractivo, topográfico, tomográfico y aberrométrico de ojos queratocónicos sometidos a cross-linking corneal. Ophthalmology. 2009;116(3):369-78.
29. Kim BZ, Jordan CA, McGhee CN, Patel DV. Natural history of corneal haze after corneal collagen crosslinking in keratoconus using Scheimpflug analysis. J Cataract Refract Surg. 2016;42(7):1053-9.
30. Wollensak G, Iomdina E. Cambios biomecánicos e histológicos tras el crosslinking corneal con y sin desbridamiento epitelial. J Cataract Refract Surg. 2009;35(3):540-6.
31. Caporossi A, Mazzotta C, Paradiso AL, et al. Transepithelial corneal collagen crosslinking for progressive keratoconus: 24-month clinical results. J Cataract Refract Surg. 2013;39(8):1157-63.
