REVISIONES
Significado de la anemia en las diferentes etapas de la vida
Significance of anaemia in the different stages of life
Guzmán Llanos, María José*; Guzmán Zamudio, José L.** y LLanos de los Reyes-García, M.J.***
*Enfermera de Pediatría Hospital SAS de Jerez de la Frontera (Cádiz). E-mail: [email protected]
**Phd.Médico Hematólogo.
***Enfermera Hospital de Día de Hematología-Oncología Hospital del SAS de Jerez de la Frontera (Cádiz)
RESUMEN
Resumen: La anemia presenta una elevada prevalência en las consultas de atención primaria y pediatría, y la ADH representa el 50% de todos los casos de anemia.
Metodología: Revisión bibliográfica y análisis descriptivo documental sobre etiopatogenia de la anemia ferropénica, las pruebas diagnósticas básicas para el estudio de la ADH y su significado, utilizando una temporalidad determinada en la búsqueda documental y criterios de inclusión atendiendo a las dimensiones que se analizan en el estudio: Nociones acerca del metabolismo del hierro. Nociones acerca de la hematopoyesis. Diagnóstico por el laboratorio y clasificación de las anemias. Clínica de la anemia ferropénica. Causas de la deficiencia de hierro.
Resultados y conclusión: EL estudio documental efectuado nos presenta la existencia de publicaciones con contenidos sobre etiopatogenia de la anemia ferropénica, las pruebas diagnósticas básicas para el estudio de la ADH y su significado, evidenciando la importancia de este contenido para el profesional de enfermería en el área de la atención primaria y pediatría.
Palabras clave: anemia por deficiencia de hierro; anemia en la gestación, anemia en el anciano.
ABSTRACT
Resumen: La anemia es muy frecuente en las consultas de atención primaria y pediatría, y la ADI es la causa del 50% de los casos de anemia.
Metodología: Revisión bibliográfica y análisis documental descriptivo de la patogénesis de la anemia ferropénica, de las pruebas diagnósticas básicas para el estudio de la ADI y del significado de las mismas utilizando un periodo de tiempo concreto en la búsqueda documental y unos criterios de inclusión que tienen en cuenta los factores que se analizan en el estudio: Ideas sobre el metabolismo del hierro. Ideas sobre la hematopoyesis. Diagnóstico de laboratorio y clasificación de la anemia. Características clínicas de la anemia ferropénica. Causas de la deficiencia de hierro.
Resultados y conclusión: El estudio documental por etapas recoge las publicaciones sobre la patogénesis de la anemia ferropénica, las pruebas diagnósticas básicas para el estudio de la ADI y el significado de las mismas, y pone de manifiesto la importancia de estos datos para el profesional de enfermería en el ámbito de la atención primaria y pediátrica, para identificarla y actuar en consecuencia.
Palabras clave: Anemia ferropénica; anemia en el embarazo; anemia en la tercera edad.
Introducción
La OMS define la anemia como el descenso del nivel de hemoglobina dos desviaciones estándar por debajo de lo normal para la edad y el sexo(1). En términos prácticos podemos adoptar las cifras de 13 gr/dl en el hombre, 12 gr/dl en las mujeres y 11 en la embarazada. En los niños de 6 meses a 6 años 11/gr/dl y de 6 años a 14 años, 12 gr/dl. Estos criterios están basados en estudios de población que no incluyen a personas mayores de 65 años por lo que tal vez no se pueda aplicar a los ancianos.
La anemia presenta una elevada prevalencia en las consultas de atención primaria, pediatría y en el control de la gestación. No es lo mismo la deficiencia de hierro (DH) que la anemia por deficiencia de hierro (ADH). La ADH es la causa más frecuente de anemia en todo el mundo y representa un importante problema de salud principalmente en los países subdesarrollados. La ADH es muy prevalente de forma que hasta un 5% de niños y adolescentes, un 10% de las mujeres pre menopáusicas y un 1% de los hombres tienen anemia por deficiencia de hierro; y puede llegar hasta un 40% de los ancianos que se cuidan en sus domicilios.
La mayoría de los servicios de salud cuentan con guías clínicas del control de la anemia en general y/o la anemia de la gestación (2,3)
La anemia gestacional se considera un factor de riesgo para el embarazo y puede causar anemia en el periodo de recién nacido debido al escaso depósito de hierro. (4)
Anemia en la infancia: la ADH afecta al crecimiento y al desarrollo de los niños, disminuye la resistencia a las infecciones y altera el desarrollo cognitivo y psicomotor.(5,6)
Según el informe de la OMS del periodo 1993-2005 la prevalencia de la ADI en los preescolares puede representar el 47.4% y la para la misma agencia la presencia de más de un 40% representa un grave problema de salud. (7).
En la ADH de la mujer postmenopáusica, el adulto y el anciano siempre hay que descartar una pérdida digestiva.
Objetivo
EL objetivo de este trabajo se centra en identificar la etiopatogenia de la anemia ferropénica, las pruebas diagnósticas básicas para el estudio de la ADH y su significado, mediante una revisión bibliográfica, y reconocer precozmente los diferentes estadios de la deficiencia de hierro en las consultas de atención primaria, pediatría y en la atención a la embarazada, como acción preventiva y oportunidad de mejora en todas aquellas actividades propias de enfermería en estos procesos.
Metodología
Revisión bibliográfica de la literatura publicada sobre la etiopatogenia de la anemia ferropénica y pruebas diagnósticas para el estudio de la ADH y su significado. Estudio descriptivo documental procedente de diferentes fuentes bibliográficas y Bases de Datos sobre el tema objeto de estudio.
La temporalidad utilizada en la búsqueda bibliográfica se ha centrado entre los años 2000-2014, así como alguna otra bibliografía de carácter referencial sobre el tema analizado, fuera de esta temporalidad.
Los criterios de inclusión en la búsqueda bibliográfica atienden a los artículos y documentación publicada sobre el tema, dentro de la temporalidad seleccionada, depurándose en virtud de sus contenidos y dimensiones a analizar (Nociones acerca del metabolismo del hierro. Nociones acerca de la hematopoyesis. Diagnóstico por el laboratorio y clasificación de las anemias. Clínica de la anemia ferropénica. Causas de la deficiencia de hierro).
Se han utilizado como descriptores o palabras clave de la búsqueda: anemia por déficit de hierro en la infancia (4368 artículos), anemia por deficiencia de hierro en la gestación (hasta 2173 artículos) y en el anciano (4605) y de estos se ha hecho una selección, atendiendo a los criterios de inclusión de la revisión efectuada.
Resultados
1.-Nociones acerca del metabolismo del hierro
La importancia del hierro se debe a que forma parte de la hemoglobina y de los citocromos. Una vez completado el crecimiento, el hierro corporal permanece fijo dentro de unos márgenes muy estrechos. El hierro corporal es ciclado y reciclado a través de varios pool. (8,9)
– Absorción: El hierro que tomamos con los alimentos tiene que ser absorbido, luego transportado por la sangre y por último almacenado para formar el hierro de depósito (las reservas del mismo). El hierro que tomamos con los alimentos viene en la forma Fe +++ pero se absorbe en el duodeno y yeyuno superior en la forma Fe ++, por lo tanto tiene que sufrir un proceso de reducción en el que interviene el ácido ascórbico. Solo se absorbe un 10% del hierro de la alimentación lo que representa el 0.25 %o del hierro corporal total. Diversos factores favorecen o dificultan la absorción del hierro.
La absorción del hierro se ajusta a las necesidades del mismo por el cuerpo. En el caso de la anemia ferropénica se favorece la absorción del mismo. El metabolismo del hierro es único en el sentido de que el balance férrico se controla fundamentalmente por la absorción más que por la excreción.
El hierro de la dieta: el contenido en hierro de la dieta es de aproximadamente de 10 a 30 mgr/día para un adulto. Con la absorción del 5 a 10% de-l hierro de la dieta (0.5 a 1 mgr) La proporción se incrementa al 20% en caso de deficiencia de hierro y se disminuye en caso de sobrecarga de hierro.
– Transporte: El hierro en la sangre se une a su proteína transportadora transferrina). El complejo hierro-transferrina es captado en las células por un receptor específico.
La transferrina se sintetiza en el hígado y su concentración en la sangre excede la capacidad de fijación del hierro y aproximadamente dos tercios de la capacidad de fijación no están saturados.
Por último, el hierro tiene que ser almacenado en forma de ferritina y/o hemosiderina; aproximadamente 1 microgramo/L de ferritina sérica corresponde a 10 mg de hierro almacenado.
Distribución del hierro: el pool más importante del hierro está en los hematíes como hierro unido a l hemoglobina y son aproximadamente 2500 mg. Otros 40 mg forman parte de la mioglobina. Los órganos de depósito almacenan de 800 a 1200 mg. Sólo 4 mg está en forma de hierro unido a la transferrina.
Necesidades de hierro y balance del mismo: Las necesidades de un adulto sano y una mujer postmenopáusica son de aproximadamente de 1 mg/día.
Las necesidades suben a 5 mg en el caso de la mujer en edad fértil, donantes de sangre etc.
En el caso de la mujer embarazada las necesidades son de 7 mg/d.
La eliminación de hierro no está tan bien regulada; aproximadamente 1 mgr de hierro por días se elimina por intestino, orina y perspiratio. Con la menstruación se pierden entre 15 a 30 mg de hierro que se pueden compensar con un aumento de la absorción pero es mas difícil de compensar en caso de las menorragias; otra causa puede ser la frecuente hemodonación y en la edad infantil el exceso de pruebas analíticas.
2.-Nociones acerca de la hematopoyesis
La formación de los elementos formes de la sangre (leucocitos, hematíes y plaquetas) tiene lugar en la médula ósea y el proceso se llama hematopoyesis. A partir de una célula madre pluripotencial y estimulada por la eritropoyetina esta célula madre después de varias transformaciones daría lugar a la formación del hematíe maduro proceso conocido como eritropoyesis(10). La eritropoyetina (EPO) es el principal factor de crecimiento para regular la eritropoyesis. Se produce en el riñón. Estimula la proliferación de la serie eritroide y la liberación del reticulocito de la médula ósea. Aproximadamente el 20-30% de las células madres se diferencian hacia la eritropoyesis. El hematíe es una célula anucleada, cuya función principal, gracias a la hemoglobina (Hb) es transportar el oxigeno a los tejidos.
La síntesis de la hemoglobina ocurre en el estadio de normoblasto, y cuando este está totalmente hemoglobinizado se libera el núcleo y da lugar al reticulocito.
Para mantener una normal hematopoyesis se necesita un adecuado aporte de hierro y una concentración adecuada de vitamina B-12 y de ácido fólico.
La Hb está formada por una parte proteica (globina) y el grupo hemo (que lleva el átomo de hierro ferroso).
Con el envejecimiento de los hematíes estos son fagocitados por las células del sistema mononuclear fagocitico. Ello ocurre aproximadamente a los 120 días y son usados aproximadamente el 0.8% del pool de los eritrocitos manteniéndose un equilibrio entre lo que se forma y lo que se destruye.
3.- Diagnóstico por el laboratorio y clasificación de las anemias
3.1.- El laboratorio en el diagnóstico de la anemia ferropénica.(4). En primer lugar hay que confirmar que el paciente tiene anemia y a continuación que esta se debe a un déficit de hierro y para ello solicitaremos:
– El hemograma es la prueba más básica, nos aporta mucha información pues nos aporta el número de hematíes, el valor de la hemoglobina y los índices corpusculares VCM, HCM. Además del número de leucocitos y plaquetas. Y todo ello es de utilidad a la hora de la clasificación de la anemia. Es frecuente que la anemia ferropénica se acompañe de una trombocitosis reactiva.
– Parámetros relacionados con el metabolismo del hierro: sideremia, transferrina, índice de saturación de la transferrina y el receptor soluble de la transferrina (RsTf)
– Valoración de los depósitos: ferritina sérica.
– Revisión del frotis sanguíneo: nos pone de manifiesto el contenido en hemoglobina (hipocromía), las alteraciones de la forma (poiquilocitosis) y del tamaño (anisocitosis) que nos orientan en el correcto diagnóstico.
Significado clínico de las diferentes proteínas que intervienen en el transporte y el depósito del hierro.
Ferritina: Es la proteína más importante de depósito del hierro. Se encuentran altas concentraciones de la misma en el hígado, bazo y en la médula ósea. Contiene entre el 15 y 20% del hierro del cuerpo.
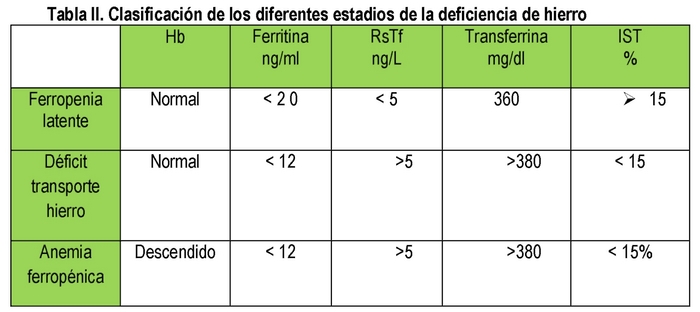
Una pequeña cantidad de la ferritina producida es secretada por las células y pasa a la circulación sanguínea. Existe una correlación directa entre la cantidad de esta proteína y el hierro almacenado de forma que: 1 mcg/L de ferritina sérica corresponde a 10 mgr de hierro almacenado. La ferritina sérica es un buen indicador de los depósitos de hierro. (11) Pero también hay que tener en cuenta que la ferritina es un reactante de fase aguda, por lo que en ocasiones habrá que solicitar también la proteína c reactiva (PCR) para poder descartar la presencia de un proceso infeccioso/inflamatorio. La ferritina es por lo tanto muy útil para la valoración del metabolismo del hierro. Unos valores < de 12 ng/ml definen la existencia de una deficiencia latente de hierro. Una ferritina elevada > de 400 ng/ml puede indicar la presencia de una sobrecarga de hierro.
Transferrina, saturación de la transferrina: La transferrina es una proteína sintetizada en el hígado y entre el 15 a 45% está saturada con hierro. Si el aporte de hierro funcional no es el apropiado entonces se aumentará la síntesis de esta proteína; valores elevados se encuentran en la deficiencia de hierro y el embarazo.
Receptor soluble de la transferrina (RsTf): Aproximadamente el 75% de los receptores de la transferrina se localizan en los precursores de la eritropoyesis. El número de los receptores de transferrina se incrementa cuando el aporte funcional de hierro es pobre. La forma soluble se conoce como (RsTf). Este es el único marcador
biológico que indica un inadecuado suministro de hierro a la eritropoyesis. Tiene, por lo tanto, un valor complementario a la ferritina. El RsTf no se ve afectado con los reactantes de fase aguda de forma que indica una deficiencia de hierro en presencia de infección, inflamación y/o tumores.(12)
3.2- Clasificación de las anemias
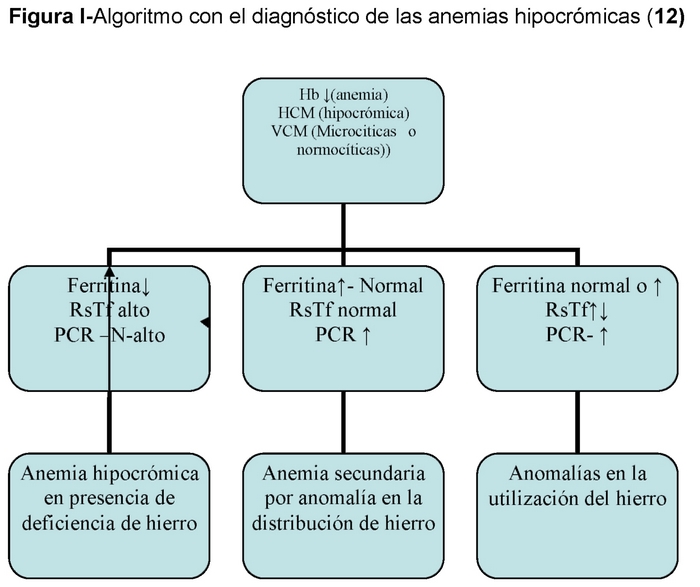
Una forma práctica de clasificar las anemias es atendiendo al tamaño de los hematíes (VCM) y al contenido en hemoglobina de los mismos (HCM). Estos son dos parámetros que nos lo aporta la lectura de cualquier hemograma de los modernos contadores de células.
– Según el tamaño hablamos de anemias normocíticas, microciticas y macrocíticas y según el contenido en Hb (HCM) hablamos de anemias normocrómicas, hipocrómicas e hiperrcrómicas.13 (Tabla I).

En el caso de las anemias por déficit de hierro normalmente son microciticas e hipocrómicas.
Abreviaturas:
– DH: deficiencia de hierro
– ADH: anemia por deficiencia de hierro
– Hb: hemoglobina
– VCM: volumen corpuscular medio
– HVM: hemoglobina corpuscular media
– RsTf: receptor soluble de la transferrina
– PCR: proteína C reactiva
– Según la gravedad clínica:
• Anemia severa: Hb < 7.0 gr/dl
• Anemia moderada 7.1 -10.0 gr/dl
• Anemia leve 10.1 – 10.9 gr/dl
La ADH es el estadio final de un proceso que se inicia con la ferropenia latente en la que no hay anemia pero si déficit de ferritina a continuación el déficit de transporte de hierro en el que además de la ferritina baja hay un IST por debajo del 15% y por último la ADH con ferritina baja, IST < 15% y anemia. (Tabla II)
– Otras anemias con anomalía de la distribución del hierro: 14,15
Anemia de las enfermedades crónicas (AEC): En estos casos existe una redistribución del hierro con aumento del hierro de depósito y una relativa deficiencia de hierro de las células eritropoyéticas como consecuencia de una síntesis reducida de la transferrina. Esta reducida disponibilidad de hierro tendría un efecto protector contra la infección.
Anemia de la enfermedad renal: En este caso los depósitos de hierro son normales pero la movilización de hierro está alterada (baja saturación de la transferrina) lo que puede conducir a una deficiente eritropoyesis y deficiente función del hierro. No se puede utilizar el hierro oral porque la absorción está disminuida.
En ocasiones la anemia renal se ve complicada por un componente hemolítico.
– Anomalías de la eritropoyesis no inducidas por el hierro:
Déficit de vitamina B-12 y ácido fólico
Talasemias: en esta enfermedad existe una disminución o ausencia de síntesis de las cadenas de globina. La estructura de la cadena de globina es normal. Dependiendo de la cantidad de globina afectada se habla de talasemia alfa, beta, gamma, delta. Se suelen manifestar con microcitosis, hipocromía y anemia de intensidad variable. 13,14
Por la microcitosis e hipocromía se puede confundir con la anemia ferropénica.
Las más frecuentes la talasemia alfa menor y la beta menor. Hay que tener en cuenta que los niños con talasemia pueden tener además una anemia ferropénica por lo que pueden necesitar tratamiento con hierro oral. Al disminuir la síntesis de una cadena de globina aumenta la síntesis de las otras globinas (Hb A2, Hb F). La cuantificación de estas hemoglobinas nos ayuda en la clasificación de las mismas.
Ahora bien, no todas las anemias microciticas e hipocrómicas son ferropenias y en este grupo hay que destacar aquellas en las que hay una mala utilización del hierro, tales como la anemia de los trastornos crónicos, etc.
4.- Clínica de la anemia ferropénica.
La clínica de la anemia ferropénica no es diferente a la del resto de las anemias, es decir, es inespecífica; y se traduce fundamentalmente en fatiga, cansancio, falta de fuerzas; pero estos síntomas van a depender más de la velocidad de instauración de la anemia que de los niveles de hemoglobina.
Gran parte de los síntomas se pueden explicar por la deficiencia de hierro.
Pagofagia: tendencia compulsiva a comer hielo.
Geofagia: tendencia a comer cosas sucias
Cambios en los epitelios: coiloniquia, estomatitis angular, atrofia de las papilas linguales, cambios en las mucosas del intestino.
Intolerancia al ejercicio Comportamientos en la conducta: el niño se vuelve apático e irritable.
5.-Causas de la deficiencia de hierro: (16)
Aumento de las necesidades fisiológicas: crecimiento, menstruación, embarazo, lactancia.
Pérdida de sangre: gastrointestinal, urogenital, iatrogénico
Mal absorción: resecciones gástricas, gastritis crónica atrófica, fármacos Aporte inadecuado: ancianos, vegetarianos
La ADH forma parte de un diagnóstico más complejo y no tiene el mismo significado en las diferentes etapas de la vida.
A.- En la infancia estaría explicada por el aumento de las necesidades producidas por el crecimiento. En el caso del niño enfermo es muy importante el número y la cantidad de sangre extraída para los estudios(7,18,19)
El recién nacido comienza la vida con unos 80 mgr de hierro por Kg de peso y la mayor parte de este hierro forma parte de la Hb con 50 gr/Kg. La cantidad de hierro del recién nacido viene determinada por el peso corporal y la masa de hemoglobina circulante. El cortar el cordón umbilical inmediatamente después del parto puede suponer la pérdida del 15% al 30% del hierro total. La concentración de Hb de los recién nacidos es independiente de los niveles de Hb y hierro de la madre. Tampoco existe correlación entre los niveles de ferritina de la madre y la sangre de cordón.
Los recién nacidos de madres diabéticas, a pesar de su elevado peso, pueden tener deficiencia de hierro.
En los 5 primeros meses de vida el recién nacido es capaz de duplicar su peso corporal sin por ello vaciar los depósitos de hierro. Después la absorción del hierro es importante para mantener el balance del hierro.
Durante el primer año de vida los requerimientos son mayores que durante el resto de la vida. El niño necesita unos 0.5 mgr/d para satisfacer las necesidades impuestas por el crecimiento. La leche es poco probable que pueda aportar esta cantidad de hierro, sin embargo, la anemia ferropénica es poco frecuente en los niños que son exclusivamente amamantados Esto se podría explicar porque el hierro de la leche se absorbe hasta un 80%. El estado nutricional de los niños amamantados con leche es superior al de los niños alimentados con leche de vaca. Entre los 6 y 12 meses los niños amamantados con leche sí pueden desarrollar una deficiencia de hierro.
La prevalencia de la DH está relacionada con el nivel socieconómico de la familia).También se relaciona con la función cognitiva e incluso con las convulsiones febriles.
B.- En la mujer en la edad fértil lo explicaría el hierro perdido con la menstruación, el embarazo y la lactancia.(20)
La perdida menstrual en la mayoría de las mujeres es de 40 ml lo que equivale a 20 mgr de hierro. En Europa la dieta contiene suficiente hierro como para compensar pérdidas de sangre de 80 ml o lo que es lo mismo 1.2 mg/d. La excesiva menstrual es la principal causa de anemia y afecta al 9-14% de las mujeres (21)
El embarazo supone una pérdida de aproximadamente 680 mgr de hierro. Esta cantidad es muy superior a la que puede ser a absorbida por lo que durante el mismo se necesita suplemento de hierro.
Actualmente más de 40 millones de mujeres embarazadas en los países en desarrollo tienen deficiencia de hierro. La anemia por deficiencia de hierro explica el 75%-95% de las anemias del embarazo. La anemia ferropénica durante el embarazo se ha asociado con prematuridad, bajo peso al nacer, y morbilidad materna. Las necesidades de hierro varían a lo largo de la gestación. Se necesitan entre 4 y 5 mgr de hierro durante el 2o y tercer trimestre. La mejor manera de corregir este déficit es hacer profilaxis con hierro oral. Las necesidades fisiológicas de hierro durante el embarazo no se pueden suplir con la administrar de forma conjunta con ácido fólico. Las recomendaciones son de 60 mgr de hierro para mujeres sin anemia más el ácido fólico.(22)
C. – En la mujer postmenopáusica, el adulto y el anciano el diagnóstico podría ser más serio y habrá que descartar una pérdida digestiva(23).
En el anciano no están tan bien delimitados los niveles de Hb para definir la anemia.
En el anciano un nivel normal de ferritina no siempre excluye una deficiencia de hierro por lo que el nivel de corte para predecir la deficiencia de hierro hay que subirlo hasta los 50 microgramos/L.
En este grupo de pacientes está indicado el estudio gastrointestinal por la elevada frecuencia con la que se detectan lesiones ocultas.
En los mayores de 75 años con anemia por déficit de hierro hasta el 68% de los pacientes que se hizo endoscopia se le detectó la causa de sangrado y hasta un 11% de los casos una lesión síncrona.
La ausencia de deficiencia de hierro no excluye la presencia de una neoplasia gastrointestinal(24). Hasta en un 20-30% de los ancianos la causa de la anemia es desconocida lo que se conoce como la «anemia idiopática del envejecimiento»
Conclusiones
– El diagnóstico y clasificación de la ADH se basa en técnicas básicas y fáciles de obtener en cualquier laboratorio clínico,
– La ADH es el final de un proceso que se inicia con la deficiencia de hierro.
– La clínica de la ADH es similar a la de otras anemias pero hay síntomas específicos que se pueden atribuir a la deficiencia de hierro.
– La ADH es la anemia más prevalente en todas las etapas de la vida
– En la infancia entre los 6 y 12 meses de edad los niños alimentados exclusivamente con leche de vaca pueden desarrollar una deficiencia de hierro. En el niño ingresado una causa importante es el número de extracciones de sangre.
– La ADH explica el 75%-95% de las anemias del embarazo
– En el caso de la mujer postmenopáusica, adulto y anciano siempre hay que descartar una pérdida digestiva.
– En el anciano hasta un 20-30% de las caso la etiología es desconocida
Referencias
1. World Health Organization. Iron deficiency anaemia assessment, prevention and control. A guide for programme managers. Geneva, Switzerland. World Health Organization 2001.
2. Proceso asistencial anemia. Proceso de anemia. Proceso asistencial integrado (Sevilla) Conserjería de Salud 2013. http://hdl.handle.net/10668/1683.
3. Ministerio de Salud Pública. Guía de práctica clínica. Diagnóstico y tratamiento de la anemia en el embarazo. 1a Edición, Quito. Dirección Nacional de normalización. 2014. http://saludgob.ec.
4. Matthew W, Domagalski, JE. Iron deficiency anemia: evaluation and management. American Family Physician 2013, vol 87, 2, 98-104.
5. Baker RD. Informe clínico Diagnóstico y prevención de la deficiencia de hierro y la anemia por deficiencia de hierro en bebés y niños pequeños (0-3 años de edad) Pediatrics vol 126: %, 1040-1051, 2010. http://www.bcguidelines.ca/pdf/iron_deficiency.pdf.
6. Lukens J N. Metabolismo del hierro y deficiencia de hierro. Chapter 6. Blood Diseases of Infancy and Childhood. 7-o edition.1995 Mosby.
7. OMS 1993-2005.Prevalencia mundial de la anemia.- 1993-2005 OMS. Base de datos mundial sobre la anemia. http://whqlibdoc.who.int/publications/2008/978924159657_eng.pdf.
8. Aisen P. Conceptos actuales sobre el metabolismo del hierro1-18; Clínica Hematológica; vol 10/2. Trastorno del metabolismo del hierro 1984. Salvat Editores.
9. Wick M, Pinggera W, Lehmann P. Aspectos clínicos y laboratorio del metabolismo del hierro, anemias. Conceptos novedosos en las anemias de las neoplasias y las enfermedades renales y reumatoides. Quinta edición ampliada. 2013 Springer Wien New York.
10. Rapaport S.I. Eritropoyesis. Capítulo 1, 2-5 Introducción a la hematología 1974. Salvat Editores.
11. Goddard AF, James MW; Mcintyre AS, Scott BB; British Society of Gastroenterology. Directrices para el manejo de la anemia por deficiencia de hierro. Gut. 2011; 60 (10): 1309-1316.
12. Mast AE, Blinder MA, Gronosky AM, Chumley C, Scott MG. Utilidad clínica del receptor soluble de transferrina y comparación con la ferritina sérica en varias poblaciones. Clin Chem. 1998; 44(1): 45-51.
13. Tefferi A, Hansen CA, Inwards DS. Cómo interpretar y perseguir un recuento completo de células sanguíneas anormal en adultos. Mayo Clin Proc 2005, 80: 923-936.
14. Wick M, Pinggera W, Lehmann P. Clinical aspects and laboratory iron metabolism, anaemias. Diagnóstico de las alteraciones del metabolismo del hierro. Alteraciones de la eritropoyesis. Quinta edición ampliada. 2003. Springer Wien New York.
15. Goddard AF, James MW, Mcintyre AS, Scott BB; Sociedad Británica de Gastroenterología. Directrices para el manejo de la anemia por deficiencia de hierro. Gut. 2011; 60 (10); 1309-1316.
16. Orkin HS, Nathan DG. Las talasemias. Chapter 21. Nathan and Oski’s Hematology of Infancy and childhood. 5a Edition.1998 W. B. Saunders Company.
17. Lee GR. Microcitosis y las anemias asociadas a la alteración de la síntesis de la hemoglobina. Chapter 25. Wintrobe’s Cllinical Hematology. Ninth Edition.1993. LEA y FEBIGER.
18. Verga M E. Deficiencia de hierro en la infancia: ¿tiene más riesgo un inmigrante? Swiss Med Wkly 2014; 144w14065.
19. Carter RC, Jacobson JL, Burden M et al. Anemia por deficiencia de hierro y función cognitiva en la infancia. Pediatrics 2010; 126 (2) 427-434.
20. Mohammad Reza Sharif, Davood Kheirkhah, et al. The relationship between iron deficiency and febrile convulsion: a case-control study. Revista global de ciencias de la salud. Global Journal of Health Science. 2016. Vol 8 (2)185-189.
21. Breyman C. Iron deficiency in pregnancy. Seminars in hematol;2015; vol 52 (4) 339-347.
22. Fraser IS, Langhan S, Uhl- Hochgraeber K. Calidad de vida relacionada con la salud y carga económica del sangrado uterino anormal. Expert Rev Obstet Gynecol 2009; 4 (2):179-189.
23. Ioannou GN, Rockey DC, Bzyson C, Weis NS. La deficiencia de hierro y la malignidad gastrointestinal: un estudio de cohorte basado en la población. Am J Med 2002. 113(4):276-280.
24. Joosten E, Ghesquiere B, Lindhoudt, et al. Upper and lower gastrointestinal evaluation of elderly impatiens who are iron deficient. Am J Med 1999: 107: 24.
