Rezultate
Figura 1
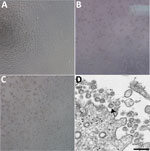
Figura 1. Efect citopatic cauzat de coronavirusul 2 al sindromului respirator acut sever 2 de la un pacient cu boală coronavirus, Statele Unite, 2020. A-C) Microscopie cu contrast de fază a monostraturilor de celule Vero la 3 zile postinoculare: A) Mock,…
Un pacient a fost identificat cu COVID-19 confirmat în statul Washington la 22 ianuarie 2020. CPE nu a fost observat în celulele infectate simulat (Figura 1, panoul A). Valorile pragului de ciclu (Ct) au fost de 18-20 pentru probele NP și de 21-22 pentru probele OP (1). Specimenele clinice pozitive au fost alicotate și recongelate și inoculate în culturi celulare la 22 ianuarie 2020. Am observat CPE la 2 zile postinoculare și am recoltat lizatul viral în ziua 3 postinoculare (Figura 1, panourile B, C). Am utilizat 50 μL de lizate virale de pasaj 1 pentru extracția de acid nucleic pentru a confirma prezența SARS-CoV-2 prin utilizarea testului de diagnostic molecular CDC (1). Valorile Ct ale celor 3 extracții de acid nucleic au fost de 16,0-17,1 pentru porțiunea nucleocapsidică 1, 15,9-17,1 pentru porțiunea nucleocapsidică 2 și 16,2-17,3 pentru porțiunea nucleocapsidică 3, ceea ce a confirmat izolarea SARS-CoV-2 (Ct <40 este considerat un rezultat pozitiv). Am testat, de asemenea, extractele pentru alți 33 de agenți patogeni respiratori diferiți folosind testul Fast Track 33 Assay. Nu au fost detectați alți agenți patogeni. Identitatea a fost susținută în plus de microscopia electronică în secțiune subțire (figura 1, panoul D). Am observat o morfologie și o morfogeneză caracteristice coronavirusurilor.
Am folosit izolate din primul pasaj al unei probe OP și al unei probe NP pentru secvențierea genomului întreg. Genomurile din specimenul NP (nr. de accesare GenBank MT020880) și specimenul OP (nr. de accesare GenBank MT020881) au prezentat o identitate de 100% unul cu celălalt. De asemenea, izolatele au prezentat o identitate de 100% cu specimenul clinic corespunzător (nr. de acces GenBank MN985325).
După cel de-al doilea pasaj, nu am mai cultivat separat specimenele OP și NP. Am trecut izolatul de virus de încă 2 ori în celule Vero CCL-81 și am titrat prin determinarea dozei infecțioase de 50% din cultura de țesut (TCID50). Titrurile au fost de 8,65 × 106 TCID50/mL pentru al treilea pasaj și de 7,65 × 106 TCID50/mL pentru al patrulea pasaj.
Am trecut acest virus în absența tripsinei. Secvența proteinei spike a SARS-CoV-2 are o inserție RRAR la interfața S1-S2 care ar putea fi scindată de furină (16). Virușii gripei aviare înalt patogene au situsuri de clivaj de furină extrem de bazice la interfața proteinei hemaglutininei HA1-HA2 care permit maturarea intracelulară a virionilor și o replicare virală mai eficientă (17). Inserția RRAR din SARS-CoV-2 ar putea avea o funcție similară.
Figura 2
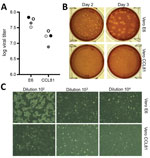
Figura 2. Propagarea virală și cuantificarea coronavirusului 2 al sindromului respirator acut sever 2 de la un pacient cu boală coronavirus, Statele Unite ale Americii, 2020. A) Au fost cuantificate două stocuri de virus de trecere 4 (cercuri negre și gri)…
Am generat ulterior un stoc de trecere 4 al SARS-CoV-2 pe celule VeroE6, o altă linie celulară de rinichi fetali de maimuță rhesus. Am secvențiat ARN-ul viral din stocul SARS-CoV-2 de trecere 4 și am confirmat că acesta nu prezintă mutații nucleotidice în comparație cu secvența de referință originală (nr. de acces GenBank MN985325). S-a constatat că SARS-CoV se dezvoltă bine pe celulele VeroE6 și MERS-CoV pe celulele Vero CCL81 (18,19). Pentru a stabili un test de placă și pentru a determina tipul de celule Vero preferat pentru cuantificare, am testat stocul nostru de pasaj 4 pe celule VeroE6 și VeroCCL81. După infectarea cu o serie de diluții, SARS-CoV-2 s-a replicat în ambele tipuri de celule Vero; cu toate acestea, titlurile virale au fost ușor mai mari în celulele VeroE6 decât în celulele Vero CCL81 (figura 2, panoul A). În plus, plăcile au fost mai distincte și mai vizibile pe celulele Vero E6 (figura 2, panoul B). Încă de la 2 zile postinoculare, celulele VeroE6 au produs plăci distincte vizibile prin colorare cu roșu neutru. În schimb, celulele Vero CCL81 au produs plăci mai puțin clare și au fost cel mai ușor de cuantificat prin colorarea cu roșu neutru la 3 zile postinoculare. Pe monostraturile de plăci individuale, infecția cu SARS-CoV-2 a celulelor Vero E6 a produs CPE cu zone de eliminare a celulelor (figura 2, panoul C). În schimb, celulele Vero CCL81 au prezentat zone de celule moarte care au fuzionat pentru a forma plăci, dar celulele nu au fost eliminate. Împreună, aceste rezultate sugerează că celulele VeroE6 ar putea fi cea mai bună alegere pentru amplificare și cuantificare, dar ambele tipuri de celule Vero susțin amplificarea și replicarea SARS-CoV-2.
Figura 3
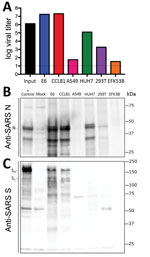
Figura 3. Liniile celulare de la pacientul cu boală coronavirus, Statele Unite, 2020, susceptibile la coronavirusul SARS 2 (SARS-CoV-2). Liniile celulare au fost infectate cu o multiplicitate mare de infecție (>5), spălate după adsorbție și…
Pentru că au fost inițiate cercetări pentru a studia și a răspunde la SARS-CoV-2, sunt necesare informații despre liniile și tipurile de celule susceptibile la infecție. Prin urmare, am examinat capacitatea SARS-CoV-2 de a infecta și de a se replica în mai multe linii celulare comune de primate și umane, inclusiv celule de adenocarcinom uman (A549), celule hepatice umane (HUH7.0) și celule de rinichi embrionar uman (HEK-293T), în plus față de celulele Vero E6 și Vero CCL81. Am examinat, de asemenea, o linie celulară disponibilă de rinichi de liliac brun mare (EFK3B) pentru capacitatea de replicare a SARS-CoV-2. Fiecare linie celulară a fost inoculată la o multiplicitate mare de infecție și examinată 24 de ore după infecție (figura 3, panoul A). Nu s-a observat niciun CPE în niciuna dintre liniile celulare, cu excepția celulelor Vero, care au crescut până la >107 PFU la 24 h postinfecție. În schimb, celulele HUH7.0 și 293T au prezentat doar o replicare virală modestă, iar celulele A549 au fost incompatibile cu infecția cu SARS-CoV-2. Aceste rezultate sunt în concordanță cu constatările anterioare privind sensibilitatea la SARS-CoV și sugerează că este puțin probabil ca alte sisteme de cultură comune, inclusiv celulele MDCK, HeLa, HEP-2, MRC-5 și ouăle embrionate, să susțină replicarea SARS-CoV-2 (20-22). În plus, SARS-CoV-2 nu s-a replicat în celulele EFK3B de liliac, care sunt sensibile la MERS-CoV. Împreună, rezultatele indică faptul că SARS-CoV-2 menține un profil similar cu SARS-CoV în ceea ce privește liniile celulare susceptibile.
După ce am stabilit o infecție robustă cu SARS-CoV-2 în mai multe tipuri de celule, am evaluat apoi reactivitatea încrucișată a anticorpilor împotriva SARS-CoV-2. Lizații celulare de la liniile celulare infectate au fost probate pentru analiza proteinelor; am constatat că serurile policlonale împotriva proteinei spike a SARS-CoV și a proteinelor nucleocapsidei recunosc SARS-CoV-2 (figura 3, panourile B, C). Proteina nucleocapsidă, care este extrem de conservată în întreaga familie din grupul 2B, păstrează >90% identitate de aminoacizi între SARS-CoV și SARS-CoV-2. În concordanță cu rezultatele replicării (figura 3, panoul A), SARS-CoV-2 a prezentat o proteină nucleocapsidă robustă în ambele tipuri de celule Vero, mai puțină proteină în celulele HUH7.0 și 293T și o proteină minimă în celulele A549 și EFK3B (figura 3, panoul B). Anticorpul împotriva proteinei spike a SARS-CoV a recunoscut, de asemenea, proteina spike a SARS-CoV-2, ceea ce indică o reactivitate încrucișată (figura 3, panoul C). În concordanță cu SARS-CoV, au fost observate mai multe forme scindate și nescindate ale proteinei SARS-CoV-2 spike. Modelul de scindare al controlului pozitiv al spike-ului SARS din celulele Calu3, o linie celulară respiratorie, variază ușor și ar putea indica diferențe între scindarea proteolitică a proteinelor spike între cele două virusuri din cauza inserției prezise a unui situs de scindare furin în SARS-CoV-2 (16). Cu toate acestea, diferențele în ceea ce privește tipul de celule și condițiile complică această interpretare și indică necesitatea unor studii suplimentare în sisteme echivalente. În general, datele privind expresia proteinelor din anticorpii împotriva nucleocapsidelor și a proteinelor spike ale SARS-CoV recapitulează constatările privind replicarea și indică faptul că reactivii SARS-CoV pot fi utilizați pentru a caracteriza infecția cu SARS-CoV-2.
Figura 4
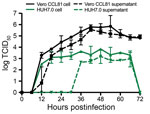
Figura 4. Curba de creștere în mai multe etape pentru coronavirusul 2 al sindromului respirator acut sever 2 de la un pacient cu boală coronavirus, Statele Unite ale Americii, 2020. Celulele Vero CCL81 (negru) și HUH7.0 (verde) au fost infectate la o multiplicitate de…
În cele din urmă, am evaluat cinetica de replicare a SARS-CoV-2 într-o curbă de creștere în mai multe etape. Pe scurt, am infectat celulele Vero CCL-81 și HUH7.0 cu SARS-CoV-2 la o multiplicitate scăzută a infecției (0,1) și am evaluat replicarea virală la fiecare 6 h timp de 72 h postinoculare, cu recoltări separate în compartimentele asociate celulelor și în cel supranatural (figura 4). La fel ca SARS-CoV, SARS-CoV-2 s-a replicat rapid în celulele Vero după o fază inițială de eclipsă, atingând 105 TCID50/mL la 24 h postinfecție și atingând un vârf de >106 TCID50/mL. Am observat titruri similare în compartimentele asociate celulelor și în compartimentul supernatant, ceea ce indică o ieșire eficientă. În ciuda titlurilor virale maxime la 48 h postinoculare, CPE major nu a fost observat până la 60 h postinoculare și a atins un maxim la 72 h postinoculare, ceea ce indică faptul că monostraturile infectate ar trebui recoltate înainte de a se observa CPE maxim. Replicarea în celulele HUH7.0 a crescut, de asemenea, rapid după o fază inițială de eclipsă, dar s-a stabilizat la 24 de ore postinoculare în compartimentul intracelular la 2 × 103 TCID50/mL și a scăzut după 66 de ore postinoculare. Virusul nu a fost detectat în supernatantul celulelor HUH7 infectate până la 36 h postinoculare și a prezentat titruri mai mici la toate momentele (figura 4). Nu s-a observat niciodată un CPE major în celulele HUH7.0. Aceste rezultate sunt în concordanță cu rapoartele anterioare pentru SARS-CoV și MERS-CoV, care au sugerat o dinamică de replicare similară între tulpinile CoV zoonotice (23,24).
.
