 |
|
Reacțiile acid-bază sunt omniprezente. În soluțiile apoase, acizii cresc concentrația ionilor de hidrogen (H+). Pe de altă parte, bazele cresc concentrația ionului hidroxid (OH-). Atunci când un acid și o bază reacționează într-o soluție apoasă, ionii H+ și OH- se combină pentru a forma apă. Acești ioni se „neutralizează” astfel unul pe celălalt:
Majoritatea acizilor au formula generală HA, în care A- este un anion, iar majoritatea bazelor au forma BOH, în care B+ este un cation corespunzător. Acizii și bazele pot fi grupați în două tipuri generale: acizi și baze puternice și baze slabe. Diferența dintre cei doi este simplă: un acid puternic într-o soluție de apă se descompune 100% în protoni (H+) și anioni (A-)
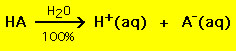
Pe de altă parte, majoritatea acizilor slabi se descompun semnificativ mai puțin de 100% într-o soluție de apă:
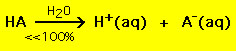 .
.Cu alte cuvinte, majoritatea moleculelor de acid slab rămân intacte în apă. Ecuații chimice similare sunt valabile pentru bazele puternice și slabe.
Există doar câțiva acizi și baze slabe, acestea sunt:
| |
|
|
HCl (acid clorhidric) HNO3 (acid azotic) HClO4 (acid percloric) . H2SO4 (acid sulfuric) |
NaOH (hidroxid de sodiu) KOH (hidroxid de potasiu) Ca(OH)2 (hidroxid de calciu) |
Toți ceilalți acizi și baze sunt slabi. Un acid slab rezultă din orice anion. Iată câteva exemple
| |
|
|
F- (fluorură) Br- (bromură) I- (iodură) HCO3- (bicarbonat) C2H3O2- (acetat) MnO4- (permanganat) PO4-3 (fosfat) CrO4-2 (cromat) CN- (cianură) NO2- (nitrit) SO3-2 (sulfit) |
HF (acid fluorhidric) HBr (acid bromhidric) HI (acid hidroiodic) . H2CO3 (acid carbonic) HC2H3O2 (acid acetic) HMnO4 (acid permanganic) H3PO4 (acid fosforic) acid) H2CrO4 (acid cromic) HCN (acid cianhidric) HNO2 (acid azotic) H2SO3 (acid sulfuros) |
Într-o reacție acid/bază tipică, acidul și baza reacționează pentru a forma o sare și apă e.g., acidul cianhidric și hidroxidul de sodiu:
