15.4 Proprietăți fizice ale acizilor carboxilici
Obiective de învățare
- Comparați punctele de fierbere ale acizilor carboxilici cu cele ale alcoolilor de masă molară asemănătoare.
- Comparați solubilitățile acizilor carboxilici în apă cu solubilitățile alcanilor și alcoolilor comparabili în apă.
Mulți acizi carboxilici sunt lichide incolore cu mirosuri neplăcute. Acizii carboxilici cu 5 până la 10 atomi de carbon au toți mirosuri de „capră” (explicând mirosul de brânză Limburger). Acești acizi sunt, de asemenea, produși de acțiunea bacteriilor de pe piele asupra sebumului uman (uleiuri de piele), ceea ce explică mirosul din vestiarele slab ventilate. Acizii cu mai mult de 10 atomi de carbon sunt solide asemănătoare cu ceara, iar mirosul lor se diminuează odată cu creșterea masei molare și, ca urmare, cu scăderea volatilității.
Acizii carboxilici prezintă o puternică legătură de hidrogen între molecule. Prin urmare, au puncte de fierbere ridicate în comparație cu alte substanțe de masă molară comparabilă.
Grupul carboxil se angajează cu ușurință în legături de hidrogen cu moleculele de apă (figura 15.3 „Legătura de hidrogen între o moleculă de acid acetic și moleculele de apă”). Acizii cu unul până la patru atomi de carbon sunt complet miscibili cu apa. Solubilitatea scade pe măsură ce lungimea lanțului de carbon crește, deoarece forțele de dipol devin mai puțin importante și forțele de dispersie devin mai predominante. Acidul hexanoic este abia solubil în apă (aproximativ 1,0 g/100 g de apă). Acidul palmitic , cu componenta sa mare de hidrocarburi nepolare, este în esență insolubil în apă. Acizii carboxilici sunt, în general, solubili în solvenți organici cum ar fi etanolul, toluenul și eterul dietilic.
Figura 15.3 Legătura de hidrogen dintre o moleculă de acid acetic și moleculele de apă
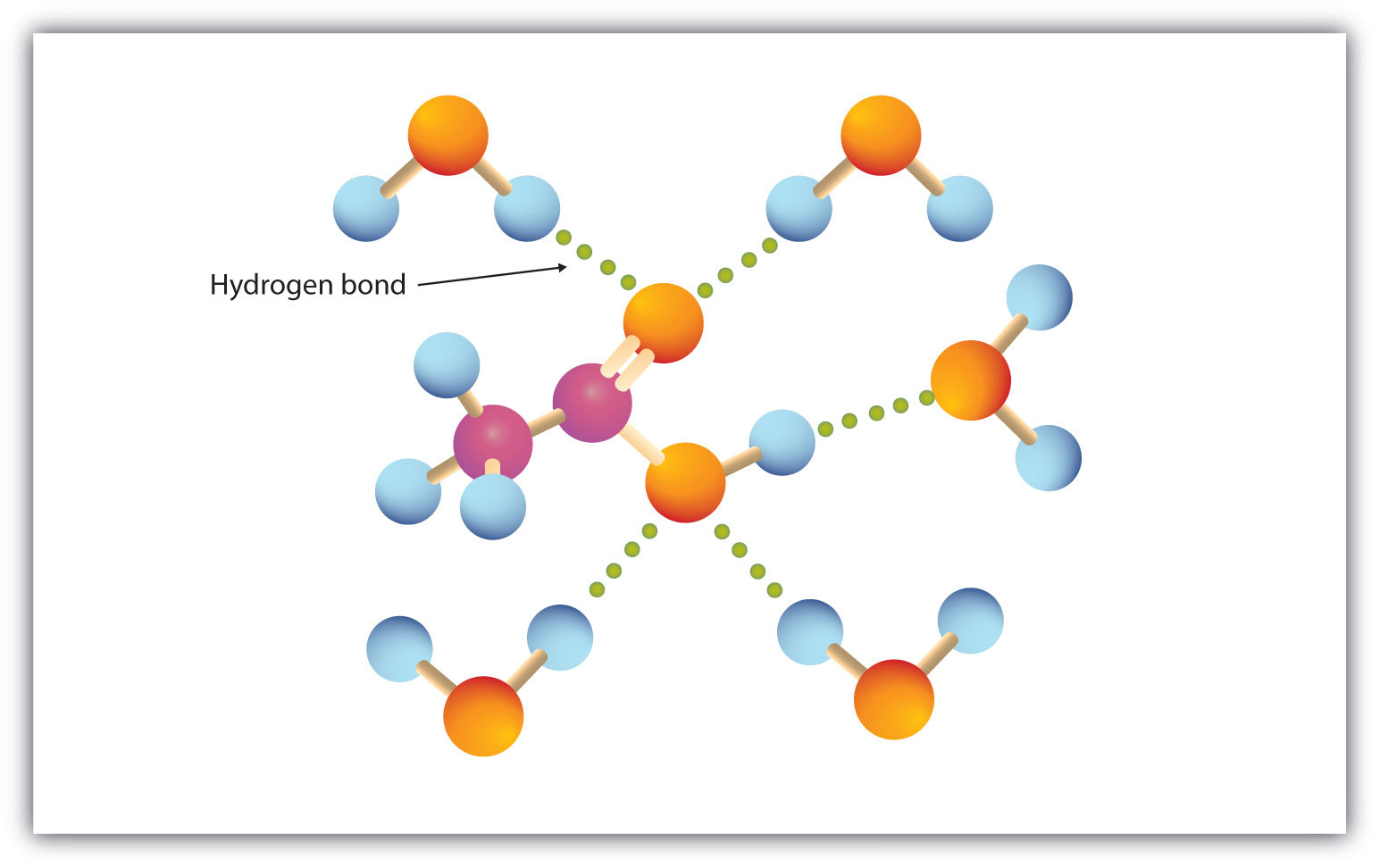
Acizii carboxilici de masă molară mică sunt destul de solubili în apă.
Tabelul 15.2 „Constantele fizice ale acizilor carboxilici” enumeră unele proprietăți fizice pentru anumiți acizi carboxilici. Primii șase sunt omologi. Observați că punctele de fierbere cresc odată cu creșterea masei molare, dar punctele de topire nu prezintă un tipar regulat.
Tabelul 15.2 Constantele fizice ale acizilor carboxilici
| Formula structurală condensată | Numele acidului | Punctul de topire (°C) | Punctul de fierbere (°C) | Solubilitate (g/100 g de apă) | |
|---|---|---|---|---|---|
| HCOOH | Acidul formic | 8 | 100 | miscibil | . |
| CH3COOH | acidul acetic | 17 | 118 | miscibil | |
| CH3CH2COOH | acid propionic | -22 | 141 | miscibil | |
| CH3(CH2)2COOH | acidul butiric | -5 | 163 | miscibil | |
| CH3(CH2)3COOH | acid valeric | -35 | 187 | 5 | |
| CH3(CH2)4COOH | acid caproic | -3 | 205 | 1.1 | |
| C6H5COOH | acid benzoic | 122 | 249 | 0.29 |
Exerciții de recapitulare a noțiunilor
-
Ce compus are punctul de fierbere mai mare – acidul butanoic (masa molară 88) sau 2-pentanona (masa molară 86)? Explicați.
-
Vă așteptați ca acidul butiric (acid butanoic) să fie mai mult sau mai puțin solubil decât 1-butanolul în apă? Explicați.
Răspunsuri
-
acidul butiric din cauza legăturii de hidrogen (Nu există legătură de hidrogen intermoleculară în 2-pentanonă.)
-
mai solubil pentru că există o legătură de hidrogen mai extinsă
Repere cheie
- Acizii carboxilici au puncte de fierbere ridicate în comparație cu alte substanțe de masă molară comparabilă. Punctele de fierbere cresc odată cu masa molară.
- Acizii carboxilici care au între unu și patru atomi de carbon sunt complet miscibili cu apa. Solubilitatea scade cu masa molară.
Exerciții
-
Ce compus are punctul de fierbere mai ridicat-CH3CH2CH2OCH2CH3 sau CH3CH2CH2COOH? Explicați.
-
Care compus are punctul de fierbere mai mare-CH3CH2CH2CH2CH2CH2OH sau CH3CH2CH2COOH? Explicați.
-
Care compus este mai solubil în apă-CH3COOH sau CH3CH2CH2CH2CH3? Explicați.
-
Care compus este mai solubil în apă-CH3CH2COOH sau CH3CH2CH2CH2CH2CH2CH2COOH? Explicați.
Răspunsuri
-
CH3CH2CH2CH2COOH din cauza legăturii de hidrogen (Nu există legătură de hidrogen intermoleculară cu CH3CH2CH2OCH2CH3.)
-
CH3COOH pentru că se angajează în legături de hidrogen cu apa (Nu există legături de hidrogen intermoleculare cu CH3CH2CH2CH2CH3.)
.
