Denumire generică: clorhidrat de lidocaină
Forma de dozare: jeleu topic
Revizuit medical de Drugs.com. Ultima actualizare la 1 octombrie 2020.
- Vizualizare generală
- Efecte secundare
- Dosare
- Profesional
- Interacțiuni
- Mai multe
Dozaj numai pentru prescripție medicală
- DESCRIERE
- FARMACOLOGIE CLINICĂ
- INDICAȚII ȘI UTILIZARE
- CONTRAINDICAȚII
- Atenționări
- PRECAUȚII
- Utilizare în timpul sarcinii:
- Reacții adverse
- Supradozaj
- DOSAGE ȘI ADMINISTRARE
- DOZA MAXIMĂ
- CUM SE ACORDĂ
- Mai multe despre lidocaină topică
- Resurse pentru consumatori
- Resurse pentru profesioniști
- Ghiduri de tratament conexe
DESCRIERE
Lidocaina HCI 2% jeleu este o gelatină sterilă, apos care conține un agent anestezic local și se administrează local. (A se vedea INDICAȚII pentru utilizări specifice.)
Lidocaina HCI 2% Jelly conține lidocaină HCI care este desemnată chimic ca acetamidă, 2-(dietilamino)-N-(2,6-dimetilfenil)-,monoclorhidrat și are următoarea formulă structurală:
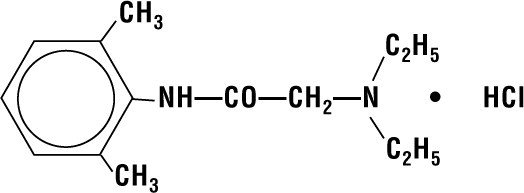
Formula sa moleculară este C14H22N2O – HCI și greutatea sa moleculară este 270.80.
Lidocaina HCI 2% jeleu conține, de asemenea, hipromeloză, iar amestecul rezultat maximizează contactul cu mucoasa și asigură lubrifierea pentru instrumentar. Porțiunea neutilizată trebuie aruncată după prima utilizare.
Compoziția Lidocaine HCI 2% Jelly 30 ml și 5 ml tuburi: Fiecare ml conține 20 mg de lidocaină HCI. Formularea conține, de asemenea, metilparaben, propilparaben, hipromeloză și hidroxid de sodiu și/sau acid clorhidric pentru a ajusta pH-ul între 6,0 și 7,0.
FARMACOLOGIE CLINICĂ
Mecanism de acțiune: Lidocaina stabilizează membrana neuronală prin inhibarea fluxurilor ionice necesare pentru inițierea și conducerea impulsurilor, efectuând astfel o acțiune anestezică locală.
Începutul acțiunii: Debutul acțiunii este de 3 până la 5 minute. Este ineficient atunci când este aplicat pe pielea intactă.
Hemodinamică: Nivelurile excesive de sânge pot determina modificări ale debitului cardiac, ale rezistenței periferice totale și ale presiunii arteriale medii. Aceste modificări pot fi atribuite unui efect deprimant direct al agentului anestezic local asupra diferitelor componente ale sistemului cardiovascular.
Farmacocinetică și metabolism: Lidocaina poate fi absorbită în urma administrării topice pe membranele mucoase, rata și gradul de absorbție depinzând de concentrația și doza totală administrată, de locul specific de aplicare și de durata expunerii. În general, rata de absorbție a agenților anestezici locali în urma aplicării topice se produce cel mai rapid după administrarea intratraheală. Lidocaina este, de asemenea, bine absorbită din tractul gastrointestinal, dar este posibil să apară puțin medicament intact în circulație din cauza biotransformării în ficat.
Lidocaina este metabolizată rapid de către ficat, iar metaboliții și medicamentul neschimbat sunt excretați de rinichi. Biotransformarea include N-dealchilarea oxidativă, hidroxilarea inelului, scindarea legăturii amidice și conjugarea. N-dealchilarea, o cale majoră de biotransformare, produce metaboliții monoetilglicinexilidida și glicinexilidida. Acțiunile farmacologice/toxicologice ale acestor metaboliți sunt similare, dar mai puțin puternice decât cele ale lidocainei. Aproximativ 90% din lidocaina administrată este excretată sub formă de diferiți metaboliți, iar mai puțin de 10% este excretată neschimbată. Metabolitul primar din urină este un conjugat al 4-hidroxi-2,6-dimetilanilinei.
Legătura plasmatică a lidocainei este dependentă de concentrația medicamentului, iar fracțiunea legată scade odată cu creșterea concentrației. La concentrații de 1 până la 4 mcg de bază liberă pe ml, 60 până la 80 la sută din lidocaină este legată de proteine. Legarea este, de asemenea, dependentă de concentrația plasmatică a glicoproteinei alfa-I-acidă.
Lidocaina traversează barierele hematoencefalică și placentară, probabil prin difuzie pasivă.
Studii privind metabolismul lidocainei după injecții intravenoase în bolus au arătat că timpul de înjumătățire prin eliminare al acestui agent este de obicei de 1,5 până la 2,0 ore. Din cauza vitezei rapide cu care este metabolizată lidocaina, orice afecțiune care afectează funcția hepatică poate modifica cinetica lidocainei. Timpul de înjumătățire poate fi prelungit de două ori sau mai mult la pacienții cu disfuncție hepatică. Disfuncția renală nu afectează cinetica lidocainei, dar poate crește acumularea de metaboliți.
Factori cum ar fi acidoza și utilizarea de stimulente și deprimante ale SNC afectează nivelurile SNC de lidocaină necesare pentru a produce efecte sistemice evidente. Manifestările adverse obiective devin din ce în ce mai evidente odată cu creșterea nivelurilor plasmatice venoase peste 6 mcg de bază liberă pe ml. La maimuța rhesus s-a demonstrat că nivelurile sanguine arteriale de 18 până la 21 mcg/mL reprezintă pragul pentru activitatea convulsivă.
INDICAȚII ȘI UTILIZARE
Lidocaina HCI 2% Jeleu este indicată pentru prevenirea și controlul durerii în procedurile care implică uretra masculină și feminină, pentru tratamentul topic al uretritei dureroase și ca lubrifiant anestezic pentru intubația endotraheală (orală și nazală).
CONTRAINDICAȚII
Lidocaina este contraindicată la pacienții cu antecedente cunoscute de hipersensibilitate la anestezicele locale de tip amidă sau la alte componente ale Lidocainei HCI 2% Jeleu.
Atenționări
Dosarea excesivă sau intervalele scurte între doze pot avea ca rezultat niveluri ridicate ale plasmei și efecte adverse grave. PACIENȚII TREBUIE SĂ FIE INSTRUIȚI SĂ RESPECTE CU STRICTEȚE DOZELE RECOMANDATE ȘI INSTRUCȚIUNILE DE ADMINISTRARE PREVĂZUTE ÎN ACEST PROSPECT. TRATAMENTUL REACȚIUNILOR ADVERSE GRAVE POATE NECESITA UTILIZAREA ECHIPAMENTELOR DE RESUSCITARE, OXIGEN ȘI ALTE MEDICAMENTE DE RESUSCITARE.
Lidocaina HCI 2% Jeleu trebuie utilizată cu extremă prudență în prezența sepsisului sau a mucoaselor grav traumatizate în zona de aplicare, deoarece în astfel de condiții există potențialul de absorbție sistemică rapidă.
Când se utilizează pentru lubrifierea tubului endotraheal trebuie să se aibă grijă să se evite introducerea produsului în lumenul tubului. Nu utilizați jeleul pentru lubrifierea styletului endotraheal. Dacă se lasă să pătrundă în lumenul interior, jeleul se poate usca pe suprafața interioară lăsând un reziduu care tinde să se aglomereze la flexie, îngustând lumenul. Au existat rapoarte rare în care acest reziduu a provocat ocluzia lumenului. (A se vedea, de asemenea, Reacții adverse și Doze și mod de administrare.)
PRECAUȚII
Generalități: Siguranța și eficacitatea lidocainei depind de o doză adecvată, de o tehnică corectă, de măsuri de precauție adecvate și de pregătirea pentru situații de urgență. (Vezi atenționări și reacții adverse.) Trebuie utilizată cea mai mică doză care determină o anestezie eficientă pentru a evita nivelurile plasmatice ridicate și efectele adverse grave. Dozele repetate de lidocaină pot determina creșteri semnificative ale nivelurilor sanguine cu fiecare doză repetată, din cauza acumulării lente a medicamentului sau a metaboliților săi. Toleranța la niveluri sanguine crescute variază în funcție de starea pacientului. Pacienților debilitați, vârstnici, pacienților cu afecțiuni acute și copiilor trebuie să li se administreze doze reduse, proporționale cu vârsta și starea lor fizică. De asemenea, lidocaina trebuie utilizată cu prudență la pacienții cu șoc sever sau blocaj cardiac.
Lidocaina HCI 2% Jelly trebuie utilizată cu prudență la pacienții cu sensibilitate cunoscută la medicamente. Pacienții alergici la derivați ai acidului para-aminobenzoic (procaină, tetracaină, benzocaină etc.) nu au prezentat sensibilitate încrucișată la lidocaină.
Multe medicamente utilizate în timpul efectuării anesteziei sunt considerate agenți declanșatori potențiali pentru hipertermia malignă familială. Deoarece nu se știe dacă anestezicele locale de tip amidă pot declanșa această reacție și deoarece nevoia de anestezie generală suplimentară nu poate fi prezisă în avans, se sugerează că ar trebui să fie disponibil un protocol standard de gestionare. Semnele timpurii inexplicabile de tahicardie, tahipnee, tensiune arterială labilă și acidoză metabolică pot precede creșterea temperaturii. Rezultatul cu succes depinde de diagnosticarea precoce, întreruperea promptă a agentului (agenților) declanșator(i) suspect(i) și instituirea unui tratament, inclusiv oxigenoterapie, măsuri de susținere indicate și dantrolen (consultați prospectul dantrolenului sodic intravenos înainte de utilizare).
Informații pentru pacienți: Atunci când anestezicele topice sunt utilizate în gură, pacientul trebuie să fie conștient de faptul că producerea anesteziei topice poate afecta deglutiția și astfel crește pericolul de aspirație. Din acest motiv, nu trebuie ingerate alimente timp de 60 de minute după utilizarea preparatelor anestezice locale în zona gurii sau a gâtului. Acest lucru este deosebit de important la copii, din cauza frecvenței cu care aceștia mănâncă.
Numelealația limbii sau a mucoasei bucale poate spori pericolul de traumă prin mușcare neintenționată. Alimentele sau guma de mestecat nu trebuie luate în timp ce zona gurii sau a gâtului este anesteziată.
Carcinogeneză – Nu s-au efectuat studii pe termen lung la animale pentru a evalua potențialul carcinogen al lidocainei.
Mutageneză – Potențialul mutagenetic al lidocainei a fost testat în testul de mutație inversă Ames Salmonella și în testul de aberații cromozomiale in vitro în limfocite umane și într-un test de micronucleare in vivo la șoareci. Nu a existat nicio indicație a vreunui efect mutagenetic în aceste studii.
Împiedicarea fertilității – Efectul lidocainei asupra fertilității a fost examinat pe modelul șobolanului. Administrarea a 30 mg/kg, s.c. (180 mg/m2) la perechea de împerechere nu a produs modificări ale fertilității sau ale performanței reproductive generale a șobolanilor. Nu există studii care să examineze efectul lidocainei asupra parametrilor spermei. Nu a existat nici o dovadă de alterare a fertilității.
Utilizare în timpul sarcinii:
Efecte teratogene: Categoria de sarcină B.
Studii de reproducere pentru lidocaină au fost efectuate atât la șobolani cât și la iepuri. Nu au existat dovezi de nocivitate pentru făt la doze subcutanate de până la 50 mg/kg de lidocaină (300 mg/m2 pe baza suprafeței corporale) în modelul de șobolan. La modelul iepurelui, nu au existat dovezi de efecte nocive asupra fătului la o doză de 5 mg/kg, s.c. (60 mg/m2 pe baza suprafeței corporale). Tratamentul iepurilor cu 25 mg/kg (300 mg/m2) a produs dovezi de toxicitate maternă și dovezi de întârziere a dezvoltării fetale, inclusiv o scădere nesemnificativă a greutății fetale (7%) și o creștere a anomaliilor scheletice minore (defect cranian și sternebral, osificare redusă a falangelor). Efectul lidocainei asupra dezvoltării postnatale a fost examinat la șobolani prin tratarea zilnică subcutanată a femelelor gestante de șobolan cu doze de 2, 10 și 50 mg/kg (12, 60 și 300 mg/m2) începând cu a 15-a zi de sarcină și până la 20 de zile postpartum. Nu s-au observat semne de efecte adverse nici la mame, nici la pui până la doza de 10 mg/kg (60 mg/m2) inclusiv; cu toate acestea, numărul de pui supraviețuitori a fost redus la doza de 50 mg/kg (300 mg/m2), atât la naștere, cât și pe durata perioadei de lactație, efectul fiind cel mai probabil secundar toxicității materne. În acest studiu nu au fost observate alte efecte asupra mărimii și greutății puilor, anomaliilor la pui și dezvoltărilor fizice ale puilor.
Un al doilea studiu a examinat efectele lidocainei asupra dezvoltării postnatale la șobolan, care a inclus evaluarea puilor de la înțărcare până la maturitatea sexuală. Șobolanii au fost tratați timp de 8 luni cu 10 sau 30 mg/kg, s.c. de lidocaină (60 mg/m2 și, respectiv, 180 mg/m2 pe baza suprafeței corporale). Această perioadă de timp a cuprins 3 perioade de împerechere. Nu a existat nicio dovadă de alterare a dezvoltării postnatale la niciun descendent; cu toate acestea, ambele doze de lidocaină au redus semnificativ numărul mediu de pui pe fătărie care au supraviețuit până la înțărcare la descendenții din primele 2 perioade de împerechere.
Nu există, totuși, studii adecvate și bine controlate la femeile gravide. Deoarece studiile de reproducere la animale nu sunt întotdeauna predictive pentru răspunsul la om, acest medicament trebuie utilizat în timpul sarcinii numai dacă este în mod clar necesar.
Lucrare și naștere: Lidocaina nu este contraindicată în travaliu și naștere. În cazul în care Lidocaina HCl 2% jeleu trebuie utilizată concomitent cu alte produse care conțin lidocaină, trebuie să se țină cont de doza totală contribuită de toate formulările.
Mamele care alăptează: Lidocaina este secretată în laptele uman. Semnificația clinică a acestei observații este necunoscută. Trebuie să se manifeste prudență atunci când lidocaina este administrată unei femei care alăptează.
Utilizare pediatrică: Deși, siguranța și eficacitatea Lidocainei 2% gelatină la pacienții pediatrici nu au fost stabilite, un studiu efectuat pe 19 nou-născuți prematur (vârsta gestațională <33 săptămâni) nu a constatat nici o corelație între concentrația plasmatică a lidocainei sau a monoetilglicinexilididei și greutatea corporală a sugarului atunci când au fost utilizate cantități moderate de lidocaină (adică 0,3 ml/kg de lidocaină gel 20 mg/mL) pentru lubrifierea atât a tuburilor intranazale cât și a celor endotraheale. Niciun nou-născut nu a avut niveluri plasmatice de lidocaină peste 750 mcg/L. Dozele la copii trebuie să fie reduse, proporțional cu vârsta, greutatea corporală și condiția fizică. (Vezi DOZE ȘI ADMINISTRARE.)
Reacții adverse
Experiențele adverse în urma administrării de lidocaină sunt de natură similară cu cele observate la alți agenți anestezici locali amidici. Aceste experiențe adverse sunt, în general, legate de doză și pot rezulta din niveluri plasmatice ridicate cauzate de o doză excesivă sau de o absorbție rapidă, sau pot rezulta dintr-o hipersensibilitate, idiosincrasie sau toleranță diminuată din partea pacientului. Experiențele adverse grave sunt, în general, de natură sistemică. Următoarele tipuri sunt cele mai frecvent raportate:
Au fost raportate rare cazuri de ocluzie a tubului endotraheal asociate cu prezența reziduurilor de gelatină uscată în lumenul interior al tubului. (Vezi și AVERTIZĂRI și POSOLOGIE ȘI ADMINISTRARE.)
Sistem nervos central: Manifestările SNC sunt excitatorii și/sau deprimante și pot fi caracterizate prin amețeală, nervozitate, aprehensiune, euforie, confuzie, amețeală, somnolență, tinitus, vedere încețoșată sau dublă, vărsături, senzații de căldură, frig sau amorțeală, spasme, tremurături, convulsii, inconștiență, depresie respiratorie și stop cardiac. Manifestările excitatorii pot fi foarte scurte sau pot să nu apară deloc, caz în care prima manifestare a toxicității poate fi somnolența care se contopește cu inconștiența și cu stop respirator.
Somnolența în urma administrării de lidocaină este de obicei un semn timpuriu al unui nivel sanguin ridicat al medicamentului și poate apărea ca o consecință a absorbției rapide.
Sistemul cardiovascular: Manifestările cardiovasculare sunt de obicei depresive și se caracterizează prin bradicardie, hipotensiune și colaps cardiovascular care poate duce la stop cardiac.
Alerice: Reacțiile alergice sunt caracterizate prin leziuni cutanate, urticarie, edem sau reacții anafilactoide. Reacțiile alergice pot apărea ca urmare a sensibilității fie la agentul anestezic local, fie la alte componente din formulare. Reacțiile alergice ca urmare a sensibilității la lidocaină sunt extrem de rare și, în cazul în care acestea apar, trebuie tratate prin mijloace convenționale. Detectarea sensibilității prin teste cutanate are o valoare îndoielnică.
Supradozaj
Urgențele acute datorate anestezicelor locale sunt în general legate de nivelurile plasmatice ridicate întâlnite în timpul utilizării terapeutice a anestezicelor locale. (Vezi reacții adverse, atenționări și precauții.)
Managementul urgențelor provocate de anestezicele locale: Prima considerație este prevenirea, cel mai bine realizată prin monitorizarea atentă și constantă a semnelor vitale cardiovasculare și respiratorii și a stării de conștiență a pacientului după fiecare administrare de anestezic local. La primul semn de schimbare, trebuie administrat oxigen.
Primul pas în managementul convulsiilor constă în atenția imediată acordată menținerii căilor respiratorii permeabile și ventilației asistate sau controlate cu oxigen și cu un sistem de administrare capabil să permită o presiune pozitivă imediată a căilor respiratorii prin mască. Imediat după instituirea acestor măsuri de ventilație, trebuie evaluată adecvarea circulației, ținând cont de faptul că medicamentele utilizate pentru tratarea convulsiilor deprimă uneori circulația atunci când sunt administrate intravenos. În cazul în care convulsiile persistă în ciuda unei asistențe respiratorii adecvate și dacă starea circulației o permite, se pot administra intravenos mici creșteri ale unui barbituric cu acțiune foarte scurtă (cum ar fi tiopentalul sau tiamilalul) sau ale unei benzodiazepine (cum ar fi diazepamul). Clinicianul trebuie să fie familiarizat, înainte de utilizarea anestezicelor locale, cu aceste medicamente anticonvulsivante. Tratamentul de susținere a depresiei circulatorii poate necesita administrarea de lichide intravenoase și, dacă este cazul, un vasopresor, conform indicațiilor situației clinice (de exemplu, efedrină).
Dacă nu sunt tratate imediat, atât convulsiile cât și depresia cardiovasculară pot duce la hipoxie, acidoză, bradicardie, aritmii și stop cardiac. Dacă ar trebui să se producă un stop cardiac, trebuie instituite măsuri standard de resuscitare cardiopulmonară.
Dializa are o valoare neglijabilă în tratamentul supradozajului acut cu lidocaină.
Dilatația orală LD50 de lidocaină HCI la femelele de șobolan nehrănite este de 459 (346 până la 773) mg/kg (sub formă de sare) și de 214 (159 până la 324) mg/kg (sub formă de sare) la femelele de șobolan aflate la post.
DOSAGE ȘI ADMINISTRARE
Când Lidocaina HCI 2% gelatină este utilizată concomitent cu alte produse care conțin lidocaină, trebuie să se țină cont de doza totală cu care contribuie toate formulările.
Dozajul variază și depinde de zona care urmează să fie anesteziată, vascularizația țesuturilor, toleranța individuală și tehnica de anestezie. Trebuie administrată cea mai mică doză necesară pentru a asigura o anestezie eficientă. Dozele trebuie reduse pentru copii și pentru pacienții vârstnici și debilitați. Deși incidența efectelor adverse cu Lidocaina HCI 2% jeleu este destul de scăzută, trebuie să se manifeste prudență, în special atunci când se utilizează cantități mari, deoarece incidența efectelor adverse este direct proporțională cu doza totală de agent anestezic local administrată.
Pentru anestezia de suprafață a uretrei masculine adulte: Atunci când se utilizează tuburi de 30 ml de Lidocaina 2% gelatină, sterilizați conul de plastic timp de 5 minute în apă clocotită, răciți-l și atașați-l la tub. Conul poate fi sterilizat cu gaz sau sterilizat la rece, după preferință. Se instilează lent aproximativ 15 ml (300 mg de lidocaină HCI) în uretră sau până când pacientul are o senzație de tensiune. Se aplică apoi o pensă peniană timp de câteva minute la nivelul coroanei. Se poate instila o doză suplimentară de cel mult 15 mL (300 mg) pentru o anestezie adecvată.
Înainte de sondaj sau cistoscopie, trebuie aplicată o pensă peniană timp de 5 până la 10 minute pentru a obține o anestezie adecvată. O doză totală de 30 ml (600 mg) este de obicei necesară pentru umplerea și dilatarea uretrei masculine.
Înainte de cateterizare, volume mai mici de 5 până la 10 ml (100 până la 200 mg) sunt de obicei adecvate pentru lubrifiere.
Pentru anestezia de suprafață a uretrei feminine adulte: Atunci când se utilizează tuburi de 30 ml de Lidocaina 2% gelatină, sterilizați conul de plastic timp de 5 minute în apă clocotită, răciți-l și atașați-l la tub. Conul poate fi sterilizat cu gaz sau sterilizat la rece, după preferință. Se instilează încet 3 până la 5 ml (60 până la 100 mg de lidocaină HCI) de gelatină în uretră. Dacă se dorește, o parte din jeleu poate fi depusă pe un tampon de bumbac și introdusă în uretră. Pentru a obține o anestezie adecvată, trebuie să se aștepte câteva minute înainte de efectuarea procedurilor urologice.
Lubrifierea pentru intubația endotraheală: Aplicați o cantitate moderată de jeleu pe suprafața externă a tubului endotraheal cu puțin timp înainte de utilizare. Trebuie să se aibă grijă să se evite introducerea produsului în lumenul tubului. Nu utilizați jeleul pentru a lubrifia stylete endotraheale. A se vedea punctul ATENȚIONARE și reacții adverse privind rapoartele rare de ocluzie a lumenului intern. Se recomandă, de asemenea, evitarea utilizării tuburilor endotraheale cu gelatină uscată pe suprafața externă, din cauza lipsei efectului lubrifiant.
DOZA MAXIMĂ
Nu trebuie administrate mai mult de 600 mg de lidocaină HCI în orice perioadă de 12 ore.
Copii: Este dificil de recomandat o doză maximă a oricărui medicament pentru copii, deoarece aceasta variază în funcție de vârstă și greutate. Pentru copiii mai mici de zece ani care au o masă corporală slabă normală și o dezvoltare normală a corpului slab, doza maximă poate fi determinată prin aplicarea uneia dintre formulele standard pentru medicamente pediatrice (de exemplu, regula lui Clark). De exemplu, la un copil de cinci ani care cântărește 15 kg, doza de clorhidrat de lidocaină nu trebuie să depășească 75 până la 100 mg atunci când este calculată conform regulii lui Clark. În orice caz, cantitatea maximă de lidocaină HCI administrată nu trebuie să depășească 4,5 mg/kg (2 mg/lb) de greutate corporală.
CUM SE ACORDĂ
Lidocaină HCI 2% jeleu se livrează în formele farmaceutice enumerate.
NDC 17478-840-30 30 ml tub de aluminiu
NDC 17478-840-05 5 ml tub de aluminiu
În cutia de 30 ml sunt incluse un con aplicator detașabil și o cheie pentru exprimarea conținutului.
Stocare: A se păstra la o temperatură cuprinsă între 20° și 25°C (68° și 77°F) .
PREMIERProRx®
Fabricat de:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® este o marcă înregistrată a Premier Inc., utilizată sub licență.
PLD00N Rev. 10/15
Principal Display Panel Text pentru eticheta recipientului:
NDC 17478-840-05 Premier Logo
Lidocaine Hydrochloride Jelly USP, 2%
Doar pentru prescripție medicală
Sterile 5 ml

Principal Display Panel Text pentru eticheta cartonului:
NDC 17478-840-05 Steril 5 mL
Clorhidrat de lidocaină jeleu USP, 2%
Doar pentru prescripție medicală
Logo-ul Premier

| LIDOCAINE lidocaină clorhidrat jeleu |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Etichetă – Akorn, Inc. (117696770)
Titularul înregistrării – Akorn Operating Company LLC (117693100)
| Stabilire | |||
| Nume | Adresă | ID/FEI | Operațiuni |
| Akorn, Inc | 117696840 | MANUFACTURE(17478-840), ANALYSIS(17478-840), STERILIZE(17478-840), PACK(17478-840), LABEL(17478-840) | |
Mai multe despre lidocaină topică
- Efecte secundare
- În timpul sarcinii sau alăptării
- Informații privind dozajul
- Interacțiuni medicamentoase
- Comparați alternativele
- Prețuri & Cupoane
- En Español
- 208 Recenzii
- Clasa de medicament: anestezice topice
- Alerte FDA (5)
.
Resurse pentru consumatori
- Informații pentru pacienți
- Lidocaina aplicație topică (lectură avansată)
Resurse pentru profesioniști
.
- Informații de prescriere
- Lidocaină (topică) (Sfaturi profesionale pentru pacienți)
- Lidocaină cremă (FDA)
- Lidocaină gel (FDA)
- Lidocaină soluție laringotraheală (FDA)
- … +9 more
Alte mărci Lidocaine Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 mai mult
Ghiduri de tratament conexe
- Mâncărimi anale
- Chirurgie gastrointestinală
- Anestezie
- Burtături, externe
- … +9 more
Denunțare medicală
