Diagrama de fază a apei
Figura 11.23 „Două versiuni ale diagramei de fază a apei” prezintă diagrama de fază a apei și ilustrează faptul că punctul triplu al apei are loc la 0,01°C și 0,00604 atm (4,59 mmHg). Mult mai reproductibil decât punctul de topire a gheții, care depinde de cantitatea de aer dizolvat și de presiunea atmosferică, punctul triplu (273,16 K) este utilizat pentru a defini scara de temperatură absolută (Kelvin). Punctul triplu reprezintă, de asemenea, cea mai mică presiune la care o fază lichidă poate exista în echilibru cu cea solidă sau cu vaporii. Prin urmare, la presiuni mai mici de 0,00604 atm, gheața nu se topește în lichid odată cu creșterea temperaturii; solidul se sublimează direct în vapori de apă. Sublimarea apei la temperaturi și presiuni scăzute poate fi utilizată pentru „liofilizarea” alimentelor și băuturilor. Alimentele sau băuturile sunt mai întâi răcite la temperaturi sub zero grade și plasate într-un recipient în care presiunea este menținută sub 0,00604 atm. Apoi, pe măsură ce temperatura crește, apa se sublimează, lăsând alimentul deshidratat (cum ar fi cel folosit de rucsacari sau astronauți) sau băutura sub formă de pulbere (ca în cazul cafelei liofilizate).
Diagrama de fază pentru apă ilustrată în partea (b) din figura 11.23 „Două versiuni ale diagramei de fază a apei” prezintă granița dintre gheață și apă la o scară extinsă. Curba de topire a gheții este înclinată în sus și ușor spre stânga, mai degrabă decât în sus și spre dreapta ca în figura 11.22 „O diagramă de fază tipică pentru o substanță care prezintă trei faze – solid, lichid și gaz – și o regiune supercritică”; adică punctul de topire al gheții scade odată cu creșterea presiunii; la 100 MPa (987 atm), gheața se topește la -9°C. Apa se comportă astfel deoarece este una dintre puținele substanțe cunoscute pentru care solidul cristalin este mai puțin dens decât lichidul (altele includ antimoniul și bismutul). Creșterea presiunii gheții care se află în echilibru cu apa la 0°C și 1 atm tinde să împingă unele dintre molecule mai aproape unele de altele, scăzând astfel volumul probei. Scăderea volumului (și creșterea corespunzătoare a densității) este mai mică pentru un solid sau un lichid decât pentru un gaz, dar este suficientă pentru a topi o parte din gheață.
Figura 11.23 Două versiuni ale diagramei de fază a apei
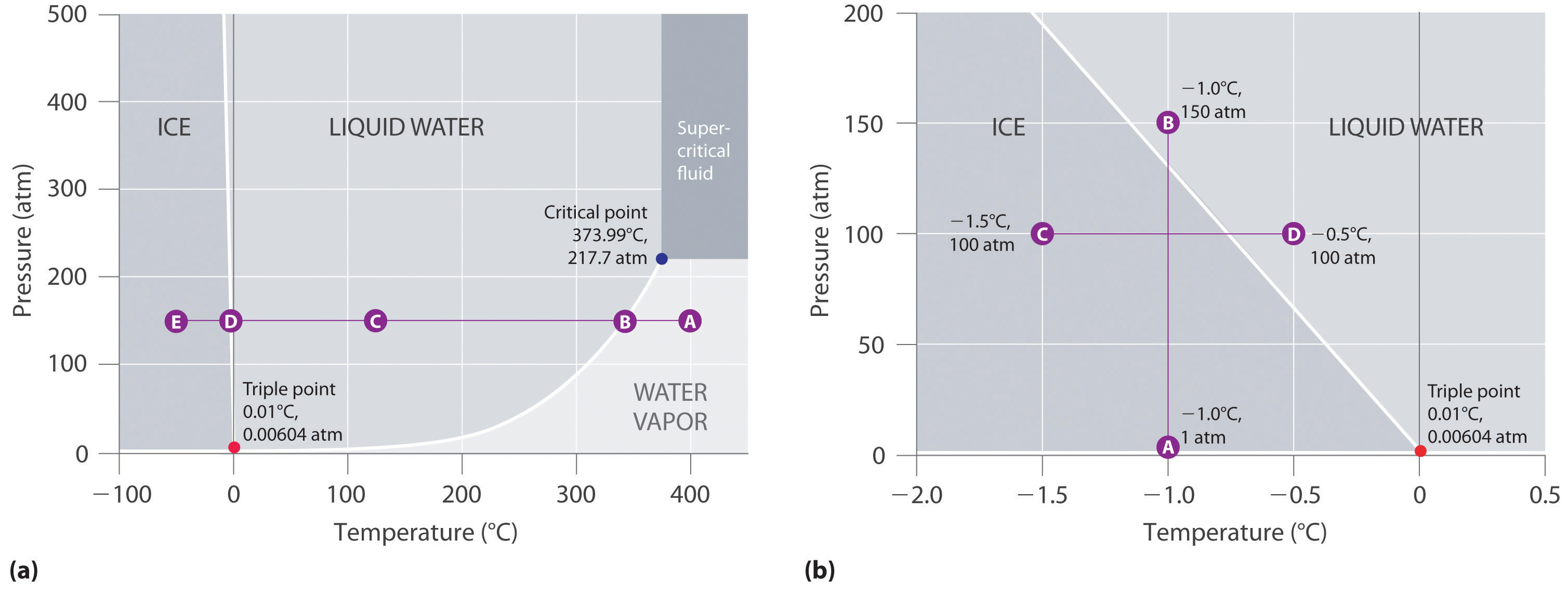
(a) În acest grafic cu axe liniare de temperatură și presiune, granița dintre gheață și apă lichidă este aproape verticală. (b) Acest grafic cu o scară extinsă ilustrează scăderea punctului de topire odată cu creșterea presiunii. (Literele se referă la punctele discutate în Exemplul 10.)
În partea (b) din Figura 11.23 „Două versiuni ale diagramei de fază a apei”, punctul A este situat la P = 1 atm și T = -1,0°C, în regiunea solidă (gheață) a diagramei de fază. Pe măsură ce presiunea crește până la 150 atm, în timp ce temperatura rămâne aceeași, linia din punctul A traversează granița gheață/apă până la punctul B, care se află în regiunea apei lichide. În consecință, aplicarea unei presiuni de 150 atm va topi gheața la -1,0°C. Am arătat deja că dependența de presiune a punctului de topire a apei este de o importanță vitală. Dacă granița solid/lichid din diagrama de fază a apei ar fi mai degrabă înclinată în sus și spre dreapta decât spre stânga, gheața ar fi mai densă decât apa, cuburile de gheață s-ar scufunda, conductele de apă nu s-ar sparge atunci când îngheață, iar antigelul ar fi inutil în motoarele automobilelor.
Până de curând, multe manuale descriau patinajul pe gheață ca fiind posibil deoarece presiunea generată de lama patinatorului este suficient de mare pentru a topi gheața de sub lamă, creând astfel un strat lubrifiant de apă lichidă care permite lamei să alunece pe gheață. Deși această explicație este satisfăcătoare din punct de vedere intuitiv, ea este incorectă, după cum putem demonstra printr-un calcul simplu. Reamintim din capitolul 10 „Gaze” că presiunea (P) este forța (F) aplicată pe unitatea de suprafață (A):
Ecuația 11.4
P = F A
Pentru a calcula presiunea pe care o exercită un patinator pe gheață, trebuie să calculăm doar forța exercitată și suprafața lamei patinei. Dacă presupunem un patinator de 75,0 kg (165 lb), atunci forța exercitată de patinator pe gheață din cauza gravitației este
Ecuația 11.5
F = mg
unde m este masa și g este accelerația datorată gravitației terestre (9,81 m/s2). Astfel, forța este
Ecuția 11.6
F = (75,0 kg)(9,81 m/s2) = 736 (kg-m)/s2 = 736 N
Dacă presupunem că lamelele patinelor sunt 2.0 mm lățime și 25 cm lungime, atunci aria părții inferioare a fiecărei lamele este
Equația 11.7
A = (2,0 × 10-3 m)(25 × 10-2 m) = 5.0 × 10-4 m2
Dacă patinatorul alunecă pe un picior, presiunea exercitată pe gheață este
Ecuația 11.8
P = 736 N 5,0 × 10 – 4 m 2 = 1,5 × 10 6 N/m 2 = 1.5 × 10 6 Pa = 15 atm
Presiunea este mult mai mică decât presiunea necesară pentru a scădea punctul de topire a gheții chiar și cu 1°C, iar experiența indică faptul că este posibil să patinezi chiar și atunci când temperatura este mult sub zero grade Celsius. Astfel, topirea gheții indusă de presiune nu poate explica frecarea scăzută care permite patinatorilor (și pucurilor de hochei) să alunece. Cercetările recente indică faptul că suprafața gheții, acolo unde rețeaua ordonată de molecule de apă întâlnește aerul, este formată din unul sau mai multe straturi de apă aproape lichidă. Aceste straturi, împreună cu topirea indusă de frecare atunci când un patinator se împinge înainte, par să explice atât ușurința cu care un patinator alunecă, cât și faptul că patinajul devine mai dificil la temperaturi mai mici de aproximativ -7°C, când numărul straturilor de apă lubrifiantă de la suprafață scade.
.
