Rezultatele învățării
- Definiți regula octetului și rolul său în legăturile chimice
Nu toate elementele au suficienți electroni pentru a umple învelișurile exterioare, dar un atom este cel mai stabil atunci când toate pozițiile electronice din învelișul cel mai exterior sunt ocupate. Din cauza acestor locuri libere în straturile cele mai exterioare, asistăm la formarea de legături chimice sau interacțiuni între două sau mai multe elemente identice sau diferite, care duc la formarea de molecule. Pentru a obține o mai mare stabilitate, atomii vor avea tendința de a-și umple complet învelișurile exterioare și se vor lega cu alte elemente pentru a atinge acest obiectiv prin schimbul de electroni, prin acceptarea de electroni de la un alt atom sau prin donarea de electroni unui alt atom. Deoarece învelișurile cele mai exterioare ale elementelor cu număr atomic mic (până la calciu, cu numărul atomic 20) pot conține opt electroni, acest lucru se numește regula octetului. Un element poate să doneze, să accepte sau să împartă electroni cu alte elemente pentru a-și umple învelișul exterior și a satisface regula octetului.
Un prim model al atomului a fost dezvoltat în 1913 de către omul de știință danez Niels Bohr (1885-1962). Modelul lui Bohr arată atomul ca un nucleu central care conține protoni și neutroni, cu electronii în învelișuri electronice circulare la distanțe specifice față de nucleu, asemănător planetelor care orbitează în jurul soarelui. Fiecare înveliș de electroni are un nivel energetic diferit, învelișurile cele mai apropiate de nucleu având o energie mai mică decât cele mai îndepărtate de nucleu. Prin convenție, fiecărui înveliș i se atribuie un număr și simbolul n – de exemplu, învelișul de electroni cel mai apropiat de nucleu se numește 1n. Pentru a se deplasa între învelișuri, un electron trebuie să absoarbă sau să elibereze o cantitate de energie care să corespundă exact diferenței de energie dintre învelișuri. De exemplu, dacă un electron absoarbe energie de la un foton, acesta poate deveni excitat și se poate muta într-un înveliș cu energie mai mare; invers, atunci când un electron excitat coboară înapoi într-un înveliș cu energie mai mică, el va elibera energie, adesea sub formă de căldură.
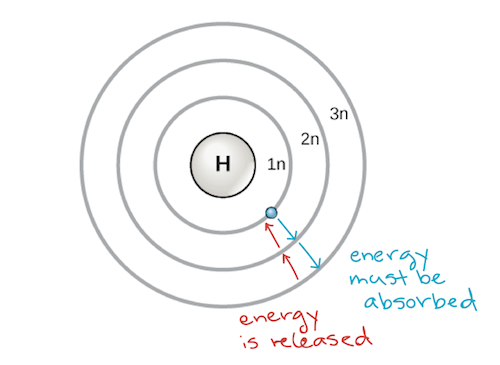
Modelul Bohr al unui atom, care arată nivelurile de energie ca cercuri concentrice în jurul nucleului. Trebuie să se adauge energie pentru a deplasa un electron spre un nivel energetic superior, iar energia este eliberată atunci când un electron coboară de la un nivel energetic superior la unul mai apropiat. Credit imagine: modificat din OpenStax Biology
Atomii, ca și alte lucruri guvernate de legile fizicii, tind să adopte configurația cu cea mai mică energie și cea mai stabilă pe care o pot lua. Astfel, învelișurile de electroni ale unui atom sunt populate din interior spre exterior, electronii umplând învelișurile de joasă energie mai apropiate de nucleu înainte de a se muta în învelișurile de energie mai mare, mai îndepărtate. Învelișul cel mai apropiat de nucleu, 1n, poate conține doi electroni, în timp ce următorul înveliș, 2n, poate conține opt, iar al treilea înveliș, 3n, poate conține până la optsprezece.
Numărul de electroni din învelișul cel mai exterior al unui anumit atom determină reactivitatea acestuia, sau tendința de a forma legături chimice cu alți atomi. Acest înveliș cel mai exterior este cunoscut sub numele de înveliș de valență, iar electronii care se găsesc în el se numesc electroni de valență. În general, atomii sunt cei mai stabili, mai puțin reactivi, atunci când învelișul lor electronic cel mai exterior este plin. Majoritatea elementelor importante în biologie au nevoie de opt electroni în învelișul lor cel mai exterior pentru a fi stabile, iar această regulă empirică este cunoscută sub numele de regula octetului. Unii atomi pot fi stabili cu un octet, chiar dacă învelișul lor de valență este învelișul 3n, care poate conține până la 18 electroni. Vom explora motivul pentru acest lucru atunci când vom discuta mai jos despre orbitalii electronici.
Exemplele unor atomi neutri și configurațiile electronice ale acestora sunt prezentate mai jos. În acest tabel, puteți vedea că heliul are un înveliș de valență complet, cu doi electroni în primul și singurul său înveliș, 1n. În mod similar, neonul are un înveliș exterior 2n complet, conținând opt electroni. Aceste configurații electronice fac ca heliul și neonul să fie foarte stabile. Deși argonul nu are, din punct de vedere tehnic, un înveliș exterior complet, deoarece învelișul 3n poate conține până la optsprezece electroni, este stabil ca și neonul și heliul, deoarece are opt electroni în învelișul 3n și, astfel, îndeplinește regula octetului. În schimb, clorul are doar șapte electroni în învelișul cel mai exterior, în timp ce sodiul are doar unul. Aceste modele nu umplu învelișul cel mai exterior și nici nu satisfac regula octetului, ceea ce face ca clorul și sodiul să fie reactivi, dornici să câștige sau să piardă electroni pentru a ajunge la o configurație mai stabilă.
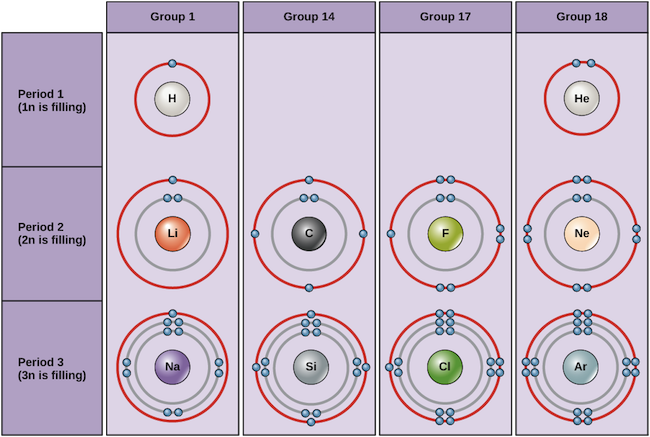
Diagramele Bohr ale diferitelor elemente Credit imagine: OpenStax Biology
Configurările electronice și tabelul periodic
Elementele sunt plasate în ordine în tabelul periodic în funcție de numărul lor atomic, adică de numărul de protoni pe care îi au. Într-un atom neutru, numărul de electroni va fi egal cu numărul de protoni, astfel încât putem determina cu ușurință numărul de electroni din numărul atomic. În plus, poziția unui element în tabelul periodic – coloana, sau grupa, și rândul, sau perioada – oferă informații utile despre modul în care sunt aranjați acei electroni.
Dacă luăm în considerare doar primele trei rânduri ale tabelului, care includ principalele elemente importante pentru viață, fiecare rând corespunde umplerii unui înveliș electronic diferit: heliul și hidrogenul își plasează electronii în învelișul 1n, în timp ce elementele din al doilea rând, cum ar fi Li, încep să umple învelișul 2n, iar elementele din al treilea rând, cum ar fi Na, continuă cu învelișul 3n. În mod similar, numărul de coloană al unui element oferă informații despre numărul de electroni de valență și reactivitatea acestuia. În general, numărul de electroni de valență este același în cadrul unei coloane și crește de la stânga la dreapta în cadrul unui rând. Elementele din grupa 1 au doar un singur electron de valență, iar elementele din grupa 18 au opt, cu excepția heliului, care are doar doi electroni în total. Astfel, numărul grupei este un bun predictor al cât de reactiv va fi fiecare element:
- Heliu (He), neon (Ne) și argon (Ar), ca elemente din grupa 18, au învelișuri exterioare de electroni care sunt pline sau care satisfac regula octetului. Acest lucru le face extrem de stabile ca atomi unici. Datorită nereactivității lor, acestea sunt numite gaze inerte sau gaze nobile.
- Hidrogenul (H), litiul (Li) și sodiul (Na), ca elemente din grupa 1, au doar un singur electron în învelișurile lor cele mai exterioare. Ele sunt instabile ca atomi singuri, dar pot deveni stabile prin pierderea sau partajarea singurului lor electron de valență. Dacă aceste elemente pierd în totalitate un electron – așa cum fac de obicei Li și Na – ele devin ioni încărcați pozitiv: Li+, Na+.
- Fluorul (F) și clorul (Cl), ca elemente din grupa 17, au șapte electroni în învelișurile lor cele mai exterioare. Ei tind să obțină un octet stabil prin preluarea unui electron de la alți atomi, devenind ioni cu sarcină negativă: F- și Cl-.
- Carbonul (C), ca element din grupa 14, are patru electroni în învelișul său exterior. De obicei, carbonul împarte electronii pentru a obține un înveliș de valență complet, formând legături cu mai mulți alți atomi.
Astfel, coloanele tabelului periodic reflectă numărul de electroni care se găsesc în învelișul de valență al fiecărui element, care la rândul său determină modul în care elementul va reacționa.
Încercați
Contribuie!
Îmbunătățiți această paginăÎnvățați mai mult
