 |
|
Las reacciones ácido-base son omnipresentes. En las soluciones acuosas los ácidos aumentan la concentración de iones hidrógeno (H+). Por otro lado, las bases aumentan la concentración de iones hidróxido (OH-). Cuando un ácido y una base reaccionan en una solución acuosa, los iones H+ y OH- se combinan para formar agua. Estos iones se «neutralizan» mutuamente:
La mayoría de los ácidos tienen la fórmula general HA, donde A- es un anión y la mayoría de las bases tienen la forma BOH, donde B+ es un catión apropiado. Los ácidos y las bases pueden agruparse en dos tipos generales: ácidos y bases fuertes y débiles. La diferencia entre ambos es sencilla: un ácido fuerte en una solución acuosa se descompone al 100% en un protón (H+) y un anión (A-)
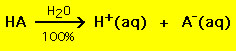
En cambio, la mayoría de los ácidos débiles se descomponen bastante menos del 100% en una solución acuosa:
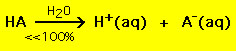 .
.En otras palabras, la mayoría de las moléculas de ácidos débiles permanecen intactas en el agua. Ecuaciones químicas similares son válidas para las bases fuertes y débiles.
Sólo hay unos pocos ácidos y bases débiles, que son:
| |
|
|
HCl (ácido clorhídrico) HNO3 (ácido nítrico) HClO4 (ácido perclórico) H2SO4 (ácido sulfúrico) |
NaOH (hidróxido de sodio) KOH (hidróxido de potasio) Ca(OH)2 (hidróxido de calcio) |
Todos los demás ácidos y bases son débiles. Un ácido débil resulta de cualquier anión. A continuación se dan ejemplos
| |
|
|
F- (fluoruro) Br- (bromuro) I- (yoduro) HCO3- (bicarbonato) C2H3O2- (acetato) MnO4- (permanganato) PO4-3 (fosfato) CrO4-2 (cromato) CN- (cianuro) NO2- (nitrito) SO3-2 (sulfito) |
HF (ácido fluorhídrico) HBr (ácido bromhídrico) HI (ácido yodado) H2CO3 (ácido carbónico) HC2H3O2 (ácido acético) HMnO4 (ácido permangánico) H3PO4 (ácido fosfórico H2CrO4 (ácido crómico) HCN (ácido cianhídrico) HNO2 (ácido nitroso) H2SO3 (ácido sulfuroso) |
En una típica reacción ácido/base el ácido y la base reaccionan para formar una sal y agua e.g., ácido cianhídrico e hidróxido de sodio:
