Nombre genérico: clorhidrato de lidocaína
Forma de dosificación: jalea tópica
Revisado médicamente por Drugs.com. Actualizado por última vez el 1 de octubre de 2020.
- Descripción
- Efectos secundarios
- Dosificación
- Profesional
- Interacciones
- Más
Sólo Rx
- DESCRIPCIÓN
- FARMACOLOGÍA CLÍNICA
- INDICACIONES Y USO
- CONTRAINDICACIONES
- ADVERTENCIAS
- PRECAUCIONES
- Uso en el embarazo:
- Reacciones adversas
- Sobredosis
- DOSIFICACIÓN Y ADMINISTRACIÓN
- Dosis máxima
- Cómo se suministra
- Más información sobre lidocaína tópica
- Recursos para el consumidor
- Recursos para el profesional
- Guías de tratamiento relacionadas
DESCRIPCIÓN
Lidocaína HCI 2% Jalea es un producto estéril, acuosa que contiene un agente anestésico local y se administra por vía tópica. (Ver INDICACIONES para usos específicos.)
Lidocaína HCI 2% Jelly contiene lidocaína HCI que se designa químicamente como acetamida, 2-(dietilamino)-N-(2,6-dimetilfenil)-,monohidrocloruro y tiene la siguiente fórmula estructural:
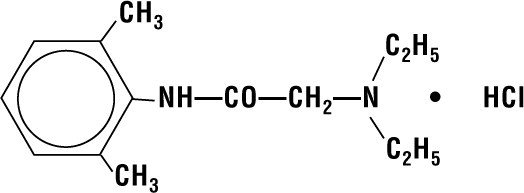
Su fórmula molecular es C14H22N2O – HCI y su peso molecular es 270.80.
La gelatina de lidocaína HCI al 2% también contiene hipromelosa, y la mezcla resultante maximiza el contacto con la mucosa y proporciona lubricación para la instrumentación. La porción no utilizada debe desecharse después del uso inicial.
Composición de Lidocaína HCI 2% Jelly Tubos de 30 mL y 5 mL: Cada mL contiene 20 mg de lidocaína HCI. La formulación también contiene metilparabeno, propilparabeno, hipromelosa e hidróxido de sodio y/o ácido clorhídrico para ajustar el pH entre 6,0 y 7,0.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción: La lidocaína estabiliza la membrana neuronal mediante la inhibición de los flujos iónicos necesarios para la iniciación y conducción de los impulsos, efectuando así la acción anestésica local.
Inicio de acción: El inicio de la acción es de 3 a 5 minutos. Es ineficaz cuando se aplica a la piel intacta.
Hemodinámica: Los niveles excesivos de sangre pueden causar cambios en el gasto cardíaco, la resistencia periférica total y la presión arterial media. Estos cambios pueden ser atribuibles a un efecto depresor directo del agente anestésico local sobre varios componentes del sistema cardiovascular.
Farmacocinética y metabolismo: La lidocaína puede ser absorbida tras la administración tópica en las membranas mucosas, su tasa y extensión de absorción depende de la concentración y la dosis total administrada, el lugar específico de aplicación y la duración de la exposición. En general, la tasa de absorción de los agentes anestésicos locales tras la aplicación tópica se produce más rápidamente después de la administración intratraqueal. La lidocaína también se absorbe bien en el tracto gastrointestinal, pero puede aparecer poco fármaco intacto en la circulación debido a la biotransformación en el hígado.
La lidocaína se metaboliza rápidamente en el hígado y los metabolitos y el fármaco inalterado se excretan por los riñones. La biotransformación incluye la N-dealquilación oxidativa, la hidroxilación del anillo, la escisión del enlace amídico y la conjugación. La N-dealquilación, una de las principales vías de biotransformación, produce los metabolitos monoetilglicinexilida y glicinexilida. Las acciones farmacológicas/toxicológicas de estos metabolitos son similares, pero menos potentes, a las de la lidocaína. Aproximadamente el 90% de la lidocaína administrada se excreta en forma de varios metabolitos, y menos del 10% se excreta sin cambios. El principal metabolito en orina es un conjugado de 4-hidroxi-2, 6-dimetilanilina.
La unión plasmática de lidocaína depende de la concentración del fármaco, y la fracción unida disminuye con el aumento de la concentración. A concentraciones de 1 a 4 mcg de base libre por mL, entre el 60 y el 80 por ciento de la lidocaína se une a las proteínas. La unión también depende de la concentración plasmática de la glicoproteína de ácido alfa-I.
La lidocaína atraviesa las barreras hematoencefálica y placentaria, presumiblemente por difusión pasiva.
Los estudios sobre el metabolismo de la lidocaína tras las inyecciones intravenosas en bolo han demostrado que la semivida de eliminación de este agente suele ser de 1,5 a 2,0 horas. Debido a la rapidez con la que se metaboliza la lidocaína, cualquier condición que afecte la función hepática puede alterar la cinética de la lidocaína. La vida media puede prolongarse dos veces o más en pacientes con disfunción hepática. La disfunción renal no afecta a la cinética de la lidocaína pero puede aumentar la acumulación de metabolitos.
Factores como la acidosis y el uso de estimulantes y depresores del SNC afectan a los niveles de lidocaína en el SNC necesarios para producir efectos sistémicos manifiestos. Las manifestaciones adversas objetivas se hacen cada vez más evidentes al aumentar los niveles plasmáticos venosos por encima de 6 mcg de base libre por mL. En el mono rhesus se ha demostrado que los niveles sanguíneos arteriales de 18 a 21 mcg/mL son el umbral para la actividad convulsiva.
INDICACIONES Y USO
Lidocaína HCI 2% Jelly está indicada para la prevención y el control del dolor en procedimientos que afectan a la uretra masculina y femenina, para el tratamiento tópico de la uretritis dolorosa y como lubricante anestésico para la intubación endotraqueal (oral y nasal).
CONTRAINDICACIONES
La lidocaína está contraindicada en pacientes con un historial conocido de hipersensibilidad a los anestésicos locales del tipo amida o a otros componentes de la jalea de lidocaína HCI al 2%.
ADVERTENCIAS
Una dosis excesiva, o intervalos cortos entre las dosis, puede dar lugar a niveles elevados de plasma y efectos adversos graves. SE DEBE INSTRUIR A LOS PACIENTES PARA QUE RESPETEN ESTRICTAMENTE LA DOSIS RECOMENDADA Y LAS PAUTAS DE ADMINISTRACIÓN ESTABLECIDAS EN ESTE PROSPECTO. EL MANEJO DE LAS REACCIONES ADVERSAS GRAVES PUEDE REQUERIR EL USO DE EQUIPOS DE RESUCITACIÓN, OXÍGENO Y OTROS MEDICAMENTOS DE RESUCITACIÓN.
Lidocaína HCI 2% Jelly debe utilizarse con extrema precaución en presencia de sepsis o de una mucosa gravemente traumatizada en la zona de aplicación, ya que en tales condiciones existe la posibilidad de una rápida absorción sistémica.
Cuando se utilice para la lubricación del tubo endotraqueal debe tenerse cuidado para evitar introducir el producto en el lumen del tubo. No utilice la jalea para lubricar los estiletes endotraqueales. Si se introduce en el lumen interno, la jalea puede secarse en la superficie interna dejando un residuo que tiende a aglutinarse con la flexión, estrechando el lumen. En raras ocasiones se ha informado de que este residuo ha provocado la oclusión de la luz. (Ver también REACCIONES ADVERSAS y POSOLOGÍA Y ADMINISTRACIÓN.)
PRECAUCIONES
Generalidades: La seguridad y la eficacia de la lidocaína dependen de la dosis adecuada, de la técnica correcta, de las precauciones adecuadas y de la preparación para emergencias. (Ver ADVERTENCIAS y REACCIONES ADVERSAS.) Debe utilizarse la dosis más baja que produzca una anestesia eficaz para evitar niveles plasmáticos elevados y efectos adversos graves. Las dosis repetidas de lidocaína pueden causar aumentos significativos en los niveles sanguíneos con cada dosis repetida debido a la lenta acumulación del fármaco o sus metabolitos. La tolerancia a los niveles sanguíneos elevados varía según el estado del paciente. Los pacientes ancianos y debilitados, los pacientes con enfermedades agudas y los niños deben recibir dosis reducidas acordes con su edad y estado físico. La lidocaína también debe utilizarse con precaución en pacientes con shock severo o bloqueo cardíaco.
Lidocaína HCI 2% Jelly debe utilizarse con precaución en pacientes con sensibilidad conocida al medicamento. Los pacientes alérgicos a los derivados del ácido paraaminobenzoico (procaína, tetracaína, benzocaína, etc.) no han mostrado sensibilidad cruzada a la lidocaína.
Muchos fármacos utilizados durante la realización de la anestesia se consideran potenciales agentes desencadenantes de hipertermia maligna familiar. Puesto que no se sabe si los anestésicos locales de tipo amida pueden desencadenar esta reacción y puesto que la necesidad de anestesia general suplementaria no puede predecirse de antemano, se sugiere que se disponga de un protocolo estándar para el manejo. Los primeros signos inexplicables de taquicardia, taquipnea, presión arterial lábil y acidosis metabólica pueden preceder a la elevación de la temperatura. El éxito de la evolución depende del diagnóstico precoz, la rápida interrupción del agente o agentes desencadenantes sospechosos y la instauración de un tratamiento que incluya oxigenoterapia, las medidas de apoyo indicadas y dantroleno (consultar el prospecto de dantroleno sódico intravenoso antes de utilizarlo).
Información para los pacientes: Cuando se utilicen anestésicos tópicos en la boca, el paciente debe ser consciente de que la producción de anestesia tópica puede dificultar la deglución y aumentar así el peligro de aspiración. Por esta razón, no deben ingerirse alimentos durante los 60 minutos siguientes al uso de preparados anestésicos locales en la zona de la boca o la garganta. Esto es especialmente importante en los niños debido a la frecuencia con la que comen.
El entumecimiento de la lengua o de la mucosa bucal puede aumentar el peligro de un traumatismo por mordedura involuntaria. No se deben tomar alimentos o chicles mientras la zona de la boca o la garganta esté anestesiada.
Carcinogénesis – No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de la lidocaína.
Mutagénesis – El potencial mutagénico de la lidocaína se ha probado en el ensayo de mutación inversa de Ames Salmonella, y en el ensayo de aberraciones cromosómicas in vitro en linfocitos humanos y en un ensayo de micronúcleos in vivo en ratones. No hubo indicación de ningún efecto mutagénico en estos estudios.
Deterioro de la fertilidad – El efecto de la lidocaína sobre la fertilidad se examinó en el modelo de rata. La administración de 30 mg/kg, s.c. (180 mg/m2) a la pareja de apareamiento no produjo alteraciones en la fertilidad o en el rendimiento reproductivo general de las ratas. No hay estudios que examinen el efecto de la lidocaína en los parámetros espermáticos. No hubo evidencia de alteración de la fertilidad.
Uso en el embarazo:
Efectos teratogénicos: Embarazo Categoría B.
Se han realizado estudios de reproducción de lidocaína tanto en ratas como en conejos. No hubo evidencia de daño al feto con dosis subcutáneas de hasta 50 mg/kg de lidocaína (300 mg/m2 en base a la superficie corporal) en el modelo de rata. En el modelo de conejo, no hubo evidencia de daño al feto con una dosis de 5 mg/kg, s.c. (60 mg/m2 en base a la superficie corporal). El tratamiento de conejos con 25 mg/kg (300 mg/m2) produjo evidencias de toxicidad materna y evidencias de retraso en el desarrollo fetal, incluyendo una disminución no significativa del peso fetal (7%) y un aumento de las anomalías esqueléticas menores (defecto craneal y esterebral, reducción de la osificación de las falanges). El efecto de la lidocaína en el desarrollo postnatal se examinó en ratas tratando diariamente a ratas hembras preñadas por vía subcutánea a dosis de 2, 10 y 50 mg/kg (12, 60 y 300 mg/m2) desde el día 15 de la gestación y hasta 20 días después del parto. No se observaron signos de efectos adversos ni en las madres ni en las crías hasta la dosis de 10 mg/kg (60 mg/m2) inclusive; sin embargo, el número de crías supervivientes se redujo con 50 mg/kg (300 mg/m2), tanto en el momento del nacimiento como en la duración del periodo de lactancia, siendo este efecto probablemente secundario a la toxicidad materna. En este estudio no se observaron otros efectos sobre el tamaño de la camada, el peso de la camada, las anomalías en las crías y el desarrollo físico de las mismas.
En un segundo estudio se examinaron los efectos de la lidocaína en el desarrollo postnatal de la rata que incluía la evaluación de las crías desde el destete hasta la madurez sexual. Las ratas fueron tratadas durante 8 meses con 10 o 30 mg/kg, s.c. de lidocaína (60 mg/m2 y 180 mg/m2 en base a la superficie corporal, respectivamente). Este período de tiempo abarcó 3 períodos de apareamiento. No hubo evidencia de alteración del desarrollo postnatal en ninguna cría; sin embargo, ambas dosis de lidocaína redujeron significativamente el número medio de crías por camada que sobrevivieron hasta el destete de las crías de los 2 primeros periodos de apareamiento.
No existen, sin embargo, estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre son predictivos de la respuesta en humanos, este fármaco debe utilizarse durante el embarazo sólo si es claramente necesario.
Parto y alumbramiento: La lidocaína no está contraindicada en el parto. En caso de que se utilice Lidocaína HCl 2% Jelly de forma concomitante con otros productos que contengan lidocaína, debe tenerse en cuenta la dosis total aportada por todas las formulaciones.
Madres lactantes: La lidocaína se secreta en la leche humana. Se desconoce la importancia clínica de esta observación. Se debe tener precaución cuando se administre lidocaína a una mujer en periodo de lactancia.
Uso pediátrico: Aunque, no se ha establecido la seguridad y eficacia de Lidocaína 2% Jelly en pacientes pediátricos, en un estudio de 19 neonatos prematuros (edad gestacional <33 semanas) no se encontró correlación entre la concentración plasmática de lidocaína o monoetilglicinexilida y el peso corporal del lactante cuando se utilizaron cantidades moderadas de lidocaína (es decir, 0,3 mL/kg de lidocaína en gel 20 mg/mL) para lubricar los tubos intranasales y endotraqueales. Ningún neonato presentó niveles plasmáticos de lidocaína superiores a 750 mcg/L. Las dosis en niños deben ser reducidas, de acuerdo con la edad, el peso corporal y la condición física. (Ver DOSIFICACIÓN Y ADMINISTRACIÓN.)
Reacciones adversas
Las experiencias adversas tras la administración de lidocaína son de naturaleza similar a las observadas en otros agentes anestésicos locales amida. Estas experiencias adversas están, en general, relacionadas con la dosis y pueden ser el resultado de niveles plasmáticos elevados causados por una dosis excesiva o una absorción rápida, o pueden ser el resultado de una hipersensibilidad, idiosincrasia o una tolerancia disminuida por parte del paciente. Las experiencias adversas graves son generalmente de naturaleza sistémica. Los siguientes tipos son los más comúnmente notificados:
Se han notificado raramente casos de oclusión del tubo endotraqueal asociados a la presencia de residuos de gelatina seca en el lumen interior del tubo. (Ver también ADVERTENCIAS y POSOLOGÍA Y ADMINISTRACIÓN.)
Sistema nervioso central: Las manifestaciones del SNC son excitatorias y/o depresivas y pueden caracterizarse por aturdimiento, nerviosismo, aprensión, euforia, confusión, mareo, somnolencia, acúfenos, visión borrosa o doble, vómitos, sensaciones de calor, frío o entumecimiento, espasmos, temblores, convulsiones, inconsciencia, depresión respiratoria y paro. Las manifestaciones excitatorias pueden ser muy breves o no producirse en absoluto, en cuyo caso la primera manifestación de toxicidad puede ser la somnolencia que se funde con la inconsciencia y la parada respiratoria.
La somnolencia tras la administración de lidocaína suele ser un signo temprano de un nivel sanguíneo elevado del fármaco y puede producirse como consecuencia de una rápida absorción.
Sistema cardiovascular: Las manifestaciones cardiovasculares suelen ser depresivas y se caracterizan por bradicardia, hipotensión y colapso cardiovascular que puede conducir a una parada cardíaca.
Alérgicas: Las reacciones alérgicas se caracterizan por lesiones cutáneas, urticaria, edema o reacciones anafilactoides. Las reacciones alérgicas pueden producirse como resultado de la sensibilidad al agente anestésico local o a otros componentes de la formulación. Las reacciones alérgicas como resultado de la sensibilidad a la lidocaína son extremadamente raras y, si ocurren, deben ser manejadas por medios convencionales. La detección de la sensibilidad mediante pruebas cutáneas es de dudoso valor.
Sobredosis
Las emergencias agudas por anestésicos locales están generalmente relacionadas con los altos niveles plasmáticos encontrados durante el uso terapéutico de los anestésicos locales. (Ver REACCIONES ADVERSAS, ADVERTENCIAS y PRECAUCIONES.)
Manejo de las emergencias por anestésicos locales: La primera consideración es la prevención, que se logra mejor mediante la monitorización cuidadosa y constante de los signos vitales cardiovasculares y respiratorios y del estado de conciencia del paciente después de cada administración de anestesia local. A la primera señal de cambio, debe administrarse oxígeno.
El primer paso en el manejo de las convulsiones consiste en la atención inmediata al mantenimiento de una vía aérea permeable y la ventilación asistida o controlada con oxígeno y un sistema de suministro capaz de permitir una presión positiva inmediata en la vía aérea mediante mascarilla. Inmediatamente después de la instauración de estas medidas ventilatorias, debe evaluarse la adecuación de la circulación, teniendo en cuenta que los fármacos utilizados para tratar las convulsiones a veces deprimen la circulación cuando se administran por vía intravenosa. Si las convulsiones persisten a pesar de una asistencia respiratoria adecuada, y si el estado de la circulación lo permite, pueden administrarse por vía intravenosa pequeños incrementos de un barbitúrico de acción ultracorta (como el tiopental o el tiamilal) o una benzodiacepina (como el diazepam). El clínico debe estar familiarizado, antes de utilizar anestésicos locales, con estos fármacos anticonvulsivos. El tratamiento de apoyo de la depresión circulatoria puede requerir la administración de fluidos intravenosos y, cuando sea apropiado, un vasopresor según la situación clínica (por ejemplo, efedrina).
Si no se trata inmediatamente, tanto las convulsiones como la depresión cardiovascular pueden dar lugar a hipoxia, acidosis, bradicardia, arritmias y parada cardiaca. Si se produce una parada cardíaca, se deben aplicar las medidas estándar de reanimación cardiopulmonar.
La diálisis tiene un valor insignificante en el tratamiento de la sobredosis aguda de lidocaína.
La DL50 oral de lidocaína HCI en ratas hembras sin ayuno es de 459 (346 a 773) mg/kg (como sal) y de 214 (159 a 324) mg/kg (como sal) en ratas hembras en ayunas.
DOSIFICACIÓN Y ADMINISTRACIÓN
Cuando se utiliza Lidocaína HCI 2% en gelatina de forma concomitante con otros productos que contienen lidocaína, debe tenerse en cuenta la dosis total aportada por todas las formulaciones.
La dosis varía y depende de la zona a anestesiar, la vascularidad de los tejidos, la tolerancia individual y la técnica de anestesia. Debe administrarse la dosis más baja necesaria para proporcionar una anestesia eficaz. Las dosis deben reducirse en los niños y en los pacientes ancianos y debilitados. Aunque la incidencia de efectos adversos con Lidocaína HCI 2% Jelly es bastante baja, se debe tener precaución, particularmente cuando se emplean grandes cantidades, ya que la incidencia de efectos adversos es directamente proporcional a la dosis total del agente anestésico local administrado.
Para la anestesia superficial de la uretra masculina adulta: Cuando se utilicen tubos de 30 mL de gelatina de lidocaína al 2%, esterilizar el cono de plástico durante 5 minutos en agua hirviendo, enfriar y acoplar al tubo. El cono puede ser esterilizado con gas o en frío, según se prefiera. Instilar lentamente unos 15 mL (300 mg de lidocaína HCI) en la uretra o hasta que el paciente tenga una sensación de tensión. A continuación, se aplica una pinza para el pene durante varios minutos en la corona. Se puede instilar una dosis adicional de no más de 15 mL (300 mg) para obtener una anestesia adecuada.
Antes del sondeo o la cistoscopia, se debe aplicar una pinza peneana durante 5 a 10 minutos para obtener una anestesia adecuada. Por lo general, se requiere una dosis total de 30 mL (600 mg) para llenar y dilatar la uretra masculina.
Antes del sondeo, suelen ser adecuados volúmenes más pequeños de 5 a 10 mL (100 a 200 mg) para la lubricación.
Para la anestesia superficial de la uretra femenina adulta: Cuando se utilicen tubos de 30 mL de gelatina de lidocaína al 2%, esterilizar el cono de plástico durante 5 minutos en agua hirviendo, enfriar y acoplar al tubo. El cono puede ser esterilizado con gas o en frío, según se prefiera. Instilar lentamente de 3 a 5 mL (60 a 100 mg de lidocaína HCI) de la jalea en la uretra. Si se desea, se puede depositar un poco de jalea en un hisopo de algodón e introducirlo en la uretra. Para obtener una anestesia adecuada, deben dejarse pasar varios minutos antes de realizar procedimientos urológicos.
Lubricación para la intubación endotraqueal: Aplicar una cantidad moderada de gelatina en la superficie externa del tubo endotraqueal poco antes de su uso. Se debe tener cuidado para evitar introducir el producto en el lumen del tubo. No utilice la jalea para lubricar estiletes endotraqueales. Ver ADVERTENCIAS y REACCIONES ADVERSAS en relación con los raros informes de oclusión del lumen interno. También se recomienda evitar el uso de tubos endotraqueales con jalea seca en la superficie externa por falta de efecto lubricante.
Dosis máxima
No deben administrarse más de 600 mg de lidocaína HCI en un periodo de 12 horas.
Niños: Es difícil recomendar una dosis máxima de cualquier fármaco para los niños, ya que ésta varía en función de la edad y el peso. Para los niños menores de diez años que tienen una masa corporal magra y un desarrollo corporal magro normales, la dosis máxima puede determinarse mediante la aplicación de una de las fórmulas estándar de medicamentos pediátricos (por ejemplo, la regla de Clark). Por ejemplo, en un niño de cinco años que pesa 50 libras, la dosis de clorhidrato de lidocaína no debe exceder de 75 a 100 mg cuando se calcula según la regla de Clark. En cualquier caso, la cantidad máxima de Lidocaína HCI administrada no debe exceder de 4,5 mg/kg (2 mg/lb) de peso corporal.
Cómo se suministra
Lidocaína HCI 2% Jalea se suministra en las formas farmacéuticas indicadas.
NDC 17478-840-30 Tubo de aluminio de 30 mL
NDC 17478-840-05 Tubo de aluminio de 5 mL
En la caja de cartón de 30 mL se incluye un cono aplicador desmontable y una llave para expresar el contenido.
Almacenamiento: Almacenar entre 20° y 25°C (68° y 77°F).
PREMIERProRx®
Fabricado por:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® es una marca registrada de Premier Inc, utilizada bajo licencia.
PLD00N Rev. 10/15
Texto del panel principal para la etiqueta del envase:
NDC 17478-840-05 Logotipo de Premier
Jalea de clorhidrato de lidocaína USP, 2%
Sólo Rx
Estéril 5 mL

Texto del panel principal para la etiqueta del cartón:
NDC 17478-840-05 Estéril 5 mL
Jalea de clorhidrato de lidocaína USP, 2%
Sólo Rx
Logotipo Premier

| LIDOCAÍNA Jalea de clorhidrato de lidocaína |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Etiquetador – Akorn, Inc. (117696770)
Registrador – Akorn Operating Company LLC (117693100)
| Establecimiento | |||
| Nombre | Dirección | ID/FEI | Operaciones |
| Akorn, Inc | 117696840 | Fabricación(17478-840), Análisis(17478-840), Esterilización(17478-840), Envasado(17478-840), Etiquetado(17478-840) | |
Más información sobre lidocaína tópica
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información sobre la dosis
- Interacciones medicamentosas
- Comparar alternativas
- Precios &Cupones
- En Español
- 208 Reseñas
- Clase de medicamentos: anestésicos tópicos
- Alertas de la FDA (5)
.
Recursos para el consumidor
- Información para el paciente
- Aplicación tópica de lidocaína (lectura avanzada)
Recursos para el profesional
- Información para la prescripción
- Lidocaína (tópica) (Consejo profesional del paciente)
- Crema de lidocaína (FDA)
- Gel de lidocaína (FDA)
- Solución laringotraqueal de lidocaína (FDA)
- … +9 más
Otras marcas Lidocaine Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 más
Guías de tratamiento relacionadas
- Picor en la boca
- Cirugía gastrointestinal
- Anestesia
- Quemaduras, externas
- … +9 más
Descargo de responsabilidad médica
