Results
図 1
Figure 1. コロナウイルス感染症患者から採取した重症急性呼吸器症候群コロナウイルス2による細胞障害作用(2020年、米国)。 A-C) 接種後3日目のVero細胞単層膜の位相差顕微鏡写真。 A) Mock,…
2020年1月22日にワシントン州でCOVID-19が確定した患者を確認した。 モック感染細胞ではCPEは観察されなかった(図1、パネルA)。 Cycle threshold(Ct)値はNP検体で18~20,OP検体で21~22であった(1)。 2020年1月22日に陽性臨床検体を分注し、細胞培養に接種して再凍結した。 接種後2日目にCPEを観察し、接種後3日目にウイルス溶解液を採取した(図1、パネルB、C)。 通過1のウイルス溶解液50μLを核酸抽出に使用し、CDC分子診断法(1)によりSARS-CoV-2の存在を確認した。 3回の核酸抽出のCt値は、ヌクレオキャプシド部分1が16.0〜17.1、ヌクレオキャプシド部分2が15.9〜17.1、ヌクレオキャプシド部分3が16.2〜17.3で、SARS-CoV-2の分離を確認できた(Ct <40を陽性とする)。 また、Fast Track 33 Assayを用いて、さらに33種類の呼吸器系病原体について抽出物の検査を行った。 他の病原体は検出されなかった。 同一性は、さらに薄切片電子顕微鏡でも確認された(図1、パネルD)。 コロナウイルスに特徴的な形態と形態形成が観察された。
我々はOPとNP検体の最初の通過から分離した株を全ゲノム配列決定に使用した。 NP検体(GenBank accession MT020880)とOP検体(GenBank accession number MT020881)のゲノムは互いに100%の同一性を示した。 また,対応する臨床検体(GenBank accession no.MN985325)とも100%の同一性を示した。
2回目の継代以降はOP検体とNP検体の分離培養は行わなかった. 2回目以降はOPとNPを別々に培養せず,Vero CCL-81で2回継代し,50%組織培養感染量(TCID50)で滴定を行った. 3902>
本ウイルスはトリプシン非存在下で継代培養した結果,3継代目で8.65 × 106 TCID50/mL,4継代目で7.65 × 106 TCID50/mLとなった. SARS-CoV-2のスパイクタンパク質配列は、S1-S2界面にRRARの挿入があり、furinによって切断される可能性がある(16)。 高病原性鳥インフルエンザウイルスは、ヘマグルチニンタンパク質HA1-HA2界面に塩基性の高いfurin切断部位を持ち、これによりビリオンの細胞内成熟とより効率的なウイルス複製が可能になる(17)。 SARS-CoV-2のRRAR挿入は同様の機能を果たすかもしれない。
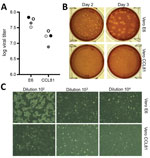
図2。 コロナウイルス疾患患者からの重症急性呼吸器症候群コロナウイルス2のウイルス増殖と定量(2020年、米国)。 A)2つのウイルス継代4株(黒丸と灰丸)を定量…
続いて、別のアカゲザル胎児腎臓細胞株であるVeroE6細胞上でSARS-CoV-2の継代4株を作製した。 SARS-CoV-2第4継代ストックのウイルスRNAの塩基配列を決定し、元の参照配列(GenBankアクセッション番号MN985325)と比較して塩基変異がないことを確認した。 SARS-CoVはVeroE6細胞で、MERS-CoVはVero CCL81細胞でよく増殖することが確認されている(18,19)。 プラークアッセイを確立し、定量に適したVero細胞の種類を決定するために、当社の継代4株をVeroE6細胞およびVeroCCL81細胞でタイイングした。 希釈系列で感染させた後、SARS-CoV-2は両方のVero細胞型で複製されたが、ウイルス力価はVeroE6細胞の方がVero CCL81細胞よりもわずかに高かった(図2、パネルA)。 また、プラークはVero E6細胞でより明瞭に確認することができた(図2、パネルB)。 接種後2日目には、Vero E6細胞はニュートラルレッドで染色して見える明瞭なプラークを形成した。 一方、Vero CCL81細胞では、接種後3日目にニュートラルレッドによる染色で最も容易に定量することができ、あまり明瞭なプラークを形成しなかった。 個々のプラークモノレイヤーにおいて、SARS-CoV-2のVero E6細胞への感染は、細胞クリアランスの領域を持つCPEを生じた(図2、パネルC)。 一方、Vero CCL81細胞では、死細胞が融合してプラークを形成している領域があったが、細胞はクリアーにならなかった。 これらの結果を合わせると、増幅と定量にはVeroE6細胞が最適かもしれないが、どちらのVero細胞型もSARS-CoV-2の増幅と複製をサポートしている。
Figure 3
Figure 3. SARSコロナウイルス2(SARS-CoV-2)に感受性のあるコロナウイルス疾患患者(米国、2020年)からの細胞株。 細胞株は高倍率感染(>5)させ、吸着後に洗浄し、…
SARS-CoV-2の研究・対応に着手しているため、感染しやすい細胞株・型についての情報が必要である。 そこで,Vero E6細胞,Vero CCL81細胞に加え,ヒト腺癌細胞(A549),ヒト肝細胞(HUH7.0),ヒト胚性腎細胞(HEK-293T)など,霊長類やヒトの一般的な細胞株へのSARS-CoV-2の感染・複製能を検討した. また、入手可能なオオコウモリの腎臓細胞株(EFK3B)についてもSARS-CoV-2の複製能を検討した。 各細胞株は高倍率で接種し、感染後24時間後に調べた(図3、パネルA)。 感染後24時間で<3797>107PFUに増殖したVero細胞を除き、いずれの細胞株でもCPEは観察されなかった。 一方、HUH7.0と293T細胞は適度なウイルス複製しか認めず、A549細胞はSARS-CoV-2感染に不適合であった。 これらの結果は、これまでのSARS-CoVの感受性に関する知見と一致しており、MDCK, HeLa, HEP-2, MRC-5 cells, embryonated eggsなどの他の一般的な培養系はSARS-CoV-2の複製を支持しないことが示唆された(20-22)。 さらに、SARS-CoV-2は、MERS-CoVに感受性のあるコウモリEFK3B細胞では複製されなかった。 これらの結果を総合すると、SARS-CoV-2は感受性細胞株という点ではSARS-CoVと同様のプロファイルを維持していることがわかる。
いくつかの細胞種でSARS-CoV-2の強固な感染を確立した後、次にSARS-CoV-2に対する抗体の交差反応性を評価した。 SARS-CoVスパイクタンパク質およびヌクレオキャプシドタンパク質に対するポリクローナル血清は、SARS-CoV-2を認識することがわかった(図3、パネルB、C)。 グループ2Bファミリーに高度に保存されているヌクレオカプシド蛋白質は、SARS-CoVとSARS-CoV-2の間で>90%のアミノ酸同一性を保っている。 複製結果(図3、パネルA)と一致して、SARS-CoV-2は、両方のVero細胞型において強固なヌクレオキャプシド蛋白質を示し、HUH7.0および293T細胞においては蛋白質が少なく、A549およびEFK3B細胞においては蛋白質が最小であった(図3、パネルB)。 SARS-CoVスパイクタンパク質抗体は、SARS-CoV-2スパイクタンパク質も認識し、交差反応性を示した(図3、パネルC)。 SARS CoVと同様に、SARS-CoV-2スパイクタンパク質のいくつかの切断型と未切断型が観察された。 呼吸器系細胞株であるCalu3細胞からのSARSスパイク陽性対照の切断パターンはわずかに異なり、SARS-CoV-2にfurin切断部位の挿入が予測されるため、2つのウイルス間でのスパイクタンパク質のタンパク質分解切断の違いを示す可能性がある(16)。 しかし、細胞の種類や条件の違いにより、この解釈は難しく、同等のシステムでさらに研究を進める必要があることを示している。 全体として、SARS-CoVヌクレオキャプシドおよびスパイクタンパク質抗体からのタンパク質発現データは、複製所見を再現し、SARS-CoV試薬がSARS-CoV-2感染の特徴を示すために使用できることを示す。 コロナウイルス疾患患者から採取した重症急性呼吸器症候群コロナウイルス2の多段階増殖曲線(米国、2020年)。 Vero CCL81(黒)およびHUH7.0細胞(緑)を多重度で感染させた…
最後に、SARS-CoV-2の複製動態を多段階増殖曲線で評価した。 簡単に言えば、Vero CCL-81およびHUH7.0細胞に、低い感染多重度(0.1)でSARS-CoV-2を感染させ、接種後72時間、6時間ごとに、細胞関連および上澄み区画で別々の採取をして、ウイルス複製を評価した(図4)。 SARS-CoVと同様に、SARS-CoV-2はVero細胞において初期の食作用の後、急速に複製され、感染後24時間までに105 TCID50/mL に達し、>106 TCID50/mL でピークに達した。 細胞内と上澄み液で同様の力価が観察され、効率的な脱出が確認された。 接種後48時間までにウイルス力価はピークに達したが,主要なCPEは接種後60時間まで観察されず,接種後72時間でピークに達したことから,感染単層細胞はCPEのピークが観察される前に摘出する必要があることが示唆された. HUH7.0細胞においても,細胞内複製は初期の日食期を経て急速に増加したが,細胞内区画では接種後24時間までに2 × 103 TCID50/mLで停滞し,接種後66時間以降に減少した. 感染したHUH7細胞の上清には、接種後36時間までウイルスが検出されず、すべてのタイムポイントで低い力価を示した(図4)。 HUH7.0細胞では、Major CPEは観察されなかった。 これらの結果は,SARS-CoVやMERS-CoVに関する過去の報告と一致しており,人獣共通感染症CoV株間で類似した複製ダイナミクスが示唆された(23,24)<3902>.
