すべての元素が最外殻を埋めるだけの電子を持つわけではないが、原子は最外殻のすべての電子位置を満たせば最も安定した状態になる。 このように最外殻に空きがあるため、化学結合が形成されたり、同じ元素や異なる元素の2つ以上の間で相互作用が起こり、分子が形成されたりするのです。 より安定性を高めるために、原子は外殻を完全に埋めようとし、電子を共有したり、他の原子から電子を受け取ったり、他の原子に電子を提供したりして、他の元素と結合してこの目的を達成しようとする。 原子番号の小さい元素(原子番号20のカルシウムまで)の最外殻は8個の電子を保持できるため、これを「オクテット則」と呼ぶ。
原子の初期のモデルは、デンマークの科学者ニールス・ボーア(1885-1962)が1913年に開発したものである。 ボーアのモデルは、原子を陽子と中性子を含む中心核とし、電子は太陽の周りを回る惑星のように、核から特定の距離にある円形の電子殻の中にあるものとして示している。 電子の殻はそれぞれ異なるエネルギーレベルを持ち、原子核に近い殻は原子核から遠い殻よりもエネルギーが低くなっている。 例えば、原子核に最も近い電子殻は「1n」と呼ばれるように、各殻には番号と記号が振られている。 電子が殻の間を移動するには、殻間のエネルギー差にちょうど対応する量のエネルギーを吸収または放出しなければならない。 例えば、電子が光子からエネルギーを吸収すると、励起されてより高いエネルギーの殻に移動します。逆に、励起された電子がより低いエネルギーの殻に下がると、エネルギーを放出し、しばしば熱という形で放出します。 電子を外側の高いエネルギー準位に移動させるにはエネルギーを加えなければならず、電子が高いエネルギー準位から内側の近い準位に落ちるときにエネルギーが放出される。 Image credit: modified from OpenStax Biology
原子は、物理法則に支配された他のものと同様に、最もエネルギーが低く、最も安定した配置になる傾向があります。 したがって、原子の電子殻は内側から外側に向かって、電子が原子核に近い低エネルギーの殻を埋めてから、さらに外側の高エネルギーの殻に移動するように配置されるのです。 原子核に最も近い殻である1nは2個の電子を保持でき、次の殻である2nは8個、3nは18個まで保持できる。
特定の原子の最外殻の電子数はその反応性、つまり他の原子との化学結合を形成する傾向を決定する。 この最外殻は価電子と呼ばれ、その中にある電子は価電子と呼ばれる。 一般に、原子は最外殻の電子が満たされているとき、最も安定し、反応性が低くなる。 生物学で重要な元素の多くは、安定であるために最外殻に8個の電子を必要とし、この経験則はオクテット則と呼ばれています。 中には、価電子帯が3n殻で、最大18個の電子を持つことができるにもかかわらず、8重極で安定な原子もあります。 その理由は、後ほど電子軌道について説明するときに明らかにします。
以下に、いくつかの中性原子とその電子配置の例を示します。 この表で、ヘリウムは完全な価電子帯を持ち、その最初の唯一の殻である1nの殻に2個の電子があることがわかります。 同様に、ネオンは8個の電子を含む完全な外殻2n殻を持っています。 このような電子配置により、ヘリウムとネオンは非常に安定している。 アルゴンは、3n殻に最大18個の電子を持つことができるので、厳密には完全な外殻を持っていませんが、3n殻に8個の電子を持っているので、ネオンやヘリウムと同様に安定で、八重項則を満たしています。 一方、塩素は最外殻に7個の電子しか持たず、ナトリウムは1個しか持っていない。 このため、塩素とナトリウムは反応性が高く、電子を獲得したり失ったりして、より安定な配置になろうとします。
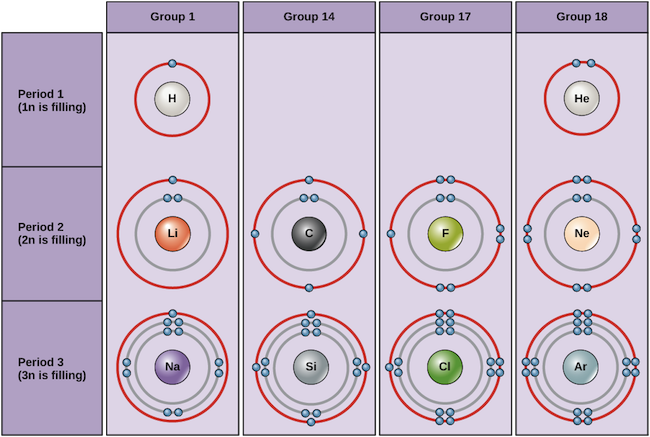
さまざまな元素のボーア図 Image credit: OpenStax Biology
電子配置と周期表
元素は、原子番号(陽子の数)に基づいて周期表の順序に配置されています。 中性原子では、電子の数と陽子の数は等しいので、原子番号から電子数を容易に求めることができます。
生命にとって重要な主要元素を含む周期表の最初の3行だけを考えてみると、それぞれの行は異なる電子殻を満たすことに対応しています。ヘリウムと水素は電子を1n殻に置き、Liなどの2行目の元素は2n殻に、Naなどの3行目の元素は3n殻に置き続けます。 同様に、元素の列番号は、価電子の数と反応性の情報を与える。 一般に、価電子の数は列の中では同じで、行の中では左から右へ増えていく。 1族元素の価電子は1個だけで、18族元素は8個、ただしヘリウムは合計2個だけである。
- ヘリウム(He)、ネオン(Ne)、アルゴン(Ar)は18族元素で、外側の電子殻は満杯か八重項則を満たしている。 そのため、単体では非常に安定している。
- 1族元素の水素(H)、リチウム(Li)、ナトリウム(Na)は、最外殻に1個だけ電子を持っている。 単体では不安定ですが、1個の価電子を失ったり共有したりすることで安定になります。 LiやNaがそうであるように、これらの元素が完全に電子を失うと、正電荷を帯びたイオンになります。
- フッ素(F)と塩素(Cl)は17族元素で、最外殻に7個の電子を持っています。 他の原子から電子を奪って負電荷のイオンになり、安定した八重項を形成する傾向があります。
- 炭素(C)は第14族元素で、外殻に4個の電子を持つ。
このように、周期表の列は、各元素の価電子帯にある電子の数を反映しており、それによってその元素がどのように反応するかが決まります。
試してみる
貢献する!
このページを改善するもっと知る
。
