学習目標
- 単純なイオン化合物の化学式を書く
- 化学式で多原子イオンを認識する
すでにいくつかの単純イオン化合物の化学式がありましたね。 化学式とは、化合物を構成する元素とその比率を簡潔にまとめたものです。
イオン化合物は、結晶と呼ばれる規則正しい3次元の配列の中に、プラスとマイナスのイオンが交互に並んで存在しています(図(ⅳ)ⅳ)。 このように、NaClの「粒子」は一つもなく、ナトリウムイオンと塩化物イオンが交互に並ぶ連続した格子状になっています。 しかし、化合物を表現する方法として、ナトリウムイオンと塩化物イオンの比率をできるだけ小さい整数で表現することができます。 塩化ナトリウムの場合、最も小さい整数で表したナトリウムイオンと塩化物イオンの比は1:1なので、NaCl(Na記号1個、Cl記号1個)を使って化合物を表します。 このように、NaClは塩化ナトリウムの化学式であり、化合物中の異なるイオンの相対数を簡潔に表現しているのである。 マクロな試料は無数のNaClの組で構成されており、その1組1組を式単位と呼びます。 NaCl結晶は1つ1つのNaClユニットで構成されていると考えると便利ですが、図(ⅳ)を見ると、1つのイオンが他の1つのイオンと排他的に結合しているわけではありません。 1561>
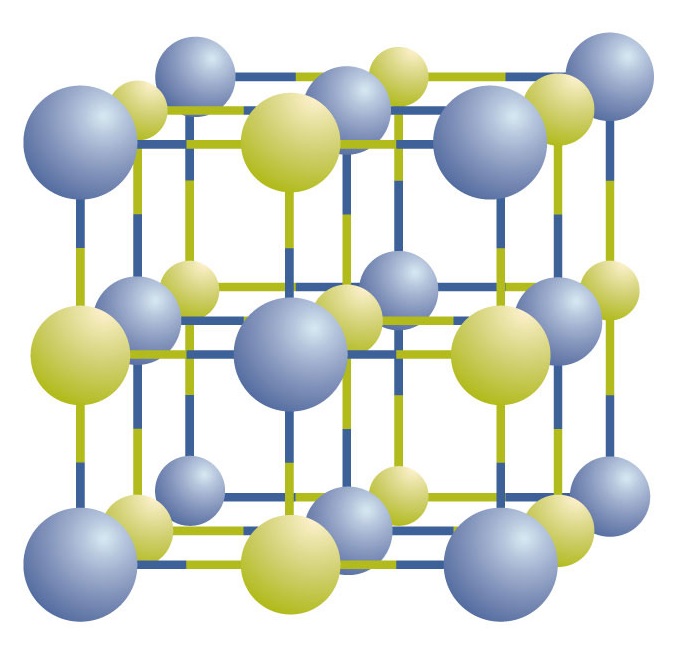
Figure \(\PageIndex{1}) A Sodium Chloride Crystal. 結晶にはプラスイオンとマイナスイオンが交互に3次元的に配列しています。 その模様は化合物によって異なる。 1561>
イオン性化合物の式は、いくつかの規則に従っている。 まず、陽イオンは陰イオンの前に書かれる。 ほとんどの金属は陽イオンを形成し、ほとんどの非金属は陰イオンを形成するので、式は通常、金属を先に、非金属を後に記載する。 第二に、電荷は式に書かない。 イオン化合物では、式に電荷が書かれていなくても、構成種は中性原子ではなくイオンであることを覚えておいてください。 最後に、イオン化合物の適切な式は、常に次の規則に従います:正の電荷の合計が負の電荷の合計と等しくなければなりません。
この規則は最終的に、物質が全体として電気的に中性であるという事実に基づいています。
慣例により、添え字が存在しない場合は原子が1つだけであると仮定してください。
リチウムイオンと臭化物イオンからなるイオン性化合物を見ると、リチウムイオンが1+、臭化物イオンが1-の電荷を持っていることがわかる。 これらの電荷をバランスさせるためには、それぞれのイオンが1つだけ必要です。 臭化リチウムの式はLiBrです。
マグネシウムと酸素からイオン化合物を形成する場合、マグネシウムイオンは2+の電荷、酸素原子は2-電荷を持ちます。 この両イオンは臭化リチウムのイオンより高い電荷を持っていますが、それでも1対1の割合で釣り合っています。 したがって、このイオン化合物の適切な式はMgOです。
次に、マグネシウムと塩素が作るイオン化合物を考えてみましょう。 マグネシウムイオンは2+の電荷を持ち、塩素イオンは1-の電荷を持ちます。
Mg2+ Cl-
それぞれのイオンを結合しても、正と負の電荷は完全にバランスするわけではありません。 これらの電荷をバランスさせる最も簡単な方法は、各マグネシウムイオンに対して2つの塩化物イオンが存在すると仮定することです:
Mg2+ Cl-
これで正と負の電荷はバランスされます。 このイオン化合物の化学式はMgClClと書くこともできますが、ある種のイオンが2つ以上ある場合は数字の添え字を使うのが慣例です(MgCl2)。 この化学式では、マグネシウムイオンが1個、塩化物イオンが2個あることになる。 (式の「Cl2」の部分を2原子元素である塩素の分子として読んではいけません。 この化合物では塩素は2原子元素として存在しない。 むしろ2つの個別の塩化物イオンとして存在する)。 イオン化合物の式では、慣例的に最も小さい整数の比率が用いられる。 Mg2Cl4の式は、1:2の比率でイオンと電荷が釣り合っていますが、最小の整数比ではありません。
By convention, the lowest whole-number ratio of theions are used in ionic formulas.これは、慣習的に、イオンの最も少ない整数比が使用されるためです。 ただし、Hg22+
など特定のイオンには例外がある。
例題 各対のイオンからなるイオン性化合物の化学式を書きなさい。
- ナトリウムイオンと硫黄イオン
- アルミニウムイオンとフッ化物イオン
- 3+鉄イオンと酸素イオン
Solution
- 8価の殻を得るために、ナトリウムは1+、硫黄は2-電荷のイオンとして形成されています。 硫黄イオンの2価の電荷と釣り合うように、2個のナトリウム1+イオンが必要です。
- アルミニウムイオンは3+の電荷を持ち、フッ素によって形成されるフッ化物イオンは1-の電荷を持っています。 アルミニウムイオンの3+の電荷と釣り合うように、3つのフッ素の1-イオンが必要である。 この組み合わせはAlF3と表記されます。
- 鉄は2つのイオンを形成する可能性がありますが、ここでは3+の電荷を持つイオンを指定します。 酸素原子はイオンとして2-の電荷を持ちます。 鉄の3+イオンが2つあれば6+になり、酸素の2-イオンが3つあれば6-になるので、全体の正負の電荷のバランスをとることができます。 したがって、このイオン化合物の化学式はFe2O3となります。
練習問題
各対のイオンからなるイオン化合物の化学式を書きなさい。
- カルシウムイオンと酸素イオン
- 2+銅イオンと硫黄イオン
- 1+銅イオンと硫黄イオン
多核イオン
原子が結合して全体として電気を持ったイオンもあります。 このようなイオンは複数の原子を含んでいるので、多原子イオンと呼ばれます。 多原子イオンには特徴的な式、名前、電荷があるので、暗記しておくとよいでしょう。 例えば、NO3-は硝酸イオンで、窒素原子1個と酸素原子3個を持ち、全体の電荷は1-です。 代表的な多原子イオンを表 ㊦に示します。 Some Biologically Important Polyatomic Ion
Nitrate イオンNO3-
多核イオンを含むイオン化合物の式の構成規則は単核(単体)を含む式と同じであり、その場合、式は1.5倍となる。原子)イオンになります。 正と負の電荷が釣り合わなければならない。 電荷を釣り合わせるために複数の多原子イオンが必要な場合は、多原子イオンの式全体を括弧で囲み、括弧の外側に数字の添え字を付けます。 これは、添え字が多原子イオン全体に適用されることを示すためです。 例:Ba(NO3)2.
例題 ⑭イオン対からなるイオン性化合物の化学式を書きなさい。
- カリウムイオンと硫酸イオン
- カルシウムイオンと硝酸イオン
解答
- カリウムイオンが1+、硫酸イオンが2-の電荷を持っていることがわかる。 硫酸イオンの電荷と釣り合うようにカリウムイオンが2個必要なので、化学式はK2SO4となります。
- カルシウムイオンは2+、硝酸イオンは1-の電荷を持っています。 カルシウムイオン1個の電荷と釣り合うように、硝酸イオンが2個必要です。 硝酸イオンの式はかっこで囲む必要があります。
Exercise \(\PageIndex{2})
各対のイオンからなるイオン性化合物の化学式を書け。
- マグネシウムイオンと炭酸イオン
- アルミニウムイオンと酢酸イオン
Recognizing Ionic Compounds
イオン性の見方は2通りある。 まず、金属と非金属の間の化合物は通常イオン性です。 例えば、CaBr2は金属元素(2A族金属のカルシウム)と非金属元素(7A族非金属の臭素)を含んでいます。 したがって、イオン性化合物である可能性が高い。 (一方、NO2という化合物は、ともに非金属である2つの元素(5A族の窒素と6A族の酸素)を含んでいるため、イオン性化合物の可能性が高い(実際、イオン性である)。 これはイオン性化合物ではなく、別項で説明する共有結合性化合物のカテゴリーに属する。 また、この窒素と酸素の組み合わせは電荷を持たないので、亜硝酸イオンではないことに注意してください。
次に、化合物の中に多原子イオンの式がある場合、その化合物はイオン性です。 例えば、Ba(NO3)2という式があれば、NO3の部分が硝酸イオンであることが分かります(˶′ᴗ‵˶)。 (イオン化合物の式の書き方として、イオンの電荷を入れないという慣習があることを覚えておいてください)。 これは、式のもう一つの部分であるBaが実際にはBa2+イオンであり、2+の電荷が2つの硝酸イオンによる全体の2-電荷と釣り合うことを示す手がかりとなります。 したがって、この化合物もイオン性です。
Example \(\PageIndex{3})
Identify each compound as ionic or not ionic.
- Na2O
- PCl3
- NH4Cl
- OF2
溶液
- Na2O は金属、酸素は非金属だからイオン性だと予想される。
- 式中のNH4はアンモニウムイオン、NH4+を表し、この化合物がイオン性であることを示しています。
- 酸素とフッ素はともに非金属です。
練習問題
それぞれの化合物がイオン性か非イオン性かを識別してください。
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
科学は長い間、血液と海水が似たような組成であることを認識していました。 結局のところ、どちらの液体にもイオン化合物が溶けているのです。 多くの科学者は、地球上の最初の生命は海で誕生したと考えている。 しかし、よく見てみると、血液と海水はまったく違う。 血液中の塩分濃度は、0.9%の塩化ナトリウム溶液で近似している。 一方、海水は主に3%の塩化ナトリウム水溶液で、血液中の3倍以上の濃度になります。 ここで、血液と海水のイオン量を比較してみましょう。
| イオン | 海水中の割合 | 血液中の割合 | ||
|---|---|---|---|---|
| Na+ | 2.36 | 0.322 | ||
| Cl- | 1.94 | 0.366 | ||
| Mg2+ | 0.13 | 0.002 | ||
| SO42ー | 0.002 | |||
| Mg2+ + | 0.09 | – | ||
| K+ | 0.04 | 0.016 | ||
| Ca2+ | 0.002 | 0.013 | Ca2+ | 0.0096 |
| hco3- | 0.002 | 0.0096 | 0.0096 | 0.165 |
| HPO42-, H2PO4- | – | 0.01 |
ほとんどのイオンが血液中より海水中で多く、いくつかの重要な例外はありますが、海水中の方がより多く存在しています。 炭酸水素イオン(HCO3-)は、海水よりも血液中の方がはるかに多いのです。 この違いは、炭酸水素イオンといくつかの関連イオンが血液の酸塩基特性を制御する上で重要な役割を担っているため、重要な意味を持ちます。 また、海水中のリン酸水素イオン(HPO42-、H2PO4)は非常に少ないが、血液中には多量に存在し、これも酸塩基性に影響を与える。
Key Takeaways
- イオン性化合物の正しい化学式は、正の電荷と負の電荷の合計のバランスがとれている。
- 多原子イオンと呼ばれる、全体の電荷を持つ原子のグループも存在します。
貢献者と帰属
-
Anonymous
