サイクリンの紹介
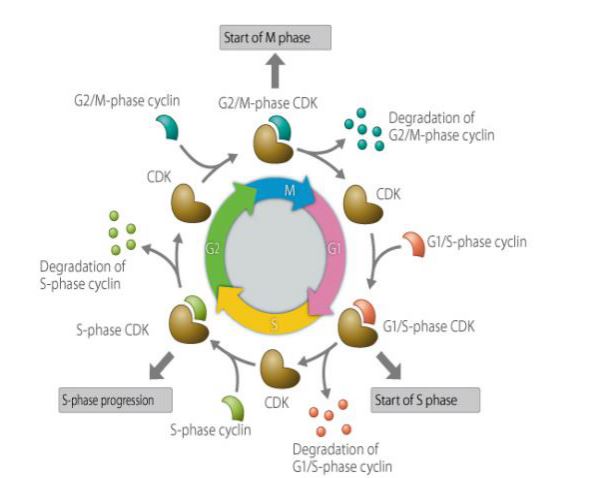 サイクリンは細胞周期で発現、蓄積、分解するタンパク質の一種で、サイクリン依存性キナーゼと相互作用して細胞周期機能に影響を与えている。 サイクリンは細胞周期制御タンパク質に関与しており、その濃度は細胞周期で周期的、循環的に変化する。 細胞周期のステージによって、時には数千倍もの高濃度になることもあれば、ゼロになることもある。 サイクリンは制御サブユニットとして、サイクリン依存性プロテインキナーゼに結合し、活性化させる。 細胞周期の異なる時期に、異なるサイクリンが発現している。 哺乳類細胞では、サイクリンAはG1期初期に発現が始まり徐々に蓄積し、G1/S接合部に達し、G2/M期で含有量が最大となり残存する。 サイクリンBはG1後期から発現し、徐々に蓄積する。 G2期後半に最大となり、M期中盤まで維持され、その後急速に分解される。 G1期サイクリンであるサイクリンDは細胞周期で連続的に発現し、サイクリンEはM期後半からG1期前半に発現が始まり徐々に蓄積し、G1期後半に最大量となり、G2期後半まで徐々に減少する。 サイクリンは細胞周期の調節に重要な役割を担っている。 サイクリンのメカニズムを研究することは、がんの治療に大きな意味を持つ。
サイクリンは細胞周期で発現、蓄積、分解するタンパク質の一種で、サイクリン依存性キナーゼと相互作用して細胞周期機能に影響を与えている。 サイクリンは細胞周期制御タンパク質に関与しており、その濃度は細胞周期で周期的、循環的に変化する。 細胞周期のステージによって、時には数千倍もの高濃度になることもあれば、ゼロになることもある。 サイクリンは制御サブユニットとして、サイクリン依存性プロテインキナーゼに結合し、活性化させる。 細胞周期の異なる時期に、異なるサイクリンが発現している。 哺乳類細胞では、サイクリンAはG1期初期に発現が始まり徐々に蓄積し、G1/S接合部に達し、G2/M期で含有量が最大となり残存する。 サイクリンBはG1後期から発現し、徐々に蓄積する。 G2期後半に最大となり、M期中盤まで維持され、その後急速に分解される。 G1期サイクリンであるサイクリンDは細胞周期で連続的に発現し、サイクリンEはM期後半からG1期前半に発現が始まり徐々に蓄積し、G1期後半に最大量となり、G2期後半まで徐々に減少する。 サイクリンは細胞周期の調節に重要な役割を担っている。 サイクリンのメカニズムを研究することは、がんの治療に大きな意味を持つ。
サイクリンファミリーとそれぞれの機能
現在までに、ヒトサイクリンはAからHの合計8種類に分離・命名され、いくつかのサブクラス(サイクリンD1、D2、D3など)を含み、そのうちF、G、Hが最新の発見者たちである。 すべてのサイクリンにはアミノ酸配列の類似性があり、サイクリンの分子構造マーカーとして機能している。 このサイクリンの相同アミノ酸領域は、いわゆるサイクリンカセットと呼ばれるもので、様々な生物のサイクリン間で高度に保存された100-150アミノ酸の配列領域である。 また、ヒトのサイクリンには、欠損カセットやプロリン、グルタミン酸、アスパラギン酸、セリン、スレオニン残基に富んだアミノ酸配列領域(以下、PESTアミノ酸配列領域と呼ぶ)が存在する。 サイクリンBとサイクリン依存性キナーゼp34CDC2との結合は、有糸分裂の入口と出口を制御する。S期からG2 /M期にかけて合成され、徐々に蓄積してp34CDC2と結合する。 M期では徐々に分解され、逆にM期からの離脱は、分裂後期にサイクリンが急速に分解され、不活性サブユニットp34CDC2が放出されることに依存する。 ヒトの細胞では、サイクリンBは細胞質内に蓄積し、核膜が消失する前に核内に侵入する。 活性化されると、サイクリンB/CDCはラミン、ビメンチン、カルシウムなどのタンパク質群をリン酸化し、染色体集中、核膜崩壊、中間フィラメント解重合、ミクロフィラメント再編成に重要な役割を果たす。 また、Cyclin Bは有糸分裂の相転移に重要な役割を果たし、古典的な切断周期タンパク質である。 サイクリンAは、G2/MとG1/Sの両相転移に関与している。 DNA合成開始前に出現し、分裂前段階まで徐々に増加し、中間段階で分解される。 有糸分裂を誘導する場合、真の有糸分裂期のサイクリンBとは多くの点で異なっている。 サイクリンCの含量は細胞周期を通じてほとんど変化せず、G1初期にわずかに増加するのみである。 サイクリンCのmRNAは同期したHeLa細胞においてG1中期にピークを示し、これはサイクリンAよりも早く、G1における役割を担っている可能性がある。 Cyclin Eは細胞周期において明確な周期的発現を示し、そのピークはG1 /S相転移にある。 細胞がS相に移行するのを制御する機能を持ち、G1 /S相転移の律速因子となる可能性がある。 哺乳類細胞では、サイクリンAと同様にG1 /S期初期にヒストンH1キナーゼ活性を持つp33CDK2と結合するが、サイクリンAおよびEはレチノブラストーマタンパク質と相互作用して複合体を分離できることから、CDK2/サイクリンAまたはE複合体は間接的にG1およびS期の遺伝子発現を制御できることが示唆される。 サイクリンEは、DNA複製の開始、G1 /S変換に重要な役割を果たし、その過剰発現により細胞のS期への移行が促進されるサイクリンDに関与している可能性がある。 サイクリンDは、サイクリンEよりも先に、あるいは同時に、G1期初期を制御していると考えられる。サイクリンDには3つのサブタイプ(D1、D2、D3)があり、その発現は細胞によって異なり、異なる染色体領域(D1:11q13、D2:12p13、D3:6p21)によって制御されていると考えられている。 サブタイプは異なる作用を持つ可能性がある。 サイクリンDの顕著な特徴は、外部刺激に応答して発現が誘導され、高い成長因子誘導性を示し、成長因子センサーとして働き、外部シグナルと細胞周期内部をつなぐ重要な役割を担っていることである。 その役割は、逆に、その無制御な発現により、細胞周期が成長因子に依存しなくなる、あるいは依存しなくなり、がんを誘発する可能性があると推論される。 サイクリンD-CDK複合体は、G1期のレチノブラストーマ(Rb)プロテインキナーゼの最有力候補である。 サイクリンDはRbタンパク質のN末端領域に結合し、G1期後半にRbをリン酸化し、サイクリンD1の合成と活性化によりRbリン酸化の不活性化とサイクリンD1のダウンレギュレーションが起こり、D1-CDK4複合体はG1期に負のフィードバックを形成し、サイクリンD1の発現をシャットダウンさせる。 サイクリンD1とRbは、G1期でサイクリンD1が異なる場合、細胞の増殖と分化に重要な役割を果たす。 ソース発現では、Rbのリン酸化が通常より早い;G1期が加速され、抗サイクリンD1抗体がG1初期からメタフェースの細胞にマイクロインジェクションされる;ほとんどの細胞はS期の前に停止し、機能的Rbの欠如はこのブロックを引き起こすことができない;サイクリンD1の重要な役割は、Rbのリン酸化を不活化し、それによってS期とDNA複製への参入を誘導すると結論された。 CyclinFは最も豊富なサイクリンタンパク質(分子量87 kDa)で、そのmRNAは様々なヒト組織細胞で普遍的に発現しており、細胞周期に大きな変化があることが分かっている。 ピークはサイクリンAと同じくG2期であり、サイクリンBのmRNA量が減少する前に減少する。 サイクリンFタンパク質は細胞間期で蓄積し、有糸分裂期で破壊される。 ほとんどの細胞で核内に存在する。 ヒトの細胞で過剰発現または変異させると、PESTアミノ酸配列領域が欠落し、G2期細胞の増加につながる。 サイクリンGは分裂酵母のサイクリンBに最も似ており、G1/S転換に関与しているが、サイクリンGのmRNAは明らかな細胞依存性はないが、細胞増殖により刺激されることがある。 因子が誘導され、上昇したレベルを維持する。 サイクリンg遺伝子には2種類のp53結合部位があり、そのうちの1つは転写開始部位の上流にあることから、p53がサイクリンg遺伝子を効率的に活性化する可能性が示唆される。 少なくとも生物学的効果においてp53の下流メディエーターであるcyclin Hは、CDK activating kinase(CAK)を分離・精製することによって見出された分子量37kDのタンパク質である。
サイクリンの機能 細胞周期とがんの関係の研究は、臨床腫瘍学研究にとって指針となる意義を持っている。 サイクリンDを阻害する、あるいは細胞周期阻害剤の作用を模倣してがん細胞の分裂を抑制するなど、臨床治療のための特定のターゲットを提供し、臨床診断、鑑別診断、予後のためのいくつかの指標を提供することができる。 Michaeletらは、マントル細胞リンパ腫32例のbcl-1遺伝子再配列とサイクリンD1タンパク質発現を解析し、bcl-1遺伝子再配列17例、細胞質サイクリンD1発現24例、対照群40例非MCL B細胞リンパ腫9例のみ陽性であったことを明らかにした。 彼らは、サイクリンD1がMCLの鑑別診断、B細胞リンパ腫の鑑別診断に使えると考えている。 サイクリンは細胞周期で周期的に発現し、ある特定のサイクリン-CDK複合体はある細胞周期を通過するのに必要であり、サイクリンが細胞の増殖状態の指標として使用できることが示唆された。 あるサイクリンの発現比率は、ある組織において、ある細胞周期にある細胞の割合を予測することができる。 腫瘍細胞の悪性度が高いほど、細胞周期の乱れは深刻であるため、細胞周期が示す情報によって患者の予後を反映し、予後指標として機能する可能性がある。 Keyomarsiらは、乳癌手術検体9例と隣接する非癌組織を対照とした研究を行った。 8例の癌組織ではcyclin Eが質・量ともに異常発現しており、少なくとも3種類の分子量が存在していた。 Cyclin Eが過剰発現しているのに対し、c-erbB2が過剰発現しているのは3例のみであった。 腫瘍の病期が進むにつれて、cyclin E蛋白の含量は有意に増加し、増殖細胞核抗原(PCNA)のレベルはわずかに増加しただけであった。 また、病期分類の高い4例ではcyclin E構造が観察された。 Duttaらは抗cyclin A, B, E抗体を用いて乳癌48例のパラフィン切片を検出し、cyclin AとBの平均陽性指数がS期の増加とともに有意に増加することを見出した(P < 0.05)。 Cyclin AはKi-67およびS期分画と正の相関があった(P < 0.05)。 Bellacosaet alは、51例の原発性喉頭扁平上皮癌を対象に29ヶ月間の追跡調査を行った。 サイクリン遺伝子増幅は、喉頭癌の独立した予後指標として使用できると考えられている。 しかし、Betticheらは外科的切除を行った非小細胞肺癌53例を検討し、25例にcyclin D1過剰発現が認められ、組織分化が悪く、腫瘍内のリンパ球浸潤が少なく、局所再発率が低かった(P < 0. 05)。 彼らは、サイクリンD1発現の予後的意義をさらに検証するために、より大規模な臨床研究が必要であると考えている。
- He G, Kuang J, Koomen J, et al. Platinum-based antitumour agentsによるDNA損傷後のG1期サイクリン依存キナーゼによる3量体の増殖細胞核抗原へのリクルート。 British Journal of Cancer. 2013, 109(9):2378-2388.
- Gang W, Cao J, Chen P, et al. Rat Spinal Cord InjuryにおけるCyclin Hの時間的・空間的発現. Neuromolecular Medicine. 2011, 13(3):187-196.
- Ibrahim N, Nazimi A J, Ajura A J, et al. Syndromic and Nonsyndromic Keratocystic Odontogenic Tumorにおける臨床的特徴および bcl-2, Cyclin D1, p53, Proliferating Cell Nuclear Antigenの発現.The clinical features and Expression of bcl-2, Cyclin D1, p53, and Proliferating Cell Nuclear Antigen in Shimedocystic Odontogenic Tumor, N. J, and al. Journal of Craniofacial Surgery. 2016, 27(5):1.
- Wang X, Wolgemuth D J, Baxi L V. Overexpression of HOXB5, cyclin D1 and PCNA in congenital cystic adenomatoid malformation.邦訳は「先天性嚢胞性腺腫腫におけるHOXB5の過剰発現」。 Fetal Diagnosis & Therapy. 2011, 29(4):315-320.
