 |
|
酸塩基反応はどこにでもある反応であります。 水溶液中では、酸は水素イオン(H+)濃度を増加させる。 一方、塩基は水酸化物イオン(OH-)濃度を増加させる。 水溶液中で酸と塩基が反応すると、H+イオンとOH-イオンが結合し、水が生成される。 8449>
ほとんどの酸は一般式 HA を持ち、A- は陰イオンであり、ほとんどの塩基は BOH の形を持ち、B+ は適切な陽イオンである。 酸と塩基は、強酸と弱酸の2種類に大別される。 強酸は水溶液中で100%分解してプロトン(H+)とアニオン(A-)になる
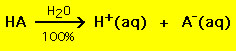
一方、ほとんどの弱酸は水溶液中で100%よりかなり少なく分解する:
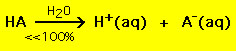 .
.つまりほとんどの弱酸分子は水中でそのまま残るのである。 強塩基、弱塩基についても同様の化学式が成り立つ。
弱い酸と塩基はわずかしかない、それらは。
| |
|
|
HCl(塩酸) HNO3(硝酸) HClO4( 過塩素酸) 。 H2SO4 (硫酸) |
NaOH (水酸化ナトリウム) KOH (水酸化カリウム) Ca(OH)2 (水酸化カルシウム) |
| |
|
||
|
F-(フッ化物) Br-(臭化物) I-(ヨウ化物) HCO3-(水素化物) |
。 (炭酸水素塩)
C2H3O2- (酢酸塩) MnO4- (過マンガン酸塩) PO4-3 (リン酸塩) CrO4-2 (クロム酸塩) CN- (青酸) NO2- (亜硝酸塩) SO3- (青藍)2(亜硫酸塩) |
HF (フッ酸) HBr (臭化水素酸) HI (ヨウ化水素酸) H2CO3 (炭酸) HC2H3O2 (酢酸) HMnO4 (過マンガン酸) H3PO4 (リン酸) H2CO3 (炭酸)H3PO4 (リン酸) H2CrO4(クロム酸) HCN(青酸) HNO2(亜硝酸) H2SO3(亜硫酸) |
通常の酸/塩基反応において酸と塩は反応して塩と水を形成する、例.g., 青酸と水酸化ナトリウム:
