Annual Cornea Report
An OD’s Guide to Corneal Transplant Options
Fixing a Hole.角膜移植の選択肢は、以下のリンクからお読みいただけます。
How to Heal Persistent Epithelial Defects
Intruder Alert: Diagnosing Corneal Infiltrative Disease
多くの眼科医と患者にとって、円錐角膜(KCN)管理は望ましくない現状を維持していると感じるかもしれません。 1にもかかわらず、これらの患者は、CLEK研究(円錐角膜の共同縦断的評価研究)の国立眼科研究所の視覚機能アンケートで、進行した黄斑変性症の患者と同様のスコアを獲得しています2-5。同じグループによる別の報告では、KCN患者の自己認識QOLスコアが時間とともに低下し続けていることが判明しました6。 2003年に開発されて以来、角膜クロスリンキング(CXL)は急速にKCNの進行抑制のための治療法として選ばれるようになりました8。 CXLは2016年に米国食品医薬品局(FDA)の承認を受けたばかりですが(AvedroのKXL Systemと2種類の光強化剤、PhotrexaとPhotrexa viscous)、Wills Eye Hospitalでは長年にわたり、臨床試験のもとで患者さんにCXL治療を提供することができました。
どんな新しい治療法でも、臨床医にとっては、患者教育や選択プロセス、その他の周術期管理関連のプロトコルを改良するための学習曲線が存在するものです。 当社のコーネアル・サービスは、オープンなコミュニケーションを通じて、臨床医がKCN診療所においてCXLを臨床的に快適に使用できるよう支援することが可能です。 ここでは、当社のパートナーである医師がよく尋ねる12の質問を紹介します。その答えは、CXLについてKCN患者をどのように教育するのが最善かを決めるのに役立ちます。
図1.
CXLとは何か、どのように機能するか?
架橋は、モノマーをポリマーの三次元ネットワークに再配列して、分子構造の健全性を高める重合プロセスです。 このプロセスは、時間の経過とともに結合組織が徐々に硬くなるにつれて、私たちの体内で自然に起こります。 内因性酵素リシルオキシダーゼが必要な酸化反応を促進することで、コラーゲン線維の間や内部にさらなる共有結合 (組織の「架橋」) が形成され、組織の生物力学的強度が向上します。 1990年代後半、ドイツのドレスデン大学の研究者たちは、角膜の架橋誘導を促進しCXLを実現するためには、光化学誘導プロセスが最も臨床的に実行可能な方法であると判断した8。この研究では、光増感剤として0.1%のリボフラビン(溶液中のデキストランは20%)を用いて、慎重に調整した紫外線エネルギー量を吸収し、組織内の酸素を1価酸素分子に変換させた。 結果として生じる活性酸素種は、リシルオキシダーゼ酵素経路を活性化するのに十分なエネルギーを持ち、角膜の間質内で新しい共有結合の形成につながる。
ドレスデンの研究では、治療した23の進行性KCN眼はすべて安定し、70%が最大で2.01Dの角膜平坦化を示したと報告されています。 それ以来、多くの研究が、上皮除去を含む同じCXLプロトコルを用いて、KCN患者に良好な安全性プロファイルで同様の効果を達成しています(図1)10-13
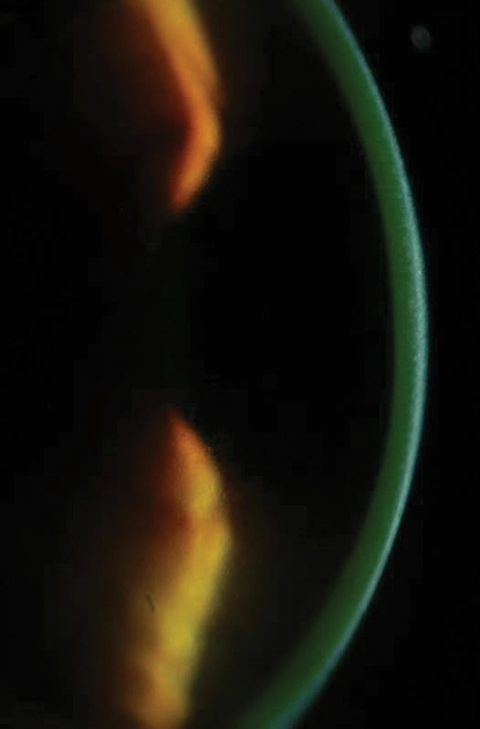
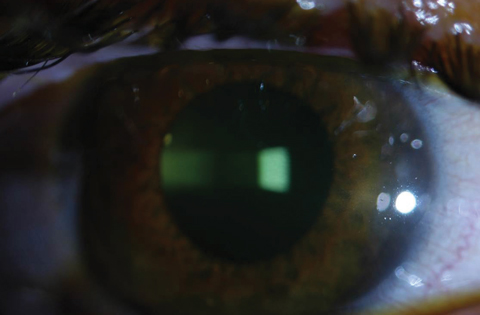
図2aおよび2b.のように、上皮を除去することで、KCN患者を改善することができました。 上図、リボフラビン負荷後の角膜間質で見られるリボフラビンの飽和状態。 下は、2分間隔でリボフラビン負荷の30分後、臨床医は水性リボフラビン染色を確認する必要があります。
CXL におけるリボフラビンの役割とは?
角膜の生体内酸素分子は紫外線によって直接活性化できないため、光増感物質が中間物質として作用する必要があるのです。 リボフラビンは、紫外線エネルギー(特に365nmから370nmのUVA)をストローマンの酸素分子に伝達することにより、CXLの光化学反応を触媒し、安定した酸素分子をより反応性の高い一重項型に転換させる。 この反応性酸素種が、間質内の酸化反応を開始させる。
紫外線エネルギーが制限的な資源ではないと仮定すると、CXLプロセスを永続させるために必要なエネルギー移動を維持するには、継続的な酸素補給と活性リボフラビン分子が不可欠となります。
さらに、リボフラビンで角膜を飽和させると、内皮、水晶体、網膜に達するそれぞれの紫外線エネルギー レベルが、実際の細胞損傷閾値よりはるかに低い強度に調整される「遮蔽効果」が生じます。 実際、リボフラビン飽和角膜の厚さが少なくとも400μmであれば、内皮に透過する紫外線放射量はわずか0.18mW/cm2であるが、実際の内皮の損傷閾値は約0.35mW/cm2である。 その後、水晶体および網膜に到達すると予測されるエネルギーレベルは、これらの組織層のそれぞれの損傷閾値と比較してさらに低くなります14,15
標準 CXL プロトコルにおける上皮除去の目的は何ですか?
角膜上皮の親油性の性質およびその密着結合の小さな孔径により、この層はリボフラビン分子に本質的に無縁です。 これらの上皮のバリア特性は、標的となる間質組織における効率的かつ均質なリボフラビン飽和を妨げる16
上皮はまた、アスコルビン酸やトリプトファン残基などの高い抗酸化特性を持つ酵素を含み、紫外線透過を防ぎ活性酸素をスカベンジさせることができる。 さらに、上皮のバリアの存在は、CXL処置中の酸素補給速度を遅くし、その結果、新たにできる細胞の架橋の総量を減らすことができる。 その結果、同じ標準的なCXLプロトコルを無傷の角膜表面で実施した場合、処置の全体的な有効性は予想より低くなる。 一方、不均質なリボフラビン飽和とリボフラビン遮蔽効果の低下により、内皮と眼球深部の組織に届く紫外線透過率は、以前に計算されたよりも高いかもしれない16,17
臨床医は、上皮剥離を伴う場合のみCXLが有効であると考えるべきではありません。 経上皮CXL(TE-CXL)アプリケーションは現在FDAの承認を受けていないが、TE-CXLの効果を高めるために修正された治療技術が研究されているところである。
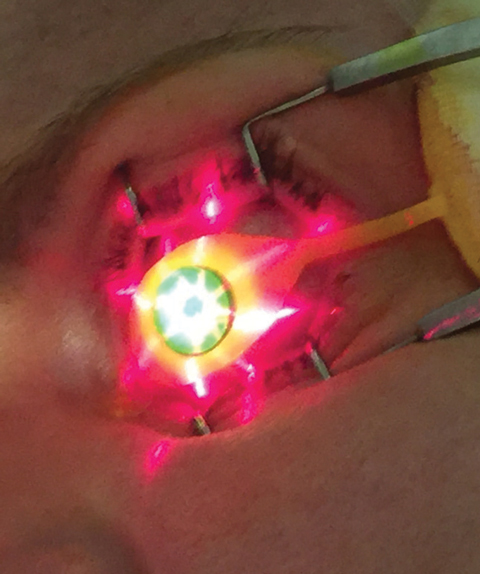
図3.
標準的なCXLプロトコルはどのように行われますか?
中央9mmの上皮を除去する際に局所麻酔を使用し、患者の快適性を確保するとともに、CXL中にPhotrexa viscous(リボフラビン 5′-phosphate in 20% dextran ophthalmic solution)の間質飽和時間をより早く、均一にすることができます。 10
30分後、患者は細隙灯の下で検査され、リボフラビンが目的の治療領域を飽和していることと、それが眼球内に存在することが確認される(図2aおよび2b)。 FDAが承認した適応症に基づき、臨床医はリボフラビン塗布後、角膜の厚さが少なくとも400μmであることを確認するためにパチメトリーを行う必要がある。 400μm未満の場合は、角膜が400μm以上に再水和されるまで5~10秒ごとに低張力フォトレキサリボフラビンを投与する必要があります10。
適切なパチメトリーレベルが確認されたら、CXL治療の第二段階としてKXL UVデバイス(Avedro)を使用し、30分間のUV照射(3mW/cm2)により5.4J/cm2の総エネルギー量を得る8。UV照射期間中、オペレーターが適切な遠心とデバイスとの距離を維持しながらPhotrexa viscousが2分間隔で注入される。 KXL装置の適切な位置は、十字線画像の投影(図3)によって誘導することができ、これにより治療角膜に最適な照明ビームプロファイルを提供することができる。
治療セッションの終わりに、余分なリボフラビンをバランス塩溶液で洗い流すことができます。 包帯コンタクトレンズ(BCL)は、局所的な抗生物質とコルチコステロイド剤を浸透させた後に挿入される。 BCLは3~5日間、または上皮が閉じるまで治療眼に装着しておく必要がある(図4a、4b)。
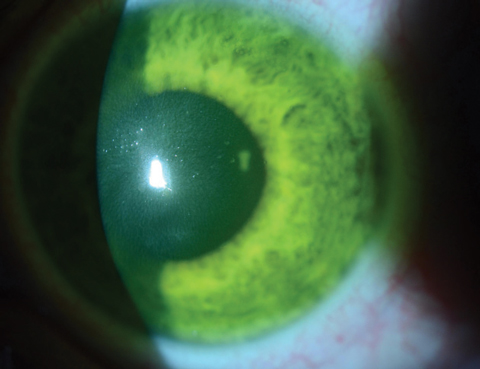
図4a. ここでは、角膜リボフラビン飽和がまだ明らかな患者に対するCXL治療直後に、包帯ソフトコンタクトレンズを眼に装着している。
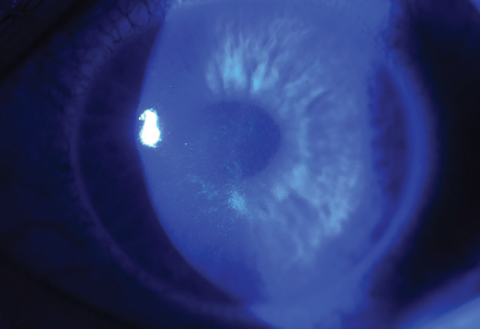
Fig. 4b. CXL治療後わずか3日で、上皮の創傷がほぼ完全に閉鎖された患者
患者選択の推奨事項は?
2016年、標準的なCXLプロトコルは、屈折矯正手術後に進行性のKCNまたは角膜外形を有する14歳以上の患者の治療に米国で表示適応を取得した。 しかし、未治療のまま放置すると、疾患の重症度や進行速度が若年層の患者さんでより積極的になることが知られています。 したがって、KXLシステムおよびPhotrexa/Photrexa viscousは、最小角膜厚が400μm以上の若年層患者への適応外使用を検討することが可能である。 FDAは禁忌を指定していないが,授乳中の母親や65歳以上の患者にCXLを提供する前に,臨床医は判断する必要がある。 また、研究者は妊娠中のCXLを避けることを強く推奨している。 最近の研究では、妊娠中の患者コホートの100%にKCN進行のトポグラフィー、パチメトリックス、バイオメカニクスの証拠が見つかった19。 20
CXLを推奨するためにKCNの進行は必要か
KCNの進行はCXL治療の適応症の一部であるが、特定の状況ではCXLの診察前に進行が必要ない場合もある。 19,21
従来のKCNケアモデルによると、新しい治療コースを開始する前に、臨床パラメータにある程度の意味のある変化が現れなければなりません。 しかし、疾患の進行を構成する正確な臨床指標とそれに対応する変化の大きさに関するコンセンサスがないため、対策が取られる前に重大な進行が起こることが多いのである。 多くのCXL研究では、KCNの進行を以下の測定値のいずれかにおける12ヶ月間の変化と定義している。 最大角膜厚が1D以上、近視が0.5D以上、乱視が1D以上、最薄パチメトリーポイントが10μm以上減少している。10-12、20、22 しかし、従来のトポグラファーは不規則な角膜表面を撮影する際の精度に限界があり、KCN患者の屈折率の変動から、これらのガイドラインは偽陽性の割合を高くしてしまうかもしれません。
あるいは、ある専門家委員会は最近、3つの基準のうち少なくとも2つが存在すれば進行を立証できると推奨している:角膜前面曲率の急峻化、角膜後面曲率の急峻化、または周辺部から最薄部までのパチメトリック分布プロファイルを比較すると薄肉化。
これらの臨床的ハードルを考慮した上で、4つの国際角膜学会から集まった専門家委員会は、進行が記録されていなくても、高リスクプロファイルのKCN患者にCXLの推奨が可能であると結論づけた。 KCN患者は、人生の4、5年目には進行速度が遅くなるか、あるいは安定する傾向があり、これは加齢に伴うクロスリンクの副産物であると考えられる。 しかしながら、KCNの発現は非常に多様であり、年齢だけではKCNのエンドポイントとして必ずしも十分な定義がなされていない。 23
さらに、術後の眼瞼外反が典型的なKCN患者よりも人生の遅い時期に起こる可能性があることを考えると、眼瞼外反が典型的にいつ起こり、いつ進行が遅くなるかという年齢範囲は、臨床的合意によって定義されてはいない。 したがって、臨床医は年齢をCXL候補の絶対的な禁忌として用いることは控えるべきである。
一般的なCXL術後所見と期待されることは何ですか?
標準的なCXLからの回復の初期段階は、角膜上皮の除去を伴う他の処置とほぼ同様である。 BCLは治療上の保護と患者の快適さを向上させるが、ほとんどの患者は上皮欠損が閉じるまで何らかの眼球の不快感や痛みを経験し、それは通常3~5日で起こる24。 3ヶ月目から6ヶ月目、または6ヶ月目から12ヶ月目の間に視力の軽度の改善を経験することがある。 10-12
標準的なCXL後、ケラトメトリー、パチメトリー、および一過性のCXLヘイズ測定も同様の時間パターンに従っており、最初の1ヶ月は角膜の透明度がさらに急勾配、薄化、および低下する。 これらの傾向は、通常、次の2ヶ月間で逆転し、その時点で患者はゆっくりとベースラインの特性に戻る。 時には、これらの患者は、安定化のプラトーに到達する前に、軽度の改善を経験することさえある(図5)。10-12
これらの術直後の傾向を、KCN疾患の悪化やCXLの失敗と誤解しないようにすることが重要である。 全体として、エピオフCXLプロトコルにもかかわらず、患者が視覚的障害を感じる可能性があるのは、術後直後の回復期のわずかな期間だけである。 これは、患者がCXL後の安定に達する前にコンタクトレンズを再装着するか、コンタクトレンズの装用を再開することができるためである。
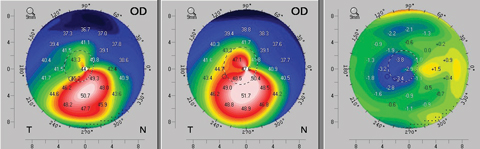
図5. 標準的な(エピオフ)角膜クロスリンキングプロトコル後3ヶ月という早い時期に見られるトポグラフィーの平坦化の一例。 左の地図は、患者の術前の軸方向のトポグラフィーを示す。 中央のマップは3ヶ月目の術後トポグラフィーで、右のマップは3ヶ月目のトポグラフィーの改善を示す差分計算を提供します。 画像をクリックすると拡大します。
CXL患者は屈折率の変化を期待できますか?
研究では、CXL治療後12ヶ月における球、円柱、球面等価の結果がさまざまであると報告されています。 25-27 研究者は、高次収差、球面収差、コマの改善と、平均1.6Dの位相平坦化を報告しています10,28。
したがって、現在利用可能なCXLプロトコルの主な目的は、KCNの安定化であり続けるべきである。 CXLを推奨する前に、CXL後もコンタクトレンズまたは眼鏡が必要であることを患者に伝えるべきである。この管理方法は、KCNが未治療のままである場合に頻繁に起こる眼鏡交換に伴うフラストレーションを軽減し、患者のQOLを向上させる可能性がある。
CXLのヘイズは懸念されますか?
一過性のCXLヘイズは、PRK後の角膜ヘイズに似ているように見えることがあります。 しかし、経験を積めば、スリットランプ下でこの2つの存在を区別することができます。 CXLヘイズは、前方から中間の間質レベルに塵のような組織変化を生じさせるが、PRKヘイズは、上皮下から前方の間質層に局在する網状の線維性増殖パターンで現れる。 24
CXL治療直後には、共焦点顕微鏡で前方から中間の間質領域に角化細胞のアポトーシスとラクナ水腫が確認されます。 24
最初の6~8週間はグレア障害の可能性があるが、一過性のCXLヘイズと境界線の深さは、治療の浸透とそれに伴う間質のコラーゲン再構築を反映する指標としてしばしば使用される。 角層細胞が徐々に再増殖するにつれて、光の後方散乱が解消され始め、CXLヘイズの領域は3~6ヶ月の間に薄くなり始める。 CXL後1年目には、霞が目立たなくなることが多い。 ステロイド外用剤は術後数週間で中止されることが多いが,CXLヘイズのほとんどの症例は,それ以上の治療介入をしなくても時間とともに自己回復する。したがって,研究者は,ステロイド外用剤はCXLヘイズを軽減せず,通常のCXL後にその長期使用は必要ないとしている。 しかし、ある研究では、1年後に持続的なヘイズまたは間質の瘢痕化が観察された場合、ステロイドの局所投与が正当化される可能性があると提案している。 CXLとIntacs角膜インプラントの適応外治療を受けた患者(AJL Ophthalmic)の視標断面で分界線を可視化している。
上皮を除去せずにCXLを実施できるか
通常のエピオフCXLは侵襲が少なく、KCN進行を停止させる効果が非常に高い。 10-13しかし、研究者は、処置中および処置後の快適性を高め、視力回復時間を短縮し、潜在的な感染のリスクを低減するための送達方法を研究し続けている。
上皮をそのままにしておくと、CXL中の光化学反応に不可欠なリボフラビン、紫外線および酸素の拡散速度が低下します。 研究者たちは、塩化ベンザルコニウム(BAK)やエチレンジアミン四酢酸(EDTA)などの化学増強剤でタイトジャンクションを破壊することにより、上皮のバリア機能を回避することに成功した。 これらの角膜エンハンサーは、リボフラビン溶液に配合され、角膜間質への浸透を補助する。 30,31
いくつかの研究でTE-CXLによる高い退縮率が報告されているが、その有害事象の発生率も標準的なエピオフCXLより低い。 さらに、ベースラインで角膜が薄い眼では、より浅いCXL治療の深さが有利になる可能性がある。 24,30,31
TE-CXLの有効性が改善されるまで、進行の可能性が高い、または臨床的に積極的に進行しているKCN患者には、引き続き標準のエピオフCXLを推奨していきます。
12. CXL後、いつコンタクトレンズを再装着すればよいですか?
共焦点顕微鏡を用いた研究では、標準的なCXL後3~6ヶ月の間に上皮の厚みが徐々に正常に戻ることが示されている。24 しかし、多くの患者は機能するためにコンタクトレンズのリハビリテーションを必要とし、コンタクトレンズ装着再開までに6ヶ月待つことはできない。
私たちの個人的なアプローチは、上皮の治癒の遅れや上皮のリモデリングの崩壊によりヘイズが持続する可能性を考慮し、レンズ後面と角膜上皮の間の相互作用を最小限または全く許容するレンズ装着戦略を採用することである。 ハイブリッドレンズ、強膜レンズ、ピギーバックレンズ、さらにはカスタムソフトレンズなど、角膜アーチ型のレンズを含む様々なレンズ設計がこの目標を達成するのに役立ちます。 臨床経験から、レンズの再装着を検討する理想的な時期は、標準的なCXL後約4~6週間、またはTE-CXL後2週間であることがわかっています。 また、特に標準的なCXLを行った後は、今後6~12ヶ月の間にコンタクトレンズの屈折矯正を頻繁に行うことが予想されることを患者に強調することが賢明です。
CXLの出現により、KCN管理の新時代が到来し、臨床家はもはや受動的な反応管理アプローチをとる必要はなく、患者にコンタクトレンズと角膜移植のどちらかを選択させるだけでよいことになった。 適切な候補者に対する早期のCXL介入とCXL後の継続的なモニタリングにより、臨床家は患者が最高の視機能を維持し、角膜移植の必要性を最大限に延期することができる。 今日の臨床では、KCNの進行に伴ってコンタクトレンズを再装着することだけに焦点を当てるべきではありません。 KCNの早期発見、CXLへのアクセス、そして特殊なレンズデザインの進歩により、臨床家はKCN患者が人生を最大限に楽しむことができるようサポートすることができるのです。
チャン博士は、ウィルズ眼科病院角膜サービスの角膜専門レンズのディレクターであり、TLCビジョンの臨床サービスのディレクターです。 彼は、国際円錐角膜アカデミー、ガス透過性レンズ研究所、オプトメトリック角膜・白内障・屈折矯正協会の顧問委員会メンバーでもあります。 彼は、いくつかの本、多数の本の章、および175以上の査読された記事を出版しており、「The Wills Eye Manual」の共著者でもあります。 Godefrooij DA, Gans R, Imhof SM, Wisse RP. クロスリンキングの導入後、円錐角膜のための角膜移植の数が全国的に減少した。 Acta Ophthalmol. 2016;94(7):675-8.
2. Davidson AE, Hayes S, Hardcastle AJ, et al. 円錐角膜の発症機序. Eye (Lond). 2014;28(2):189-95.
3. Tuft SJ, Moodaley LC, Gregory WM, et al. 円錐角膜の進行に関する予後因子. Ophthalmology. このような状況下で、「円錐角膜の進行に関する予後因子」を調査したところ、「円錐角膜の進行に関する予後因子」は、「円錐角膜の進行に関する予後因子」と「円錐角膜の進行に関する予後因子」の2つに分類された。 Am J Ophthalmol. 2006;142(6):923-30.
5. Kymes SM, Walline JJ, Zadnik K, Gordon MO. 円錐角膜におけるQOL(クオリティ・オブ・ライフ)。 Am J Ophthalmol. 2004;138(4):527-35.
6. Kymes SM, Walline JJ, Zadnik K, et al. 円錐角膜を持つ人々のQOLの変化. Am J Ophthalmol. Godefrooij DA, de Wit GA, Uiterwaal CS, et al. 円錐角膜の年齢別発生率と有病率:全国登録調査。 Am J Ophthalmol. 2017;175:169-72.
8. Wollensak G, Spoerl E, Seiler T. Riboflavin/ultraviolet-a-induced collagen crosslinking for the treatment of keratoconus.「円錐角膜の治療におけるリボフラビン/ウルトラバイオレット-a誘発コラーゲンクロスリンキング」. Am J Ophthalmol 2003;135(5):620-7.
9. Schumacher S, Mrochen M, Wernli J, et al. UV-riboflavin corneal cross-linkingのための最適化モデル。 インベスト・オフタルモール・ヴィス・サイエンス(Invest Ophthalmol Vis Sci.) 2012;53(2):762-9.
10. チャンCY、ハーシュPS. 角膜コラーゲンクロスリンキング:1年成績のレビュー。 アイ・コンタクト・レンズ。 2014;40(6):345-52.
11. Hersh PS, Stulting RD, Muller D, et al. 角膜コラーゲンクロスリンキングによる円錐角膜治療の米国多施設臨床試験. Ophthalmology. 2017;124(9):1259-70.
12. Hersh PS, Stulting RD, Muller D, et al. 屈折矯正手術後の角膜外反の治療に対する角膜コラーゲンクロスリンキングの米国多施設共同臨床試験. Ophthalmology. 2017;124(10):1475-84.
13. Raiskup F, Theuring A, Pillunat LE, Spoerl E. 進行性円錐角膜におけるリボフラビンおよび紫外線a光による角膜コラーゲンクロスリンキング:10年間の結果。 J Cataract Refract Surg. 2015;41(1):41-6.
14. Spoerl E, Mrochen M, Sliney D, Trokel S, Seiler T. 角膜のUVA-リボフラビンクロスリンキングの安全性. Cornea. 2007 May;26(4):385-9.
15. Schumacher S, Mrochen M, Wernli J, et al. UV-リボフラビン角膜クロスリンキングの最適化モデル。 インベスト・オフタルモル・ビス・サイエンス(2012;53(2):762-9.
16. Bottós KM, Schor P, Dreyfuss JL, et al. 紫外線とリボフラビンの吸収に対する角膜上皮の影響. Arq Bras Oftalmol. 2011;74(5):348-51.
17. Richoz O, Hammer A, Tabibian D, et al. リボフラビンとUV-Aによる角膜コラーゲン架橋(CXL)のバイオメカニカル効果は、酸素依存性である。 Transl Vis Sci Technol. 2013;2(7):6.
18. Padmanabhan P, Rachapalle Reddi S, Rajagopal R, et al. 小児患者の円錐角膜に対する角膜コラーゲンクロスリンキング-長期結果. Cornea. 2017;36(2):138-43.
19. Naderan M, Jahanrad A. 円錐角膜患者の妊娠中のトポグラフィー、トモグラフィー、バイオメカニカルコーンの変化: コホート研究. Acta Ophthalmol. 2017;95(4):e291-e296.
20. Sandvik GF, Thorsrud A, Råen M, et al. 角膜コラーゲンクロスリンキングは円錐角膜患者における角膜移植の必要性を減少させるか? Cornea. 2015;34(9):991-5.
21. Gomes JA, Tan D, Rapuano CJ, et al. 円錐角膜と外耳道疾患に関するグローバルコンセンサス. Cornea. 2015;34(4):359-69.
22. Nordström M, Schiller M, Fredriksson A, Behndig A. 円錐角膜に対するトポグラフィー誘導角膜クロスリンキングによる屈折改善と安全性:1年結果.Nordström M, Schiller M, Fredriksson A, Behndig A. Br J Ophthalmol. 2017;101(7):920-5.
23. Yildiz EH, Diehl GF, Cohen EJ, et al. 50歳以上の円錐角膜患者の人口統計学. Eye Contact Lens. 2009;35(6):309-11.
24. Mazzotta C, Hafezi F, Kymionis G, et al. 角膜コラーゲンクロスリンキング後のin vivo共焦点顕微鏡検査. Ocul Surf. 2015;13(4):298-314.
25. Cınar Y, Kürs¸at Cingü A, Turkcu FM, et al. Accelerated corneal collagen cross-linking for progressive keratoconus(進行性円錐角膜に対する角膜コラーゲンクロスリンキングの加速)。 Cutan Ocul Toxicol. 2014;33:168-71.
26. カネロプロスAJ. 進行性円錐角膜に対する高フルエンス、短時間紫外線a照射、リボフラビンコラーゲンクロスリンキングの前向き無作為化両目比較試験の長期結果。 Clin Ophthalmol. 2012;6:97-101.
27. 円錐角膜の治療における角膜クロスリンクの最適化:標準プロトコルと高強度プロトコル後の結果の比較。 Cornea. 2016;35(6):814-22.
28. Vinciguerra P, Albè E, Trazza S, et al. 角膜クロスリンキングを受けた角膜症眼の屈折、トポグラフィー、トモグラフィ、アベロメトリックの解析. Ophthalmology. 2009;116(3):369-78.
29. キムBZ、ジョーダンCA、マクギーCN、パテルDV。 Scheimpflug分析を用いた円錐角膜における角膜コラーゲンクロスリンキング後の角膜ヘイズの自然史。 J Cataract Refract Surg. 2016;42(7):1053-9.
30. Wollensak G, Iomdina E. Biomechanical and histological changes after corneal crosslinking with and without epithelial debridement.角膜クロスリンキング後の生体力学的および組織学的変化。 J Cataract Refract Surg. 2009;35(3):540-6.
31. Caporossi A, Mazzotta C, Paradiso AL, et al. 進行性円錐角膜に対する経上皮角膜コラーゲンクロスリンキング:24ヶ月の臨床結果. J Cataract Refract Surg. 2013;39(8):1157-63.
.
