15.4 カルボン酸の物性
学習目標
- カルボン酸と類似モル質量のアルコールの沸点を比較できる。
- カルボン酸の水への溶解度を、同程度のアルカンやアルコールの水への溶解度と比較する。
多くのカルボン酸は無色の液体で嫌なにおいがある。 炭素原子数5~10のカルボン酸は、いずれも「山羊臭」がします(リンブルガーチーズの臭いを説明します)。 また、これらの酸は、人間の皮脂(スキンオイル)に皮膚細菌が作用することによっても生成されるため、換気の悪いロッカールームの臭いの原因ともなっている。 炭素原子数10以上の酸はワックス状の固体であり、モル質量の増加や揮発性の低下により臭いが弱くなる。
カルボキシル基は、水分子と容易に水素結合します(図15.3「酢酸分子と水分子の水素結合」)。 炭素原子数1~4の酸は、水と完全に混和する。 炭素鎖長が長くなると、双極子力の重要性が低下し、分散力が優位になるため、溶解度は低下する。 ヘキサン酸は水にほとんど溶けない(水100gあたり約1.0g)。 パルミチン酸は非極性炭化水素成分が多く、水には基本的に溶けない。 カルボン酸は一般にエタノール、トルエン、ジエチルエーテルなどの有機溶媒に可溶である。3 酢酸分子と水分子との水素結合
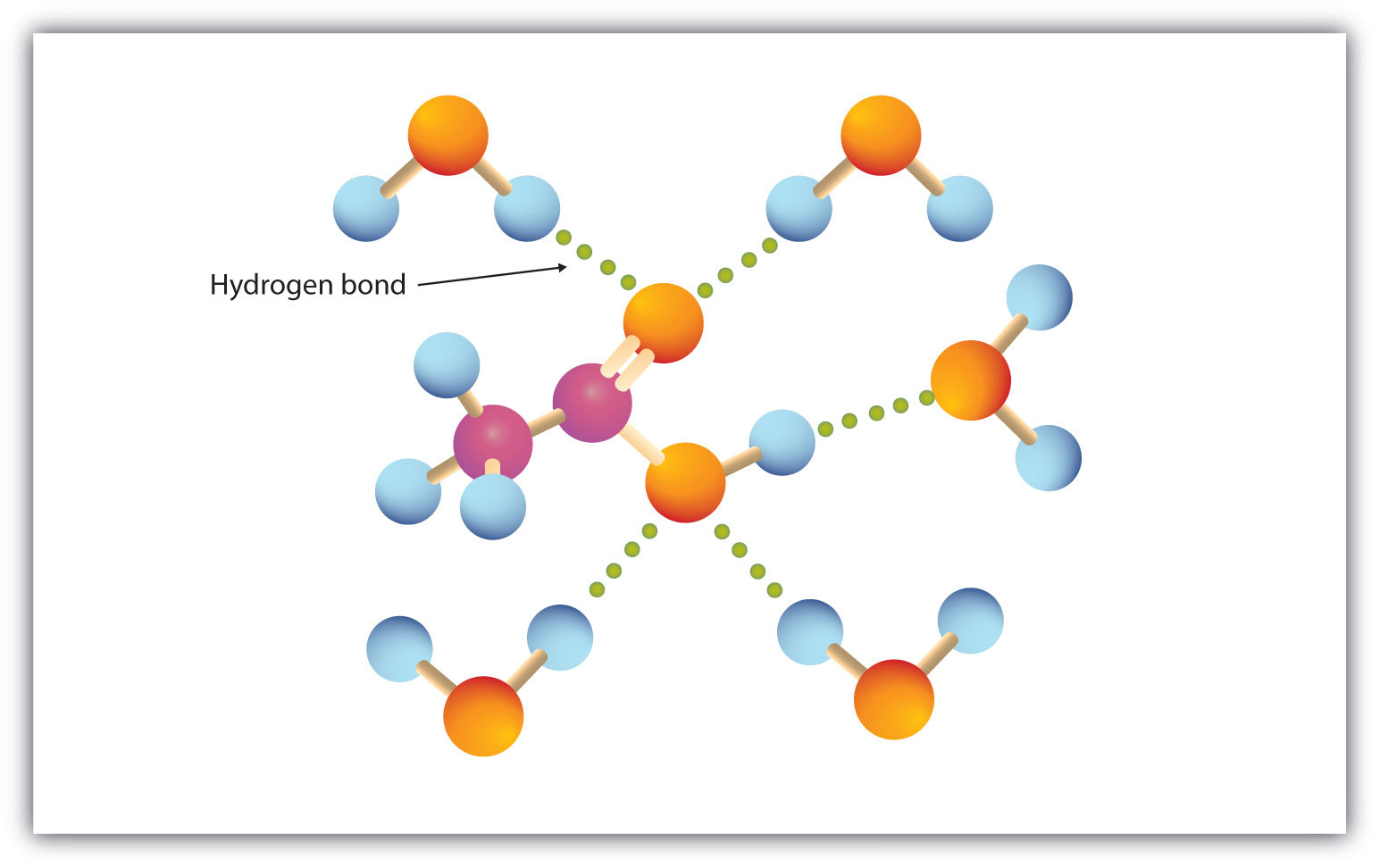
モル質量の小さいカルボン酸は水によく溶ける
表15.2「カルボン酸の物理定数」は、カルボン酸の物性をいくつか挙げたものである。 最初の6つは同族体です。 沸点はモル質量の増加とともに上昇しますが、融点は規則的なパターンを示さないことに注意してください。2 カルボン酸の物理定数
| 縮合構造式 | 酸の名称 | |||
|---|---|---|---|---|
| HCOOH | ギ酸 | 8 | 100 | miscible |
| CH3COOH | 酢酸 | 17 | 118 | 混和性 |
| CH3CH2COOH | プロピオン酸 | -22 | 141 | 混和性 |
| CH3(CH2)2COOH | 酪酸 | -5 | 163 | miscible |
| CH3(CH2)3COOH | 吉草酸 | -35 | 187 | 5 |
| CH3(CH2)4COOH | カプロ酸 | -3 | 205 | |
| C6H5COOH | 安息香酸 | 122 | 249 | 0.29 |
コンセプトレビュー演習
-
沸点の高い化合物はブタン酸(モル質量88)と2-ペンタノン(同86)のどちらか? 説明せよ。
-
酪酸(ブタン酸)は1-ブタノールより水に溶けやすいと思うか、溶けにくいと思うかは、どちらでしょうか? 説明せよ。
回答
-
酪酸は水素結合があるから(2-ペンタノンには分子間水素結合はない。)
-
より広範な水素結合があるため、より溶解する
キーポイント
- Carboxylic acids have high boiling points compared to other substances of comparable molar mass. 沸点はモル質量と増加します。
- 1〜4個の炭素原子を持つカルボン酸は、水と完全に混和性である。
演習
-
CH3CH2CH2OCH2CH3とCH3CH2CH2COOHではどちらの化合物が沸点が高いでしょうか? Explain.
-
CH3CH2CH2CH2OH とCH3CH2CH2COOHではどちらの化合物の方が沸点が高いですか? 説明する。
-
水に溶ける化合物はCH3COOHとCH3CH2CH2CH3のどちらか? Explain.
-
水に溶ける化合物はCH3CH2COOHとCH3CH2CH2COOHのどちらですか。 説明せよ。
答え
-
CH3CH2CH2COOHは水素結合があるから(CH3CH2OCH2CH3とは分子間水素結合はない。)
-
CH3COOH 水と水素結合をするから (CH3CH2CH2CH3 と分子間水素結合はない。)
