- Rapport annuel sur la cornée
- Qu’est-ce que le CXL et comment fonctionne-t-il ?
- Quel est le rôle de la riboflavine pendant le CXL ?
- Quel est le but de l’élimination de l’épithélium dans le protocole CXL standard ?
- Comment se déroule le protocole standard du CXL ?
- Quelles sont les recommandations pour la sélection des patients ?
- La progression du KCN est-elle nécessaire pour recommander le CXL ?
- Dois-je envisager le CXL pour les patients de plus de 40 ans ?
- Quels sont les résultats postopératoires généraux du CXL et les attentes ?
- Les patients traités par CXL peuvent-ils s’attendre à des changements de réfraction ?
- La brume du CXL est-elle une préoccupation ?
- Pouvez-vous réaliser un CXL sans enlever l’épithélium ?
- 12. Quand dois-je réadapter des lentilles de contact après un CXL ?
Rapport annuel sur la cornée
Suivez les liens ci-dessous pour lire d’autres articles de notre rapport annuel sur la cornée :
Guide d’un DO sur les options de transplantation cornéenne
Fixer un trou : Comment guérir les défauts épithéliaux persistants
Alerte aux intrus : diagnostic de la maladie cornéenne infiltrante
Pour de nombreux fournisseurs de soins oculaires et patients, la gestion du kératocône (KCN) peut ressembler au maintien d’un statu quo indésirable. Grâce aux progrès des technologies de lentilles de contact spécialisées, les greffes de cornée ne sont désormais nécessaires que pour 10 à 20 % des patients atteints de kératocône.1 Néanmoins, ces patients obtiennent toujours des résultats similaires à ceux des patients atteints de dégénérescence maculaire avancée dans le questionnaire sur la fonction visuelle du National Eye Institute dans l’étude CLEK (Collaborative Longitudinal Evaluation of Keratoconus Study).2-5 Un autre rapport du même groupe a révélé que les scores de qualité de vie auto-perçue des patients atteints de kératocône continuent de baisser avec le temps.6 Avec une prévalence postulée du KCN atteignant un individu sur 375, la stabilisation de la maladie et l’amélioration ou le maintien de la qualité de vie sont des priorités absolues.7
Depuis son développement en 2003, le crosslinking cornéen (CXL) est rapidement devenu le traitement de choix pour contrôler la progression du KCN.8 Bien que le CXL n’ait reçu l’approbation de la Food and Drug Administration (FDA) américaine qu’en 2016 (système KXL d’Avedro et deux photoréalisateurs, Photrexa et Photrexa visqueux), nous avons pu proposer des traitements CXL aux patients depuis de nombreuses années au Wills Eye Hospital sous les auspices d’essais cliniques. Comme pour toute nouvelle procédure de traitement, il existe une courbe d’apprentissage pour les cliniciens qui doivent affiner l’éducation et le processus de sélection des patients, ainsi que d’autres protocoles liés à la gestion péri-opératoire. Un canal de communication ouvert permet à notre Service Cornéen d’aider les cliniciens en comanaging à acquérir un confort clinique avec le CXL dans leurs pratiques KCN. Voici 12 questions courantes posées par nos médecins partenaires ; les réponses peuvent vous aider à décider de la meilleure façon d’éduquer vos patients KCN sur le CXL.
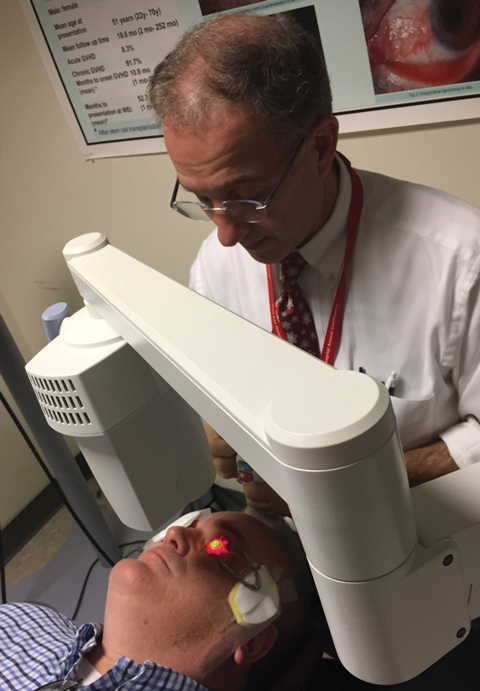
Fig. 1. Christopher Rapuano, MD, effectue un protocole standard de réticulation cornéenne avec le système KXL approuvé par la FDA.
Qu’est-ce que le CXL et comment fonctionne-t-il ?
La réticulation est un processus de polymérisation qui réarrange les monomères en un réseau tridimensionnel de polymères pour augmenter la solidité d’une structure moléculaire. Ce processus se produit naturellement dans notre corps lorsque les tissus conjonctifs se raidissent progressivement avec le temps. Facilitées par l’enzyme endogène lysyl oxydase dans le lancement des réactions oxydatives requises, des liaisons covalentes supplémentaires (ou « réticulations » tissulaires) sont formées entre et au sein des fibrilles de collagène – donnant lieu à une augmentation de la résistance biomécanique des tissus.9
Typiquement, les effets cumulatifs des réactions de réticulation naturelles sont lents à se manifester. À la fin des années 1990, des chercheurs de l’université de Dresde en Allemagne ont déterminé que le processus d’induction photochimique était la méthode la plus viable cliniquement pour stimuler l’induction de réticulations dans la cornée, ce qui a donné naissance au CXL.8 Cette étude a utilisé de la riboflavine à 0,1 % (avec 20 % de dextran en solution) comme photosensibilisateur pour absorber une dose d’énergie ultraviolette (UV) soigneusement calibrée, convertissant ainsi l’oxygène tissulaire disponible en molécules d’oxygène singulet. Les espèces réactives de l’oxygène résultantes possèdent suffisamment d’énergie pour activer la voie enzymatique de la lysyl oxydase, conduisant à la formation de nouvelles liaisons covalentes au sein du stroma cornéen.
L’étude de Dresde a rapporté que l’ensemble des 23 yeux à KCN progressif traités étaient stabilisés, 70% présentant un aplatissement kératométrique maximal de 2,01D. Depuis, de nombreuses études ont obtenu une efficacité similaire avec de bons profils de sécurité chez les patients atteints de KCN en utilisant le même protocole CXL impliquant l’ablation de l’épithélium (figure 1).10-13
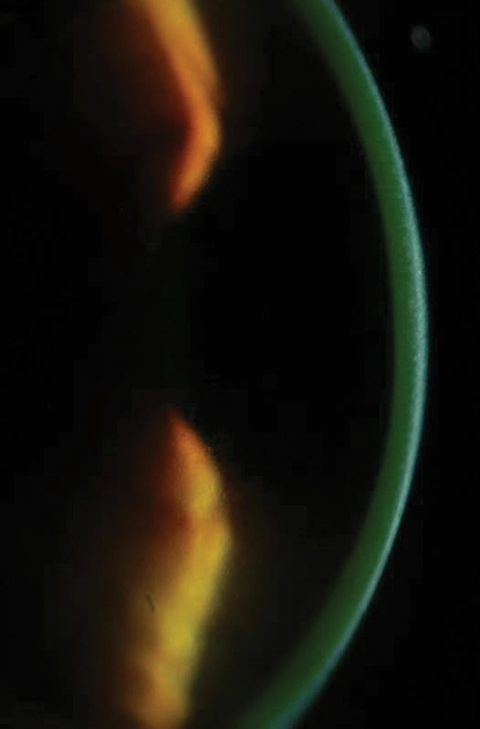
Figures 2a et 2b. En haut, saturation de la riboflavine observée dans le stroma cornéen après chargement en riboflavine. En bas, après 30 minutes de chargement en riboflavine à intervalles de deux minutes, les cliniciens doivent vérifier la coloration de la riboflavine aqueuse. Cliquez sur l’image du bas pour l’agrandir.
Quel est le rôle de la riboflavine pendant le CXL ?
Puisque les molécules d’oxygène biodisponible dans la cornée ne peuvent pas être activées directement par la lumière UV, une substance photosensibilisante doit agir comme agent intermédiaire. La riboflavine catalyse les réactions photochimiques du CXL en transférant l’énergie UV (spécifiquement, les UVA de 365nm à 370nm) aux molécules d’oxygène stromal, convertissant ainsi les molécules d’oxygène stable en une forme singlet plus réactive. Ces espèces d’oxygène réactives initient ensuite des réactions oxydatives intrastromales.
En supposant que l’énergie UV ne soit pas la ressource limitante, un réapprovisionnement continu en oxygène et des molécules de riboflavine actives sont essentiels pour maintenir le transfert d’énergie nécessaire à la perpétuation du processus CXL.
En outre, la saturation de la cornée en riboflavine crée un » effet de bouclier » dans lequel les niveaux d’énergie UV respectifs atteignant l’endothélium, le cristallin et la rétine sont titrés à une intensité beaucoup plus faible que les seuils de dommages cellulaires réels. En fait, si une cornée saturée en riboflavine a une épaisseur d’au moins 400 µm, l’irradiation UV transmise à l’endothélium n’est que de 0,18 mW/cm2, alors que le seuil réel de dommage endothélial est d’environ 0,35 mW/cm2. Par la suite, le niveau d’énergie projeté pour atteindre le cristallin et la rétine est encore plus faible par rapport aux seuils de dommages respectifs de ces couches tissulaires.14,15
Quel est le but de l’élimination de l’épithélium dans le protocole CXL standard ?
La nature lipophile de l’épithélium cornéen et la petite taille des pores de ses jonctions serrées rendent cette couche essentiellement imperméable aux molécules de riboflavine. Ces caractéristiques de barrière épithéliale empêchent une saturation efficace et homogène de la riboflavine dans le tissu stromal ciblé.16
L’épithélium contient également des enzymes aux propriétés antioxydantes élevées, comme l’ascorbate et les résidus de tryptophane, qui peuvent empêcher la pénétration des UV et piéger les espèces réactives de l’oxygène. De plus, la présence d’une barrière épithéliale ralentit le taux de renouvellement de l’oxygène pendant les procédures de CXL, réduisant ainsi la quantité totale de nouvelles liaisons transversales cellulaires qui peuvent être créées. Par conséquent, lorsque le même protocole CXL standard est réalisé avec une surface cornéenne intacte, l’efficacité globale de la procédure sera plus faible que prévu. D’autre part, en raison de la saturation non homogène en riboflavine et de la réduction des effets de protection de la riboflavine, les transmissions UV délivrées à l’endothélium et aux tissus oculaires plus profonds peuvent être plus élevées que celles calculées précédemment.16,17
Les cliniciens ne doivent pas supposer que le CXL n’est efficace que lorsqu’il est accompagné d’un débridement épithélial. Bien que les applications du CXL transépithélial (TE-CXL) ne soient pas actuellement approuvées par la FDA, des techniques de traitement modifiées sont à l’étude pour améliorer l’efficacité du TE-CXL.
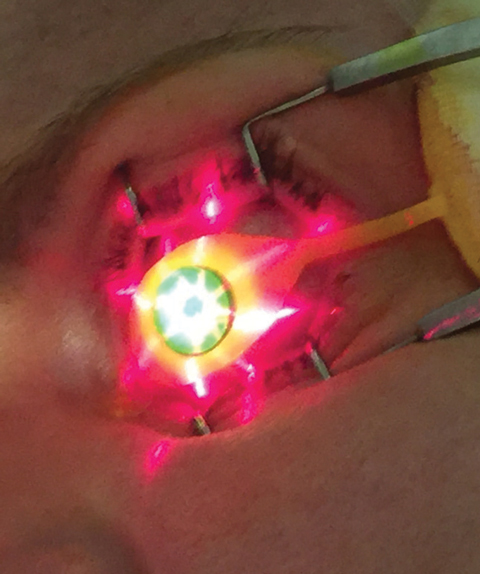
Fig. 3. Le guidage par réticule est projeté à partir du dispositif KXL sur le site de traitement.
Comment se déroule le protocole standard du CXL ?
Une anesthésie topique est utilisée lors de l’ablation des 9 mm centraux d’épithélium pour assurer le confort du patient et permettre une saturation stromale plus rapide et plus homogène de Photrexa visqueux (riboflavine 5′-phosphate dans une solution ophtalmique dextran à 20%) pendant le CXL. Cette phase dure 30 minutes avec instillation de riboflavine à intervalles de deux minutes.10
Après 30 minutes, les patients sont examinés sous la lampe à fente pour s’assurer que la riboflavine a saturé la zone de traitement prévue et qu’elle est présente dans l’aqueux (figures 2a et 2b). Conformément aux indications approuvées par la FDA, les cliniciens doivent effectuer une pachymétrie après l’application de riboflavine pour s’assurer que l’épaisseur de la cornée est d’au moins 400µm. Si elle est inférieure à 400µm, la riboflavine hypotonique Photrexa doit être administrée toutes les cinq à dix secondes jusqu’à ce que la cornée soit réhydratée à 400µm ou plus10.
Une fois que le niveau de pachymétrie approprié est vérifié, les cliniciens utilisent le dispositif UV KXL (Avedro) pour la deuxième phase du traitement CXL, où 30 minutes d’irradiation UV (3mW/cm2) donnent une dose d’énergie totale de 5,4J/cm2.8 Pendant la période d’émission UV, Photrexa visqueux est instillé à intervalles de deux minutes tandis que l’opérateur maintient une centration et une distance dispositif-œil appropriées. La position correcte du dispositif KXL peut être guidée par les projections d’images en croix (figure 3), qui aident à délivrer un profil de faisceau d’illumination optimal sur la cornée traitée.
L’excès de riboflavine peut être rincé avec une solution saline équilibrée à la fin d’une session de traitement. Une lentille de contact à pansement (BCL) est insérée après l’instillation d’agents antibiotiques et corticostéroïdes topiques. Le BCL doit être maintenu sur l’œil traité pendant trois à cinq jours ou jusqu’à la fermeture épithéliale (figures 4a et 4b).
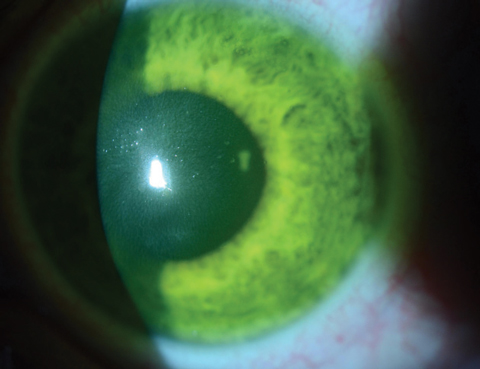
Fig. 4a. Ici, une lentille de contact souple bandée est sur l’œil immédiatement après le traitement CXL sur un patient où la saturation cornéenne en riboflavine est encore évidente.
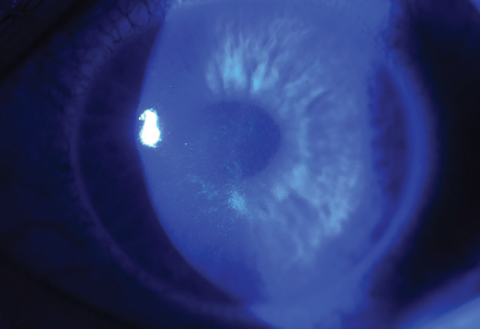
Fig. 4b. La fermeture de la plaie épithéliale est presque complète sur le même patient seulement trois jours après le traitement par CXL.
Quelles sont les recommandations pour la sélection des patients ?
En 2016, le protocole standard du CXL a reçu des indications labellisées aux États-Unis pour traiter les patients âgés de 14 ans ou plus présentant un KCN progressif ou une ectasie cornéenne après des chirurgies réfractives. Cependant, en l’absence de traitement, on sait que la gravité et le taux de progression de la maladie sont plus agressifs chez les patients plus jeunes. Par conséquent, le système KXL et Photrexa/Photrexa visqueux peuvent être envisagés pour une utilisation hors AMM chez les jeunes patients dont l’épaisseur cornéenne minimale est de 400 µm ou plus. Des essais cliniques ont fait état de patients atteints de KCN âgés de huit ans seulement, mais des consentements éclairés spéciaux doivent être obtenus des patients et de leurs tuteurs dans ces cas.18
Bien que la FDA n’ait pas spécifié de contre-indications, les cliniciens doivent faire preuve de jugement avant de proposer le CXL aux mères allaitantes et aux patients âgés de plus de 65 ans. De même, les chercheurs recommandent vivement d’éviter le CXL au cours d’une grossesse. Une étude récente a trouvé des preuves topographiques, pachymétriques et biomécaniques de la progression du KCN chez 100% de sa cohorte de patientes enceintes.19 Cela a conduit les chercheurs à recommander de discuter du CXL prophylactique avec les patientes avant le planning familial. Certains pays européens ont commencé à proposer de manière proactive le CXL aux patientes atteintes de KCN qui prévoient une grossesse malgré l’absence de progression de la maladie.20
La progression du KCN est-elle nécessaire pour recommander le CXL ?
Bien que la progression du KCN fasse partie de l’indication sur étiquette du traitement CXL, certaines circonstances ne nécessitent pas de progression avant une consultation CXL. Les patientes atteintes de KCN qui prévoient une grossesse et les patients présentant un risque élevé de progression ne sont que deux exemples cliniques potentiels.19,21
Selon le modèle de soins conventionnel du KCN, un certain nombre de changements significatifs dans les paramètres cliniques doivent se manifester avant d’initier un nouveau traitement. Cependant, une progression significative se produit fréquemment avant que des mesures soient prises en raison de l’absence de consensus sur l’indicateur clinique exact et l’ampleur correspondante du changement qui constitue la progression de la maladie. De nombreuses études CXL définissent la progression du KCN comme des changements sur une période de 12 mois dans l’une des mesures suivantes : 1D ou plus dans la kératométrie maximale ; 0,5D ou plus dans la myopie ; 1D ou plus dans l’astigmatisme ; ou 10µm ou plus de perte dans le point pachymétrique le plus fin.10-12,20,22 Cependant, avec la précision limitée des topographes traditionnels lors de l’imagerie de la surface cornéenne irrégulière et la variabilité réfractive des patients KCN, ces directives peuvent entraîner un taux plus élevé de faux positifs.
Alternativement, un groupe d’experts a récemment recommandé que la présence d’au moins deux des trois critères puisse établir une progression : raideur de la courbure cornéenne antérieure ; raideur de la courbure cornéenne postérieure ; ou amincissement lors de la comparaison du profil de distribution pachymétrique de la périphérie au point le plus fin.21 Bien qu’utiles, ces directives nécessitent l’accès à une tomographie cornéenne capable de suivre les changements au fil du temps, ce qui présente un défi possible pour certains cliniciens de comanage.
Compte tenu de ces obstacles cliniques, le groupe d’experts réuni par quatre sociétés supranationales de cornée a conclu que des recommandations de CXL peuvent être faites aux patients atteints de KCN présentant des profils à haut risque, même si la progression n’a pas été documentée.21
Dois-je envisager le CXL pour les patients de plus de 40 ans ?
La réponse courte est oui. Les patients atteints de KCN ont tendance à afficher un taux de progression plus lent ou même une stabilisation dans leur quatrième ou cinquième décennie de vie – probablement un sous-produit de la réticulation associée à l’âge. Cependant, l’expression du KCN est très variable, et l’âge seul n’est pas toujours un point final bien défini pour le KCN. Un examen rétrospectif des dossiers du Wills Eye Hospital a révélé que 24 % des 186 yeux nouvellement diagnostiqués avec le KCN appartenaient à des patients âgés de 40 ans ou plus.23
En outre, étant donné que l’ectasie post-chirurgicale peut survenir à un moment plus tardif de la vie qu’un patient typique du KCN, le consensus clinique n’a pas défini une tranche d’âge pour le moment où l’ectasie survient typiquement et où la progression peut ralentir. Ainsi, les cliniciens doivent s’abstenir d’utiliser l’âge comme une contre-indication absolue à la candidature au CXL.
Quels sont les résultats postopératoires généraux du CXL et les attentes ?
La phase initiale de récupération après un CXL standard ressemble beaucoup à toute procédure impliquant un retrait de l’épithélium cornéen. Bien que les BCL offrent une protection thérapeutique et un confort accru pour le patient, la plupart des patients ressentent encore une certaine gêne ou douleur oculaire jusqu’à la fermeture du défaut épithélial, qui se produit généralement en trois à cinq jours.24
Après la fermeture de l’épithélium, l’acuité visuelle se dégrade généralement ou fluctue fortement tout au long du premier mois avant de revenir lentement à la ligne de base au troisième mois. Les patients peuvent connaître une légère amélioration de leur vision entre le troisième et le sixième mois ou entre le sixième et le douzième mois. De plus, une tendance à la stabilisation émerge généralement comme nouvelle ligne de base entre les mois six et 12.10-12
Après un CXL standard, les mesures de kératométrie, de pachymétrie et de voile transitoire du CXL suivent également un schéma temporel similaire, avec une accentuation de la pente, un amincissement et une réduction de la transparence cornéenne au cours du premier mois. Ces tendances s’inversent généralement au cours des deux mois suivants, après quoi les patients retrouvent lentement leurs caractéristiques de base. Parfois, ces patients connaissent même de légères améliorations avant d’atteindre un plateau de stabilisation (figure 5).10-12
Il est important de ne pas interpréter à tort ces tendances postopératoires immédiates comme une aggravation de la maladie du KCN ou un échec du CXL. Dans l’ensemble, malgré un protocole CXL épi-off, il n’existe qu’une courte période pendant la récupération postopératoire immédiate où les patients peuvent se sentir visuellement compromis. Ceci est dû au fait que les patients sont réadaptés en lentilles de contact ou peuvent reprendre le port de lentilles de contact avant d’atteindre la stabilisation post-CXL.
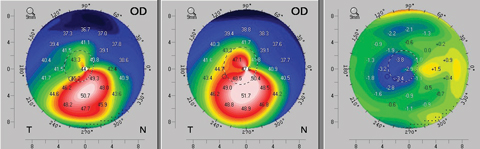
Fig. 5. Un exemple d’aplatissement topographique observé dès trois mois après le protocole standard (épi-off) de réticulation cornéenne. La carte de gauche montre la topographie axiale préopératoire du patient. La carte centrale est la topographie postopératoire au troisième mois, et la carte de droite fournit un calcul de différence révélant l’amélioration topographique au troisième mois. Cliquez sur l’image pour l’agrandir.
Les patients traités par CXL peuvent-ils s’attendre à des changements de réfraction ?
Des études ont rapporté des résultats variables pour la sphère, le cylindre et l’équivalent sphérique 12 mois après le traitement par CXL. Certaines montrent des changements réfractifs statistiquement significatifs, tandis que d’autres n’ont enregistré aucune différence notable.25-27 Les chercheurs ont signalé des améliorations de l’aberration totale d’ordre supérieur, de l’aberration sphérique et du coma, ainsi qu’un aplatissement topographique moyen de 1,6D.10,28 Pourtant, la littérature ne fournit aucune corrélation cohérente entre les changements de ces paramètres cliniques et le traitement CXL.
En conséquence, la stabilisation du KCN doit rester l’objectif principal des protocoles CXL actuellement disponibles. Avant de recommander le CXL, les patients doivent être informés que des lentilles de contact ou des lunettes seront toujours nécessaires après le CXL, et cette approche de gestion peut améliorer la qualité de vie des patients en réduisant la frustration souvent associée aux changements optiques fréquents lorsque le KCN n’est pas traité.
La brume du CXL est-elle une préoccupation ?
Un haze CXL transitoire peut sembler similaire à un haze cornéen post-PRK. Avec l’expérience, cependant, les cliniciens peuvent différencier les deux entités sous la lampe à fente. Le voile du CXL crée un changement tissulaire semblable à de la poussière dans les niveaux stromaux antérieurs et moyens, alors que le voile de la PRK se manifeste par un modèle de prolifération fibreuse réticulée qui est localisé dans les couches stromales sous-épithéliales et antérieures. Étant donné les différentes apparences anatomiques et la nature auto-résolutive du voile CXL, il est peu probable qu’il ait les mêmes implications visuelles que le voile PRK.24
Immédiatement après le traitement CXL, la microscopie confocale révélera une apoptose des kératocytes et un œdème lacunaire dans la zone stromale antérieure à moyenne. Lorsque les zones de voile CXL et d’œdème stromal commencent à s’améliorer à la fin du premier mois, les cliniciens verront des zones de discontinuité optique – ou lignes de démarcation – avec une coupe optique lors de l’examen à la lampe à fente (figure 6).24
Bien que l’incapacité à éblouir soit une possibilité pendant les six à huit premières semaines, le voile CXL transitoire et la profondeur des lignes de démarcation sont souvent utilisés comme indicateurs pour refléter la pénétration du traitement et le remodelage du collagène stromal qui en résulte. À mesure que les kératocytes se repeuplent lentement, la rétrodiffusion de la lumière commence à se résorber et les zones de voile CXL commencent à s’estomper entre trois et six mois. Le voile devient souvent imperceptible un an après le CXL. Les stéroïdes topiques sont souvent interrompus après les premières semaines suivant la procédure, mais la plupart des cas de voile CXL se résorbent d’eux-mêmes avec le temps sans autre intervention thérapeutique ; les chercheurs suggèrent donc que les stéroïdes topiques n’atténuent pas le voile CXL et que leur utilisation à long terme n’est pas nécessaire après un CXL standard. Cependant, une étude a proposé que les stéroïdes topiques puissent être justifiés si un haze persistant ou une cicatrice stromale sont observés après un an.24,29
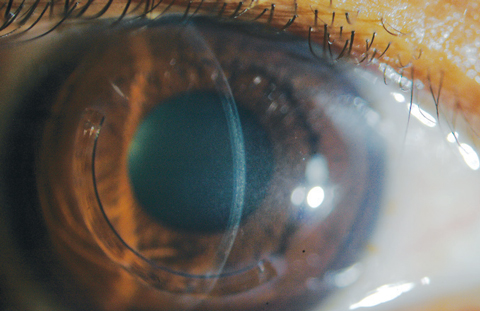
Fig. 6. Les lignes de démarcation sont visualisées avec une coupe optique chez un patient ayant reçu un traitement off-label de CXL et d’implant cornéen Intacs (AJL Ophthalmic).
Pouvez-vous réaliser un CXL sans enlever l’épithélium ?
Le CXL standard épi-off est peu invasif et très efficace pour stopper la progression du KCN. De plus, les effets indésirables sont peu fréquents après un CXL standard.10-13 Cependant, les chercheurs continuent d’étudier les méthodes d’administration pour augmenter le confort pendant et après la procédure, raccourcir le temps de récupération visuelle et réduire les risques d’infection potentielle.
Maintenir l’épithélium intact réduit les taux de diffusion de la riboflavine, de la lumière UV et de l’oxygène, qui sont tous essentiels aux réactions photochimiques pendant le CXL. Les chercheurs ont réussi à contourner la fonction de barrière épithéliale en perturbant les jonctions serrées à l’aide d’exhausteurs chimiques tels que le chlorure de benzalkonium (BAK) et l’acide éthylènediaminetétraacétique (EDTA). Ces activateurs cornéens sont incorporés dans la solution de riboflavine pour faciliter la pénétration dans le stroma cornéen. Cependant, certaines études ont rapporté des lignes de démarcation moins profondes et des effets de raidissement cornéen réduits après le TE-CXL.30,31
Bien que plusieurs études aient rapporté des taux de régression plus élevés avec le TE-CXL, ses taux d’effets indésirables sont également inférieurs à ceux du CXL épi-off standard. De plus, la faible profondeur du traitement CXL peut être avantageuse pour les yeux dont la cornée est plus fine au départ. Les patients présentant un faible risque de progression et ceux qui sont préoccupés par le temps de récupération visuelle peuvent être des candidats raisonnables pour le TE-CXL.24,30,31
Jusqu’à ce que l’efficacité du TE-CXL s’améliore, nous continuerons à recommander le CXL épi-off standard pour les patients atteints de KCN présentant une forte probabilité de progression ou une progression clinique agressive.
12. Quand dois-je réadapter des lentilles de contact après un CXL ?
Une étude utilisant la microscopie confocale a montré que l’épaisseur épithéliale revient progressivement à la normale entre trois et six mois après un CXL standard.24 Cependant, de nombreux patients ont besoin d’une réadaptation des lentilles de contact pour fonctionner et ne peuvent pas attendre six mois avant de reprendre le port de lentilles de contact.
Notre approche personnelle consiste à adopter une stratégie d’adaptation des lentilles qui permet une interaction minimale, voire nulle, entre la surface postérieure de la lentille et l’épithélium cornéen, étant donné la possibilité d’un voile persistant en cas de retard de cicatrisation épithéliale ou de perturbation du remodelage épithélial. Différentes conceptions de lentilles peuvent aider à atteindre cet objectif, y compris celles avec des capacités de voûte cornéenne, telles que les lentilles hybrides, sclérales, piggyback et même les lentilles souples personnalisées. D’après notre expérience clinique, nous avons constaté que le moment idéal pour envisager de réadapter une lentille est environ quatre à six semaines après un CXL standard ou deux semaines après un TE-CXL. Il est également prudent de souligner aux patients, en particulier après un CXL standard, que des modifications fréquentes de la réfraction de leurs lentilles de contact peuvent être attendues au cours des six à douze mois suivants.
L’émergence du CXL a inauguré une nouvelle ère de la gestion du KCN dans laquelle les cliniciens ne doivent plus assumer une approche de gestion réactive passive et ne proposer aux patients qu’un choix forcé entre les lentilles de contact et les greffes de cornée. Avec une intervention CXL précoce pour les candidats appropriés et une surveillance post-CXL continue, les cliniciens peuvent aider les patients à conserver leur meilleure fonction visuelle et à différer au maximum les besoins éventuels de kératoplasties. Aujourd’hui, l’objectif clinique devrait aller au-delà de la simple réadaptation des lentilles de contact au fur et à mesure que le KCN progresse. Grâce à la détection précoce du KCN, à l’accès au CXL et aux progrès réalisés dans la conception de lentilles spécialisées, les cliniciens peuvent aider leurs patients atteints de KCN à vivre pleinement leur vie.
Le Dr Chang est directeur des lentilles de spécialité pour la cornée au Wills Eye Hospital-Cornea Service et directeur des services cliniques chez TLC Vision. Il est membre du conseil consultatif de l’Académie internationale du kératocône, de l’Institut des lentilles perméables au gaz et de l’Optometric Cornea, Cataract and Refractive Society.
Le Dr Rapuano est chef du service de la cornée au Wills Eye Hospital. Il a publié plusieurs livres, de nombreux chapitres de livres et plus de 175 articles évalués par des pairs, notamment en ayant coécrit The Wills Eye Manual.
1. Godefrooij DA, Gans R, Imhof SM, Wisse RP. Réduction à l’échelle nationale du nombre de transplantations de cornée pour le kératocône après la mise en œuvre du cross-linking. Acta Ophthalmol. 2016;94(7):675-8.
2. Davidson AE, Hayes S, Hardcastle AJ, et al. La pathogenèse du kératocône. Eye (Lond). 2014;28(2):189-95.
3. Tuft SJ, Moodaley LC, Gregory WM, et al. Facteurs pronostiques de la progression du kératocône. Ophtalmology. 1994;101(3):439-47.
4. Gordon MO, Steger-May K, Szczotka-Flynn L, et al. Baseline factors predictive of incident penetrating keratoplasty in keratoconus. Am J Ophthalmol. 2006;142(6):923-30.
5. Kymes SM, Walline JJ, Zadnik K, Gordon MO. Quality of life in keratoconus. Am J Ophthalmol. 2004;138(4):527-35.
6. Kymes SM, Walline JJ, Zadnik K, et al. Changes in the quality-of-life of people with keratoconus. Am J Ophthalmol. 2008;145(4):611-7.
7. Godefrooij DA, de Wit GA, Uiterwaal CS, et al. Age-specific incidence and prevalence of keratoconus : a nationwide registration study. Am J Ophthalmol. 2017;175:169-72.
8. Wollensak G, Spoerl E, Seiler T. Riboflavin/ultraviolet-a-induced collagen crosslinking for the treatment of keratoconus. Am J Ophthalmol 2003;135(5):620-7.
9. Schumacher S, Mrochen M, Wernli J, et al. Modèle d’optimisation pour la réticulation cornéenne par UV-riboflavine. Invest Ophthalmol Vis Sci. 2012;53(2):762-9.
10. Chang CY, Hersh PS. Réticulation du collagène cornéen : une revue des résultats à 1 an. Eye Contact Lens. 2014;40(6):345-52.
11. Hersh PS, Stulting RD, Muller D, et al. Essai clinique multicentrique américain du crosslinking du collagène cornéen pour le traitement du kératocône. Ophtalmology. 2017;124(9):1259-70.
12. Hersh PS, Stulting RD, Muller D, et al. Essai clinique multicentrique américain du crosslinking du collagène cornéen pour le traitement de l’ectasie cornéenne après chirurgie réfractive. Ophtalmology. 2017;124(10):1475-84.
13. Raiskup F, Theuring A, Pillunat LE, Spoerl E. Réticulation du collagène cornéen avec la riboflavine et la lumière ultraviolette-a dans le kératocône progressif : résultats à dix ans. J Cataract Refract Surg. 2015;41(1):41-6.
14. Spoerl E, Mrochen M, Sliney D, Trokel S, Seiler T. Sécurité de la réticulation de la cornée par les UVA-riboflavine. Cornea. 2007 May;26(4):385-9.
15. Schumacher S, Mrochen M, Wernli J, et al. Modèle d’optimisation pour la réticulation cornéenne aux UVA-riboflavine. Invest Ophthalmol Vis Sci. 2012;53(2):762-9.
16. Bottós KM, Schor P, Dreyfuss JL, et al. Effet de l’épithélium de la cornée sur l’absorption des ultraviolets-a et de la riboflavine. Arq Bras Oftalmol. 2011;74(5):348-51.
17. Richoz O, Hammer A, Tabibian D, et al. L’effet biomécanique de la réticulation du collagène cornéen (CXL) avec la riboflavine et les UV-A dépend de l’oxygène. Transl Vis Sci Technol. 2013;2(7):6.
18. Padmanabhan P, Rachapalle Reddi S, Rajagopal R, et al. Réticulation du collagène cornéen pour le kératocône chez les patients pédiatriques – résultats à long terme. Cornea. 2017;36(2):138-43.
19. Naderan M, Jahanrad A. Changements topographiques, tomographiques et biomécaniques de la cornée pendant la grossesse chez les patients atteints de kératocône : une étude de cohorte. Acta Ophthalmol. 2017;95(4):e291-e296.
20. Sandvik GF, Thorsrud A, Råen M, et al. Le cross-linking du collagène cornéen réduit-il le besoin de kératoplasties chez les patients atteints de kératocône ? Cornea. 2015;34(9):991-5.
21. Gomes JA, Tan D, Rapuano CJ, et al. Consensus global sur le kératocône et les maladies ectatiques. Cornea. 2015;34(4):359-69.
22. Nordström M, Schiller M, Fredriksson A, Behndig A. Améliorations réfractives et sécurité avec le crosslinking cornéen guidé par topographie pour le kératocône : résultats à un an. Br J Ophthalmol. 2017;101(7):920-5.
23. Yildiz EH, Diehl GF, Cohen EJ, et al. Démographie des patients de plus de 50 ans atteints de kératocône. Eye Contact Lens. 2009;35(6):309-11.
24. Mazzotta C, Hafezi F, Kymionis G, et al. Microscopie confocale in vivo après réticulation du collagène cornéen. Ocul Surf. 2015;13(4):298-314.
25. Cınar Y, Kürs¸at Cingü A, Turkcu FM, et al. Réticulation accélérée du collagène cornéen pour le kératocône progressif. Cutan Ocul Toxicol. 2014;33:168-71.
26. Kanellopoulos AJ. Résultats à long terme d’un essai prospectif randomisé de comparaison oculaire bilatérale d’une fluence plus élevée, d’un rayonnement ultraviolet a de plus courte durée et de la réticulation du collagène par la riboflavine pour le kératocône progressif. Clin Ophthalmol. 2012;6:97-101.
27. Cummings AB, McQuaid R, Naughton S, et al. Optimisation de la réticulation de la cornée dans le traitement du kératocône : une comparaison des résultats après des protocoles standard et de haute intensité. Cornea. 2016;35(6):814-22.
28. Vinciguerra P, Albè E, Trazza S, et al. Analyse réfractive, topographique, tomographique et aberrométrique des yeux kératoconiques subissant un cross-linking cornéen. Ophtalmology. 2009;116(3):369-78.
29. Kim BZ, Jordan CA, McGhee CN, Patel DV. Histoire naturelle du voile cornéen après le crosslinking du collagène cornéen dans le kératocône en utilisant l’analyse de Scheimpflug. J Cataract Refract Surg. 2016;42(7):1053-9.
30. Wollensak G, Iomdina E. Changements biomécaniques et histologiques après crosslinking cornéen avec et sans débridement épithélial. J Cataract Refract Surg. 2009;35(3):540-6.
31. Caporossi A, Mazzotta C, Paradiso AL, et al. Crosslinking cornéen transépithélial de collagène pour le kératocône progressif : résultats cliniques à 24 mois. J Cataract Refract Surg. 2013;39(8):1157-63.
.
