Les cliniciens sont depuis longtemps frustrés par le rôle disproportionné que joue la pression intraoculaire (PIO) dans le traitement du glaucome. En tant que seul facteur se prêtant à une intervention médicale ou chirurgicale, son rôle est vital. Pourtant, la tonométrie est intrinsèquement limitée : Une seule mesure prise tous les quelques mois ne permet pas de décrire les flux et reflux diurnes de la PIO. Même le fait de faire venir les patients pour plusieurs lectures de tonométrie ne donne pas une idée idéale des caractéristiques de la PIO du patient.

|
|
| Ce capteur microfluidique implantable de surveillance de la PIO sur 24 heures est actuellement en cours de développement à l’Université de Stanford. Photo : Ishmail E. Araci |
Les experts pensent que l’on finira par équiper les patients d’un minuscule capteur logé sur une lentille de contact ou une paire de lunettes, ou par les envoyer chez un ophtalmologiste pour qu’il en implante un dans l’œil. Ce capteur mesurerait en permanence la PIO, ce qui augmenterait de façon exponentielle la quantité – et, espérons-le, la valeur – des données que vous recevrez. Si l’approche actuelle de la documentation de la PIO s’apparente à la prise d’un instantané, la surveillance continue de la PIO pendant 24 heures s’apparente davantage à la capture d’une vidéo qui enregistre les changements au fil du temps plutôt que de donner une seule lecture statique.
Ces gadgets sont encore en cours de développement. Sont-ils prêts pour le prime time ? Jetons un coup d’œil à la façon dont la PIO fluctue, aux défis cliniques qu’elle crée et aux technologies de pointe actuelles qui tentent de mieux suivre la PIO pour permettre une meilleure compréhension clinique.
Une cible mobile
Mettre en place un plan de traitement basé sur l’atteinte d’une PIO cible est délicat lorsque la cible elle-même se déplace. La PIO fluctue tout au long de la journée – heure par heure, minute par minute, voire seconde par seconde – en fonction d’une variété de facteurs endogènes et exogènes.
Dans le système oculaire, la PIO peut dépendre de l’équilibre entre la production d’humeur aqueuse, la facilité d’écoulement (la facilité avec laquelle l’humeur aqueuse quitte l’œil), la pression veineuse épisclérale (la pression dans les veines à la surface de l’œil) et l’écoulement uvéoscléral (une voie secondaire pour que l’humeur aqueuse quitte l’œil).
Par exemple, une augmentation de la facilité d’écoulement ou une diminution de la production d’humeur aqueuse ferait baisser la PIO, explique Arthur J. Sit, MD, chercheur sur le glaucome à la Mayo Clinic de Rochester, Minn. Des sauts à court terme de la PIO peuvent également se produire en raison de la pression exercée sur l’œil par le clignement ou le frottement de l’œil ou même pendant le mouvement de l’œil ou les pulsations de la pression sanguine.
La pression intraoculaire fluctue également en raison de la position du corps, de l’heure de la journée (pics la nuit, creux le jour), de la pression sanguine et du concept connexe de pression de perfusion oculaire (PPO), des niveaux de stress ou de douleur, de la consommation d’eau et de caféine.
En outre, une activité vigoureuse et le stress peuvent provoquer des pics de pression artérielle, de PIO et de PPO, explique Kaweh Mansouri, MD, MPH, ophtalmologue à l’Université de Genève et à l’Université du Colorado à Denver. La mesure de la pression artérielle en conjonction avec la PIO est utile pour déterminer comment la pression artérielle affecte la PIO, dit le Dr Mansouri. Les chercheurs utilisent actuellement des dispositifs de surveillance de la PIO sur 24 heures pour explorer ces effets sur la progression du glaucome.
|
Les choses à faire et à ne pas faire dans la mesure de la PIO Ne pas diagnostiquer ou traiter après une seule mesure. Le Dr Sowka conseille aux optométristes de ne pas commencer un traitement immédiatement, sauf si la pression est excessivement élevée ou si les nerfs optiques sont déjà gravement endommagés et vulnérables ; au contraire, mesurez la pression plusieurs fois. Il est également bon d’obtenir plusieurs lectures de la pression après le début du traitement pour déterminer si le médicament est efficace, dit le Dr Sowka. Une seule lecture de la PIO après avoir commencé un médicament n’est vraiment pas suffisante pour juger de sa véritable efficacité. Dire aux patients de se détendre. Comme mentionné précédemment, les patients peuvent se crisper ou retenir leur respiration pendant la tonométrie. Dites-leur régulièrement de se détendre et de respirer normalement pendant le processus, exhorte le Dr Mansouri. Ne laissez pas tomber vos soupçons. Si les mesures de la PIO du patient ne semblent pas correspondre à vos évaluations du champ visuel et du nerf optique, il se peut que la PIO du patient soit plus importante que vous ne le pensiez, dit le Dr Hartwick. Demandez-leur de revenir et de mesurer leur PIO à un autre moment de la journée, ajoute-t-il. Envisagez une courbe diurne chez certains patients. L’enregistrement d’une courbe diurne par tonométrie est peu pratique et fastidieux pour la plupart des patients. Mais si le niveau de la PIO et l’étendue des dommages semblent incongrus – par exemple, lorsque vous soupçonnez un glaucome à tension normale – envisagez cette possibilité, dit le Dr Davey. Si le patient est d’accord, faites-le venir tôt le matin et enregistrez la PIO toutes les heures pendant huit à dix heures. « Cela vous donne la courbe diurne du cabinet, qui peut ne pas être totalement représentative des valeurs jour/nuit, mais au moins cela vous donne plus d’une mesure », dit-il. |
Voici comment ces variables affectent la PIO :
– Position du corps. Selon la position du patient sur le fauteuil, la pression peut augmenter ou diminuer. Par exemple, la PIO est la plus basse lorsque le patient est assis dans une position neutre. « Presque tout le reste provoque une augmentation de la PIO, notamment le fait de pencher le cou en avant, de pencher la tête en arrière, de tourner la tête sur le côté, de s’allonger, de se pencher en avant, de cligner des yeux ou de se frotter les yeux », explique le Dr Sit.
– La consommation d’eau. Boire un grand volume d’eau entraîne une augmentation du volume sanguin du patient pendant un court moment. La pression veineuse augmente également lorsque le patient consomme plus d’eau. « Tout ce qu’ils ont à faire, c’est de consommer 16 à 32oz, soit une ou deux petites bouteilles d’eau, et en cinq minutes, la pression augmentera de 6mm Hg », explique Pinakin Gunvant Davey, PhD, OD, professeur et expert en glaucome au College of Optometry de la Western University of Health Sciences à Pomona, en Californie.
– Le moment de la journée. La littérature a montré que le pic de PIO se produit la nuit chez deux tiers des patients. La raison : l’eau est sous-sécrétée la nuit, explique Joseph Sowka, OD, professeur d’optométrie au Nova Southeastern University College of Optometry à Ft. Lauderdale, Fla.
Par exemple, le Dr Mansouri a observé des patients pendant 24 heures dans des laboratoires de sommeil et a constaté que les PIO les plus élevées se situaient la nuit. Même si vos patients ne seront pas soumis à des études du sommeil, ils peuvent se présenter à votre cabinet le soir – si c’est le cas, attendez-vous à voir des PIO élevées par rapport aux autres moments de la journée.
– La pression artérielle. La PIO de base est basée sur le cycle cardiaque, la pression sanguine systolique et diastolique. La force utilisée pour amener le sang dans l’œil est la pression de perfusion oculaire, explique James L. Fanelli, OD, du Cape Fear Eye Institute à Wilmington, NC.
Si la pression sanguine est basse, il y a moins de force pour « pousser » le sang dans l’œil, et donc moins de pression de perfusion pour l’œil. Les facteurs qui provoquent une élévation de la PIO auront un effet sur la baisse de la pression de perfusion, et les facteurs qui abaissent la pression artérielle entraîneront également une baisse de la pression de perfusion – ou une combinaison de n’importe lequel de ces facteurs peut jouer un rôle, dit le Dr Fanelli. La pression artérielle a tendance à baisser pendant les heures de sommeil, tôt le matin, qui est aussi le moment de la journée où la PIO a tendance à être la plus élevée.1 Ces deux facteurs opposés peuvent avoir un effet duplicatif en réduisant la PPO pendant les heures nocturnes, ce qui peut permettre une augmentation des dommages à la tête du nerf oculaire.
– Le stress. Une augmentation ou une diminution du stress provoque des changements hormonaux qui poussent les niveaux de PIO vers le haut ou vers le bas. L’un des patients du Dr Mansouri – étudié à l’aide d’un capteur de surveillance de la PIO sur 24 heures sur une lentille de contact – présentait des pics de pression chaque fois que son chien avait des crises d’épilepsie la nuit.
– Les « nerfs » en général. Il est possible que, chez certains patients, le stress de l’examen oculaire lui-même – par exemple, s’ils sont inquiets de se voir diagnostiquer un glaucome – puisse faire monter leur PIO, explique Andrew Hartwick, OD, PhD, professeur associé à l’Ohio State University College of Optometry à Columbus. Par exemple, ils peuvent serrer les yeux parce qu’ils sont stressés par l’examen, et les lectures de la PIO grimpent en flèche.
– La douleur provoque également des poussées de PIO parce qu’elle est source de stress. Un des patients du Dr Mansouri s’est violemment cogné la jambe dans un parking. Il y avait un pic dans son niveau de PIO au moment exact où elle se rappelait que son accident s’était produit, selon les données de surveillance de 24 heures.
Conséquences des lectures inexactes de la PIO
Des études ont indiqué que les pics de PIO pourraient contribuer à la progression du glaucome.2,3 Mais si vous examinez un patient lorsque la PIO est au plus bas ou au plus haut, vous pouvez surestimer ou sous-estimer le diagnostic de glaucome ou le traitement requis pour le patient.
« Si nous attrapons un patient au creux de la vague, là où la PIO est la plus basse, cela peut nous éloigner d’une considération de glaucome », surtout si la lecture se situe dans une fourchette statistiquement normale, dit le Dr Sowka. « D’autres fois, nous pouvons les recevoir à un pic de PIO, où elle est un peu supérieure à la normale – un scénario qui tend à inquiéter inutilement les praticiens. »
|
|
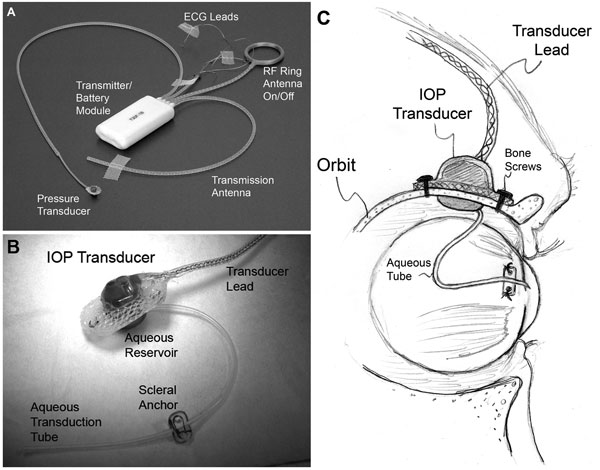
| (A) Un système d’implant total T30F typique (Konigsberg Instruments). (B) La surface extra-orbitaire du boîtier du transducteur de PIO personnalisé. (C) Un tube en silicone de 23 gauges achemine l’eau de la chambre antérieure à un réservoir de fluide sur le côté intraorbitaire du transducteur (partiellement caché de la vue en B) ; Le tube (avec un jeu approprié pour permettre le mouvement des yeux) a été coupé et inséré dans la chambre antérieure. |
L’enregistrement d’une plage de PIO permettrait potentiellement d’améliorer le diagnostic et la gestion du glaucome. « Si les chercheurs pouvaient montrer que des schémas spécifiques de PIO sur 24 heures sont liés à la progression du glaucome, on peut alors espérer que la détection de ces schémas pourrait aider à identifier les patients présentant un risque accru de progression et nous permettre d’adapter leur traitement en conséquence », explique le Dr Mansouri.
Le glaucome pourrait être identifié plus tôt, ce qui permettrait de commencer la chirurgie ou la prise de médicaments plus rapidement, ajoute-t-il. Les ophtalmologistes pourraient également déterminer si les médicaments abaissant la PIO sont efficaces la nuit ou pendant des activités spécifiques qui augmentent la PIO.
L’établissement d’une véritable fourchette de PIO nécessiterait une surveillance continue de la PIO sur 24 heures. C’est un défi, car une seule mesure de la PIO recueillie pendant les heures normales de bureau ne permet pas de saisir la plage de la PIO d’un patient, ses pics ou ses changements au cours de la journée.4
À l’heure actuelle, la détermination de la plage de la PIO est possible en utilisant la tonométrie d’aplanation de Goldman (GAT) par le biais d’une courbe de tension diurne (DTC), où les lectures de la PIO sont capturées à différents moments pendant les heures de la clinique. Mais cette méthode est problématique tant pour le praticien que pour le patient. Les courbes nocturnes ne sont pas enregistrées, et moins de 1 % des patients subissent une CPT ou une surveillance de la PIO dans un laboratoire de sommeil.4
En effet, des chercheurs ont mesuré la PIO pendant 24 heures et ont documenté non seulement que la PIO atteint un pic nocturne, mais aussi que la fluctuation de la PIO était bien plus importante en dehors des heures de bureau.5 Dans une étude portant sur 35 patients dont la PIO a été enregistrée à l’aide d’un pneumatonomètre dans un laboratoire de sommeil pendant 24 heures, la plupart des pics de PIO ont été enregistrés la nuit chez les patients glaucomateux plus âgés par rapport aux personnes en bonne santé, qu’ils soient assis ou allongés.6
Plus récemment, les enquêteurs utilisant une surveillance de 24 heures ont appris que la PIO moyenne ne s’élève pas seulement la nuit, mais qu’elle est en fait constamment en pic – et davantage le jour que la nuit.7 Les chercheurs du Devers Eye Institute de Portland (Ore) ont utilisé un système de télémétrie implanté dans les yeux de singes pour enregistrer 500 mesures de PIO par seconde.
Ils ont constaté que la PIO fluctue beaucoup plus qu’on ne le pensait auparavant. « Les clignements et les mouvements oculaires génèrent de grands pics de PIO qui se produisent environ 12 000 fois par heure et constituent environ 12% de l’énergie totale de la PIO que l’œil doit absorber pendant les heures d’éveil », ont constaté les chercheurs. Ils pensent que ces données chez le singe seront à peu près les mêmes chez l’homme. « La PIO doit maintenant être considérée comme dynamique et en constante évolution, et les fluctuations de la PIO pourraient s’avérer être un facteur important du glaucome. « 8
Ils ont également constaté que le cycle diurne ne se répète pas d’un jour à l’autre. D’où la nécessité d’une surveillance continue de la PIO. Les prototypes actuels comprennent des capteurs implantés et des dispositifs à base de lentilles de contact.
Intelligent Implantables
Plusieurs start-up ont développé des capteurs de pression télémétriques qui peuvent être implantés lors d’une chirurgie de la cataracte ou du glaucome. « Télémétrique signifie que les lectures de pression sont capturées à distance (c’est-à-dire à l’intérieur de l’œil) et transmises sans fil à un lecteur externe », explique le Dr Sit.
Les dispositifs implantables actuellement à l’étude comprennent :

|
|
|
Le capteur Pro-IOP est un dispositif télémétrique qui est implanté comme une IOL. Photo : Implandata Ophthalmic Products GmbH |
– Pro-IOP. La société allemande Implandata Ophthalmic Products travaille sur le Pro-IOP, un transducteur de pression intraoculaire sans fil (WIT) qui est alimenté par télémétrie par un dispositif portatif. Ressemblant à un minuscule anneau en plastique, le WIT mesure 11,3 mm de diamètre.9 Il intègre des capteurs de pression, un capteur de température, un codeur d’identification, un codeur analogique-numérique et une unité de télémétrie dans un seul système microélectromécanique.9
Une puce RFID avec antenne intégrée diffuse les relevés de la PIO sur 24 heures à un lecteur portatif externe. À terme, le patient et le médecin pourraient également avoir la possibilité de recevoir ces données via une application pour smartphone. Le patient pourrait également communiquer avec le médecin au sujet des lectures de la PIO sur l’application.
Le dispositif n’a pas encore reçu les marques CE en Europe ou l’approbation de la FDA aux États-Unis, mais des chercheurs en Allemagne ont récemment inséré le Pro-IOP dans le premier sujet humain, une femme d’une soixantaine d’années ; aucune donnée n’a encore été publiée.9
– AcuMEMs. Implantable en cours de développement par une société américaine du même nom, AcuMEMs fonctionne de manière similaire au Pro-IOP. Il s’agit d’un capteur de pression capacitif qui change de forme en fonction des fluctuations de la PIO. « Lorsqu’il change de forme, la capacité électrique est modifiée et cela peut être détecté en externe avec le lecteur », explique le Dr Sit.
Le capteur peut être implanté dans la chambre antérieure comme une procédure autonome ou dans le cadre d’une chirurgie du glaucome ; il peut également être inséré dans le sac capsulaire lors d’une chirurgie de la cataracte.
– Implantation d’une LIO microfluidique. Des chercheurs de l’université de Stanford et de l’université Bar-Ilan en Israël développent conjointement un capteur microfluidique implantable. La PIO serait mesurée « sur la base d’une interface de pression d’équilibre établie entre un liquide et un gaz intraoculaires » contenus dans les chambres du capteur, selon le brevet du dispositif. Les patients et les médecins pourraient utiliser leurs smartphones ou un lecteur externe pour vérifier leur PIO.10 Les inventeurs attendent l’approbation du brevet pour le capteur.
Le signal transmis par les dispositifs implantés dans l’œil pourrait être plus précis que ceux fixés sur les lentilles de contact, en théorie, dit le Dr Davey. L’intensité du signal dépend de la quantité d’énergie émise par le dispositif. « Nous avons implanté les deux dispositifs (Pro-IOP et AcuMEMs) et ils ne fonctionnaient pas si bien », dit le Dr Davey.
Les lecteurs Pro-IOP et AcuMEMs pourraient potentiellement être attachés à une paire de lunettes, et les données seraient collectées de la même manière, dit le Dr Sit.
Les lentilles de contact intelligentes
Les chercheurs ont d’abord étudié les capteurs de lentilles de contact dans les années 1970, mais les lentilles de contact dures disponibles étaient trop inconfortables et modifiaient l’intégrité structurelle de l’œil du patient, selon le Dr Davey.
|
|
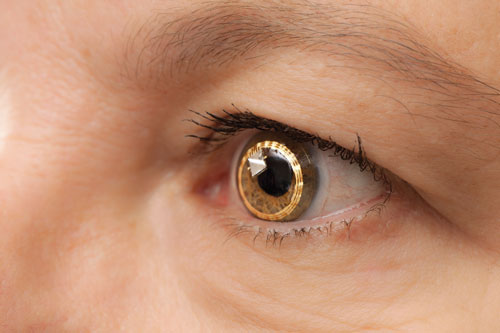
| Le Triggerfish de Sensimed sur l’œil. Il fait encore l’objet d’essais cliniques aux États-Unis. |
Les capteurs n’étaient pas non plus assez sensibles. « La personne avec un œil « plus souple » avait des lectures plus précises qu’une personne avec un œil plus rigide », explique le Dr Davey. « La technologie n’était pas assez bonne pour obtenir des valeurs de PIO ». Une cornée plus épaisse répond moins facilement aux changements de PIO, ce qui rend la tonométrie (et les capteurs de lentilles de contact) moins précise.
Les capteurs de PIO à base de lentilles de contact comprennent :
– Le Triggerfish (Sensimed). A l’Université de Genève en Suisse, les ophtalmologistes ont mené les premières investigations sur une lentille de contact surnommée Triggerfish, dirigée par le Dr Mansouri et d’autres.
Le Triggerfish est une lentille de contact souple hydrophile équipée d’un capteur de lentille de contact (CLS). Le CLS comporte deux jauges de contrainte situées autour du limbe qui détectent les changements de circonférence oculaire. « On pense que ces changements de circonférence oculaire sont liés aux changements de PIO et de volume intraoculaire, ce qui a été prouvé dans des yeux énucléés », explique le Dr Mansouri. L’appareil mesure un mélange de PIO, de volume intraoculaire et de changements de propriétés biomécaniques (une combinaison d’hystérésis et de rigidité de la cornée et de la sclère) qui sont en corrélation avec les fluctuations de la PIO. Un lecteur externe capture les données sur une période de 24 heures.
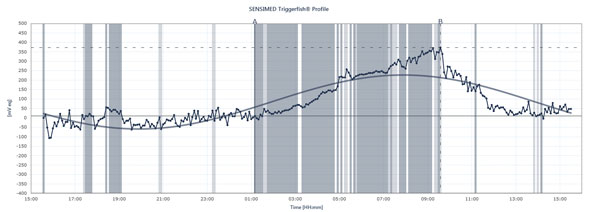
Le diagramme de flux montre les pics et les creux de la PIO chez un patient portant le Triggerfish de Sensimed sur une période de 24 heures.
Le Triggerfish est approuvé par le marquage CE en Europe. L’approbation de la FDA n’a pas été atteinte aux États-Unis et le dispositif est toujours en cours d’essais cliniques.
|
Le Triggerfish suit la PIO différemment Les données affichées sur le lecteur externe sont une combinaison de la pression intraoculaire, du volume intraoculaire et des propriétés biomécaniques de l’œil, explique le Dr Mansouri. « Il est utile de vous donner une idée des changements qualitatifs sur 24 heures plus que des changements quantitatifs, car nous ne pouvons pas les traduire en millimètres de mercure », dit-il. Le Triggerfish fournit néanmoins des informations précieuses. De futures études utilisant l’appareil pourraient aider à expliquer à quel point la pression a été instable ou stable sur 24 heures, quand les pics de PIO nocturnes se produisent, comment l’introduction d’un traitement ou de changements de traitement affecte les schémas de PIO sur 24 heures et comment des activités spécifiques affectent les schémas de PIO sur 24 heures, comme les positions de yoga, la consommation de caféine, les situations stressantes et d’autres causes de pics de PIO décrites ci-dessus. Le Dr Mansouri fait également subir aux patients atteints de glaucome normal ou à faible tension une surveillance simultanée de la pression artérielle sur 24 heures et de la PIO sur 24 heures, car les pics peuvent affecter la PIO. Mais le Triggerfish montrera-t-il une corrélation entre les schémas de PIO sur 24 heures et la progression du glaucome ? De nombreuses études sont en cours pour répondre à cette question essentielle.
|
– Lentille de contact à capteur de circuit de résonance. Un autre dispositif CLS intelligent en cours de développement est un circuit de résonance composé d’un condensateur à couche mince combiné à une bobine de détection qui détecte la déformation de la courbure de la cornée. Il en est aux premiers stades de développement sous la direction de David C.C. Lam au département d’ingénierie mécanique et aérospatiale de l’université des sciences et technologies de Hong Kong.
Dans une étude de septembre 2014, le CLS a été testé sur un modèle d’œil en caoutchouc de silicone. Il s’est avéré que le capteur suivait avec précision les fluctuations de la PIO.11
Comme la mesure du taux de glucose une fois par jour pour les patients diabétiques ou de la pression artérielle une fois par jour pour les patients atteints de maladies cardiaques, le fait de se fier à une seule mesure de la PIO pourrait entraîner des données erronées sur la PIO. Mais peut-être que dans un avenir pas si lointain, des dispositifs tout droit sortis d’un film de science-fiction – lentilles de contact et capteurs implantables – pourraient vous permettre de suivre la PIO avec une meilleure compréhension et moins de tracas pour vous et vos patients.
1. Liu JH1, Gokhale PA, Loving RT, Kripke DF, Weinreb RN. Évaluation en laboratoire des pressions de perfusion oculaire diurnes et nocturnes chez l’homme. J Ocul Pharmacol Ther. 2003 Aug;19(4):291-7.
2 Zeimer RC, Wilensky JT, Gieser DK, Viana MA. Association entre les pics de pression intraoculaire et la progression de la perte de champ visuel. Ophtalmology. 1991 Jan;98(1):64-69.
3. Konstas AG, Quaranta L, Mikropoulos DG, et al. Peak Intraocular Pressure and Glaucomatous Progression in Primary Open-Angle Glaucoma. J Ocul Pharmacol Ther. 2012 Feb;28(1):26-32.
4. Mansouri K, Weinreb RN, Medeiros FA. La surveillance de la pression intraoculaire sur 24 heures est-elle nécessaire dans le glaucome ? Semin Opthalmol. Mai 2013 : 28(3):157-164.
5. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Utilité clinique de la surveillance de la pression intraoculaire en dehors des heures normales de bureau chez les patients atteints de glaucome. Arch Ophthalmol. 2006 Jun;124(6):793-7.
6. Mosaed S, Liu H, Weinreb RN. Corrélation entre les pressions intraoculaires nocturnes maximales chez les sujets sains et les patients atteints de glaucome. Am J Ophthalmol. 2005 ; Feb;139(2):320-4.
7. Downs JC, Burgoyne CF, Seigfreid WP, et al. 24-hour IOP telemetry in the nonhuman primate : implant system performance and initial characterization of IOP at multiple timescales. Invest Ophthalmol Vis Sci. 2011 Sep 21;52(10):7365-75.
8. Association pour la recherche en vision et en ophtalmologie : Tendances émergentes et sujets brûlants. Présenté le lundi 5 mai 2014 à la réunion annuelle de l’ARVO. Disponible à l’adresse suivante : www.arvo.org/About_ARVO/Press_Room/Emerging_Trends_and_hot_topics__Presented_Monday,_May_5_at_the_ARVO_Annual_Meeting. Consulté le 19 novembre 2014.
9. Melki S, Todani A, Cherfan G. Un transducteur de pression intraoculaire implantable Résultats initiaux de sécurité. JAMA Ophthalmol. 2014 Oct 1;132(10):1221-5.
10. Mandel Y, Araci IE, Quake SR. Google Patents. Dispositif microfluidique implantable pour la surveillance de la pression intra-oculaire. Disponible à l’adresse : www.google.com/patents/WO2014137840A1?cl=en. Consulté le 17 octobre 2014.
11. Chen GZ, Chan IS, Leung LK, Lam DC. Capteur de lentille de contact souple portable pour la surveillance continue de la pression intraoculaire. Med Eng Phys. 2014 Sep;36(9):1134-9.
12. Mottet B, Aptel F, Romanet JP, et al. Rythme de la pression intraoculaire sur 24 heures chez les jeunes sujets sains évalué par un suivi continu à l’aide d’un capteur de lentilles de contact. JAMA Ophthalmol. 2013 Dec;131(12):1507-16.
