REVIEWS
Signification de l’anémie dans les différentes étapes de la vie
Guzmán Llanos, María José* ; Guzmán Zamudio, José L.** y LLanos de los Reyes-García, M.J.***
*Infirmière en pédiatrie Hôpital SAS de Jerez de la Frontera (Cadix). E-mail : [email protected]
**Ph.D. Hématologue.
***Infirmière de jour Hôpital d’hématologie-oncologie Hospital del SAS de Jerez de la Frontera (Cádiz)
SUMMARY
Abstract : L’anémie a une prévalence élevée dans les consultations de soins primaires et de pédiatrie, et l’HAD représente 50% de tous les cas d’anémie.
Méthodologie : Revue de la littérature et analyse documentaire descriptive sur l’étiopathogénie de l’anémie ferriprive, les tests diagnostiques de base pour l’étude de l’ADH et sa signification, en utilisant un cadre temporel spécifique dans la recherche documentaire et des critères d’inclusion selon les dimensions analysées dans l’étude : Notions sur le métabolisme du fer. Notions sur l’hématopoïèse. Diagnostic de laboratoire et classification des anémies. Clinique de l’anémie ferriprive. Causes de la carence en fer.
Résultats et conclusion : L’étude documentaire réalisée montre l’existence de publications dont le contenu porte sur l’étiopathogénie de l’anémie ferriprive, les tests diagnostiques de base pour l’étude de l’ADH et leur signification, démontrant l’importance de ce contenu pour le professionnel infirmier dans le domaine des soins primaires et de la pédiatrie.
Palabras clave : anemia por deficiencia de hierro ; anemia en la gestación, anemia en el anciano.
ABSTRACT
Overview : L’anémie est très fréquente dans les consultations de soins primaires et en pédiatrie, et l’IDA est la cause de 50% de tous les cas d’anémie.
Méthodologie : Revue de la littérature et analyse descriptive documentaire de la pathogénie de l’anémie ferriprive, des tests diagnostiques de base pour étudier l’AID et de la signification de ceux-ci en utilisant une période spécifique dans la recherche documentaire et des critères d’inclusion qui tiennent compte des facteurs qui sont analysés dans l’étude : Idées sur le métabolisme du fer. Idées sur l’hématopoïèse. Diagnostic de laboratoire et classification de l’anémie. Caractéristiques cliniques de l’anémie ferriprive. Causes de la carence en fer.
Résultats et conclusion : L’étude documentaire étagée couvre les publications sur la pathogénie de l’anémie ferriprive, les tests diagnostiques de base pour étudier l’AID et la signification de ces derniers, et elle montre l’importance de ces données pour les soins infirmiers professionnels dans le domaine des soins primaires et de la pédiatrie, pour les identifier et agir en conséquence.
Mots clés : anémie ferriprive ; anémie pendant la grossesse ; anémie chez les personnes âgées.
Introducción
La OMS définit l’anémie como el descenso del nivel de hemoglobina dos desviaciones estándar por debajo de lo normal para la edad y el sexo(1). En términos prácticos podemos adoptar las cifras de 13 gr/dl en el hombre, 12 gr/dl en las mujeres y 11 en la embarazada. En los niños de 6 meses a 6 años 11/gr/dl y de 6 años a 14 años, 12 gr/dl. Ces critères sont basés sur des études de population qui n’incluent pas les personnes de plus de 65 ans et peuvent ne pas être applicables aux personnes âgées.
L’anémie est très présente dans les consultations de soins primaires, en pédiatrie et dans le suivi de la grossesse. La carence en fer (IDA) n’est pas la même chose que l’anémie ferriprive (IDA). L’IDA est la cause la plus courante d’anémie dans le monde et représente un problème de santé majeur, principalement dans les pays sous-développés. L’HAD est très répandue, de sorte que jusqu’à 5 % des enfants et des adolescents, 10 % des femmes pré-ménopausées et 1 % des hommes souffrent d’anémie ferriprive ; et elle peut atteindre 40 % des personnes âgées en soins à domicile.
La plupart des services de santé ont des directives cliniques pour la prise en charge de l’anémie en général et/ou de l’anémie gestationnelle (2,3)
L’anémie gestationnelle est considérée comme un facteur de risque pour la grossesse et peut provoquer une anémie dans la période néonatale en raison de faibles réserves en fer. (4)
Anémie dans l’enfance : l’HAD affecte la croissance et le développement des enfants, diminue la résistance aux infections et altère le développement cognitif et psychomoteur.(5,6)
Selon le rapport de l’OMS de 1993-2005, la prévalence de l’HAD chez les enfants d’âge préscolaire peut représenter 47,4% et pour la même agence, la présence de plus de 40% représente un grave problème de santé. (7).
En cas d’HAD chez les femmes ménopausées, les adultes et les personnes âgées, il faut toujours exclure une fuite digestive.
Objectif
Le but de ce travail est d’identifier l’étiopathogénie de l’anémie ferriprive, les tests diagnostiques de base pour l’étude de l’ADH et leur signification, à travers une revue de la littérature, et de reconnaître les différents stades de la carence en fer de manière précoce dans les consultations de soins primaires, de pédiatrie et de grossesse, comme une action préventive et une opportunité d’amélioration de toutes les activités infirmières dans ces processus.
Méthodologie
Revue bibliographique de la littérature publiée sur l’étiopathogénie de l’anémie ferriprive et des tests diagnostiques pour l’étude de l’ADH et de sa signification. Étude documentaire descriptive à partir de différentes sources bibliographiques et bases de données sur le sujet étudié.
Le cadre temporel utilisé dans la recherche bibliographique a porté sur les années 2000-2014, ainsi que quelques autres bibliographies à caractère référentiel sur le sujet analysé, en dehors de ce cadre temporel.
Les critères d’inclusion dans la recherche bibliographique sont basés sur les articles et la documentation publiés sur le sujet, dans la période sélectionnée, en étant affinés en fonction de leur contenu et des dimensions à analyser (Notions sur le métabolisme du fer. Notions sur l’hématopoïèse. Diagnostic de laboratoire et classification des anémies. Clinique de l’anémie ferriprive. Causes de la carence en fer).
Les descripteurs ou mots-clés suivants ont été utilisés comme mots-clés de recherche : anémie ferriprive chez l’enfant (4368 articles), anémie ferriprive chez la femme enceinte (jusqu’à 2173 articles) et chez les personnes âgées (4605) et une sélection a été faite parmi ceux-ci, selon les critères d’inclusion de la revue effectuée.
Résultats
1.-Information sur le métabolisme du fer
Le fer est important car il fait partie de l’hémoglobine et des cytochromes. Une fois la croissance terminée, le fer corporel reste fixé dans une fourchette très étroite. Le fer corporel est recyclé dans différents bassins. (8,9)
– Absorption : Le fer que nous absorbons avec les aliments doit être absorbé, puis transporté dans le sang et enfin stocké pour former du fer de dépôt (les réserves de fer). Le fer que nous absorbons avec les aliments se présente sous la forme Fe +++ mais il est absorbé dans le duodénum et la partie supérieure du jéjunum sous la forme Fe ++, il doit donc subir un processus de réduction impliquant l’acide ascorbique. Seuls 10 % du fer contenu dans l’alimentation sont absorbés, ce qui représente 0,25 % du fer total de l’organisme. Un certain nombre de facteurs favorisent ou entravent l’absorption du fer.
L’absorption du fer est ajustée aux besoins de l’organisme en fer. En cas d’anémie ferriprive, l’absorption du fer est favorisée. Le métabolisme du fer est unique en ce sens que l’équilibre du fer est contrôlé principalement par l’absorption plutôt que par l’excrétion.
Le fer alimentaire : la teneur en fer de l’alimentation est d’environ 10 à 30 mg/jour pour un adulte. Avec l’absorption de 5 à 10% du fer alimentaire (0,5 à 1 mgr), la proportion augmente à 20% en cas de carence en fer et diminue en cas de surcharge en fer.
– Transport : le fer dans le sang est lié à sa protéine de transport, la transferrine). Le complexe fer-transferrine est absorbé dans les cellules par un récepteur spécifique.
La transférine est synthétisée dans le foie et sa concentration dans le sang dépasse la capacité de liaison du fer et environ deux tiers de la capacité de liaison sont insaturés.
Enfin, le fer doit être stocké sous forme de ferritine et/ou d’hémosidérine ; environ 1 microgramme/L de ferritine sérique correspond à 10 mg de fer stocké.
Distribution du fer : le plus grand pool de fer se trouve dans les globules rouges sous forme de fer lié à l’hémoglobine et représente environ 2500 mg. 40 mg supplémentaires font partie de la myoglobine. Les organes de dépôt stockent 800 à 1200 mg. Seuls 4 mg sont sous forme de fer lié à la transferrine.
Besoins en fer et bilan ferrique : Les besoins d’un adulte en bonne santé et d’une femme ménopausée sont d’environ 1 mg/jour.
Les besoins augmentent jusqu’à 5 mg pour les femmes en âge de procréer, les donneurs de sang, etc.
Chez les femmes enceintes, le besoin est de 7 mg/j.
L’élimination du fer n’est pas aussi bien régulée ; environ 1 mg de fer par jour est éliminé par l’intestin, l’urine et la transpiration. Avec les menstruations, 15 à 30 mg de fer sont perdus, ce qui peut être compensé par une augmentation de l’absorption mais est plus difficile à compenser en cas de ménorragie ; une autre cause peut être une hémodontie fréquente et, dans la petite enfance, des tests analytiques excessifs.
2.-Note sur l’hématopoïèse
La formation des éléments constitutifs du sang (leucocytes, globules rouges et plaquettes) a lieu dans la moelle osseuse et ce processus est appelé hématopoïèse. A partir d’une cellule souche pluripotente et stimulée par l’érythropoïétine, cette cellule souche après plusieurs transformations aboutirait à la formation de l’hémocyte mature, un processus connu sous le nom d’érythropoïèse(10). L’érythropoïétine (EPO) est le principal facteur de croissance régulant l’érythropoïèse. Il est produit dans le rein. Il stimule la prolifération de la série érythroïde et la libération du réticulocyte de la moelle osseuse. Environ 20 à 30 % des cellules souches se différencient en érythropoïèse. L’hémocyte est une cellule anucléée dont la fonction principale, grâce à l’hémoglobine (Hb), est de transporter l’oxygène vers les tissus.
La synthèse de l’hémoglobine se fait au stade normoblaste, et lorsque l’hémoglobine est entièrement hémoglobinée, le noyau est libéré et donne naissance au réticulocyte.
Pour maintenir une hématopoïèse normale, un apport adéquat en fer et une concentration suffisante de vitamine B-12 et d’acide folique sont nécessaires.
L’hb est constitué d’une partie protéique (la globine) et du groupe hème (qui porte l’atome de fer ferreux).
Lorsque les globules rouges vieillissent, ils sont phagocytés par les cellules du système phagocytaire mononucléaire. Cela se produit à environ 120 jours et environ 0,8% du pool de globules rouges est utilisé et un équilibre est maintenu entre ce qui est formé et ce qui est détruit.
3.- Diagnostic de laboratoire et classification des anémies
3.1. Tout d’abord nous devons confirmer que le patient est anémique et ensuite que cela est dû à une carence en fer et pour cela nous allons demander :
– L’hémogramme est l’examen le plus basique, il nous apporte beaucoup d’informations puisqu’il nous fournit le nombre de globules rouges, la valeur de l’hémoglobine et les indices corpusculaires VCM, HCM. En plus du nombre de leucocytes et de plaquettes. Et tout cela est utile pour classer les anémies. L’anémie ferriprive s’accompagne souvent d’une thrombocytose réactive.
– Paramètres liés au métabolisme du fer : sidérémie, transferrine, indice de saturation de la transferrine et récepteur soluble de la transferrine (RsTf)
– Évaluation des dépôts : ferritine sérique.
– Examen du frottis sanguin : il révèle la teneur en hémoglobine (hypochromie), les altérations de forme (poïkilocytose) et de taille (anisocytose) qui nous orientent vers le bon diagnostic.
Signification clinique des différentes protéines impliquées dans le transport et le dépôt du fer.
Ferritine : c’est la protéine de dépôt du fer la plus importante. On trouve des concentrations élevées dans le foie, la rate et la moelle osseuse. Elle contient 15 à 20 % du fer de l’organisme.
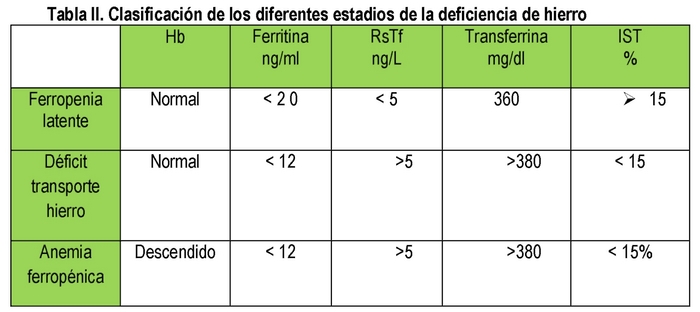
Une petite quantité de la ferritine produite est sécrétée par les cellules et passe dans le sang. Il existe une corrélation directe entre la quantité de cette protéine et le fer stocké de telle sorte que : 1 mcg/L de ferritine sérique correspond à 10 mgr de fer stocké. La ferritine sérique est un bon indicateur des réserves de fer. (11) Cependant, il faut également garder à l’esprit que la ferritine est un réactif de phase aiguë, de sorte que parfois la protéine c-réactive (CRP) doit également être demandée afin d’exclure la présence d’un processus infectieux/inflammatoire. La ferritine est donc très utile pour l’évaluation du métabolisme du fer. Des valeurs < de 12 ng/ml définissent une carence en fer latente. Une ferritine élevée >de 400 ng/ml peut indiquer la présence d’une surcharge en fer.
Transferrine, saturation de la transferrine : la transferrine est une protéine synthétisée dans le foie et 15 à 45% est saturée en fer. Si l’apport fonctionnel en fer est insuffisant alors la synthèse de cette protéine sera augmentée ; des valeurs élevées sont retrouvées en cas de carence en fer et de grossesse.
Récepteur soluble de la transferrine (RsTf) : Environ 75% des récepteurs de la transferrine sont situés dans les précurseurs de l’érythropoïèse. Le nombre de récepteurs de la transferrine augmente lorsque l’approvisionnement en fer fonctionnel est faible. La forme soluble est connue sous le nom de (RsTf). C’est le seul marqueur biologique
qui indique un apport en fer insuffisant pour l’érythropoïèse. Elle a donc une valeur complémentaire à la ferritine. Le RsTf n’est pas affecté par les réactifs de phase aiguë, de sorte qu’il indique une carence en fer en présence d’une infection, d’une inflammation et/ou de tumeurs.(12)
3.2- Classification des anémies
Une manière pratique de classer les anémies est la taille des globules rouges (MCV) et la teneur en hémoglobine (HBC). Ces deux paramètres sont fournis par la lecture de tout hémogramme des compteurs cellulaires modernes.
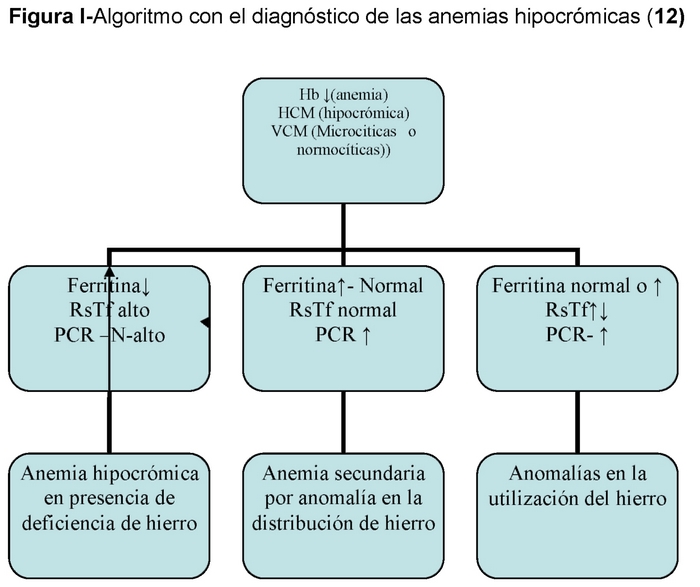
– Selon la taille on parle d’anémies normocytaires, microcytaires et macrocytaires et selon le contenu en Hb (MCH) on parle d’anémies normochromes, hypochromes et hyperchromes13 (tableau I).
– Selon la taille on parle d’anémies normocytaires, microcytaires et macrocytaires. (Tableau I).

Dans le cas des anémies ferriprives, elles sont généralement microcytaires et hypochromes.
Abréviations:
– DH : carence en fer
– ADH : anémie ferriprive
– Hb : hémoglobine
– MCV : volume corpusculaire moyen
– HVM : hémoglobine corpusculaire moyenne
– RsTf : récepteur soluble de la transferrine
– CRP : protéine C-réactive
– Selon la gravité clinique:
– Anémie sévère : Hb < 7.0 gr/dl
– Anémie modérée 7.1 -10.0 gr/dl
– Anémie légère 10.1 – 10.9 gr/dl
L’HAD est l’étape finale d’un processus qui commence par une carence en fer latente dans laquelle il n’y a pas d’anémie mais une carence en ferritine, suivie d’une carence en transport de fer dans laquelle, en plus d’une ferritine basse, il y a un TSI inférieur à 15% et enfin l’HAD avec une ferritine basse, un TSI < 15% et une anémie. (Tableau II)
– Autres anémies avec anomalie de distribution du fer : 14,15
Anémie de la maladie chronique (ACD) : Dans ces cas, il existe une redistribution du fer avec une augmentation du fer de dépôt et une carence relative en fer des cellules érythropoïétiques, conséquence d’une synthèse réduite de la transferrine. Cette disponibilité réduite du fer aurait un effet protecteur contre les infections.
Anémie de la maladie rénale : Dans ce cas, les réserves en fer sont normales mais la mobilisation du fer est altérée (faible saturation de la transferrine), ce qui peut entraîner une altération de l’érythropoïèse et une mauvaise fonction du fer. Le fer oral ne peut être utilisé car l’absorption est altérée.
L’anémie rénale se complique parfois d’une composante hémolytique.
– Anomalies de l’érythropoïèse non induites par le fer :
Déficience en vitamine B-12 et en acide folique
Thalassémies : dans cette maladie, il y a une diminution ou une absence de synthèse des chaînes de globine. La structure de la chaîne de globine est normale. En fonction de la quantité de globine affectée, la thalassémie est appelée alpha, bêta, gamma, delta thalassémie. Ils se manifestent généralement par une microcytose, une hypochromie et une anémie d’intensité variable. 13,14
En raison de la microcytose et de l’hypochromie, elle peut être confondue avec une anémie ferriprive.
Les plus fréquentes sont l’alpha thalassémie mineure et la bêta thalassémie mineure. Il convient de noter que les enfants atteints de thalassémie peuvent également souffrir d’anémie ferriprive et nécessiter un traitement par fer oral. Lorsque la synthèse d’une chaîne de globine diminue, la synthèse des autres globines (Hb A2, Hb F) augmente. La quantification de ces hémoglobines nous aide à les classer.
Néanmoins, toutes les anémies microcytaires et hypochromes ne sont pas des anémies ferriprives et dans ce groupe, il faut mettre en évidence celles où il y a une mauvaise utilisation du fer, comme l’anémie des maladies chroniques, etc.
4.
Les symptômes de l’anémie ferriprive ne sont pas différents de ceux des autres anémies, c’est-à-dire qu’ils ne sont pas spécifiques ; ce sont principalement la fatigue, la lassitude, le manque de force ; mais ces symptômes vont dépendre davantage de la rapidité d’apparition de l’anémie que du taux d’hémoglobine.
Une grande partie des symptômes peut être expliquée par une carence en fer.
Pagophagie : tendance compulsive à manger de la glace.
Géophagie : tendance à manger des choses sales
Modifications des épithéliums : koïlonychie, stomatite angulaire, atrophie des papilles linguales, modifications des muqueuses de l’intestin.
Intolérance à l’effort Modifications comportementales : l’enfant devient apathique et irritable.
5.-Causes de la carence en fer : (16)
Augmentation des besoins physiologiques : croissance, menstruation, grossesse, allaitement.
Perte de sang : gastro-intestinale, urogénitale, iatrogène
Malabsorption : résections gastriques, gastrite chronique atrophique, médicaments Apports inadéquats : personnes âgées, végétariens
L’HAD fait partie d’un diagnostic plus complexe et n’a pas la même signification aux différents âges de la vie.
A. Dans la petite enfance, elle s’expliquerait par les besoins accrus produits par la croissance. Chez l’enfant malade, le nombre et la quantité de sang prélevé pour les études sont très importants(7,18,19)
Le nouveau-né commence sa vie avec environ 80 mg de fer par kg de poids corporel et la majeure partie de ce fer fait partie de l’Hb avec 50 gr/kg. La quantité de fer présente chez le nouveau-né est déterminée par le poids corporel et la masse d’hémoglobine circulante. Couper le cordon ombilical immédiatement après la naissance peut entraîner la perte de 15 à 30 % du fer total. La concentration d’Hb des nouveau-nés est indépendante des taux d’Hb et de fer maternels. Il n’y a pas non plus de corrélation entre les taux de ferritine de la mère et du sang du cordon.
Les nouveau-nés nés de mères diabétiques, malgré leur poids de naissance élevé, peuvent être carencés en fer.
Durant les 5 premiers mois de vie, le nouveau-né est capable de doubler son poids corporel sans vider ses réserves de fer. Ensuite, l’absorption du fer est importante pour maintenir l’équilibre en fer.
Pendant la première année de vie, les besoins sont plus importants que pendant le reste de la vie. L’enfant a besoin d’environ 0,5 mgr/j pour répondre aux besoins imposés par la croissance. Il est peu probable que le lait puisse fournir cette quantité de fer, mais l’anémie ferriprive est rare chez les enfants nourris exclusivement au sein, ce qui pourrait s’expliquer par le fait que le fer contenu dans le lait est absorbé à 80 %. L’état nutritionnel des nourrissons allaités est supérieur à celui des nourrissons nourris au lait de vache. Entre 6 et 12 mois, les nourrissons nourris au lait peuvent développer une carence en fer.
La prévalence de la DH est liée au statut socio-économique de la famille).
B.- Chez les femmes en âge de procréer, la prévalence de la DH est liée à la fonction cognitive et même aux crises fébriles.
B.- Chez les femmes en âge de procréer, la prévalence de la DH est liée au statut socio-économique de la famille. Chez les femmes en âge de procréer, elle s’expliquerait par la perte de fer liée aux menstruations, à la grossesse et à l’allaitement.(20)
La perte menstruelle chez la plupart des femmes est de 40 ml ce qui équivaut à 20 mgr de fer. En Europe, l’alimentation contient suffisamment de fer pour compenser des pertes sanguines de 80 ml, soit 1,2 mg/j. Les saignements menstruels excessifs sont la principale cause d’anémie et touchent 9 à 14% des femmes (21)
La grossesse entraîne une perte d’environ 680 mg de fer. C’est beaucoup plus que ce qui peut être absorbé, c’est pourquoi une supplémentation en fer est nécessaire pendant la grossesse.
À l’heure actuelle, plus de 40 millions de femmes enceintes dans les pays en développement souffrent d’une carence en fer. L’anémie ferriprive représente 75 % à 95 % des anémies de la grossesse. L’anémie ferriprive pendant la grossesse a été associée à la prématurité, au faible poids de naissance et à la morbidité maternelle. Les besoins en fer varient tout au long de la grossesse. Entre 4 et 5 mgr de fer sont nécessaires au cours du 2ème et 3ème trimestre. La prophylaxie orale du fer est le meilleur moyen de corriger ce déficit. Les besoins physiologiques en fer pendant la grossesse ne peuvent être satisfaits par l’administration simultanée d’acide folique. Les recommandations sont de 60 mg de fer pour les femmes sans anémie plus l’acide folique.(22)
C. – Chez les femmes ménopausées, les adultes et les personnes âgées, le diagnostic peut être plus grave et une fuite digestive doit être exclue(23).
Chez les personnes âgées, le taux d’Hb n’est pas aussi bien défini pour définir l’anémie.
Chez les personnes âgées, un taux de ferritine normal n’exclut pas toujours une carence en fer, le seuil de prédiction de la carence en fer doit donc être porté à 50 microgrammes/l.
Dans ce groupe de patients, l’examen gastro-intestinal est indiqué en raison de la fréquence élevée à laquelle des lésions occultes sont détectées.
Chez les patients de plus de 75 ans souffrant d’anémie ferriprive, jusqu’à 68% des patients ayant subi une endoscopie ont vu la cause du saignement détectée et jusqu’à 11% des cas avaient une lésion synchrone.
L’absence de carence en fer n’exclut pas la présence d’une néoplasie gastro-intestinale(24). Chez jusqu’à 20-30% des personnes âgées, la cause de l’anémie est inconnue et est connue sous le nom d' »anémie idiopathique du vieillissement »
Conclusions
– Le diagnostic et la classification de l’HAD sont basés sur des techniques de base facilement disponibles dans tout laboratoire clinique,
– L’HAD est la fin d’un processus qui commence par une carence en fer.
– La clinique de l’HAD est similaire aux autres anémies mais il existe des symptômes spécifiques qui peuvent être attribués à une carence en fer.
– L’HAD est l’anémie la plus répandue à tous les âges de la vie
– Dans la petite enfance, entre 6 et 12 mois, les enfants nourris exclusivement au lait de vache peuvent développer une carence en fer. Chez l’enfant hospitalisé, une cause importante est le nombre de prises de sang.
– L’ADH est responsable de 75% à 95% des anémies de la grossesse
– Chez les femmes ménopausées, les adultes et les personnes âgées, il faut toujours exclure une fuite digestive.
– Chez les personnes âgées, jusqu’à 20-30% des cas, l’étiologie est inconnue
Références
1. Organisation mondiale de la santé. Évaluation, prévention et contrôle de l’anémie ferriprive. Un guide pour les gestionnaires de programmes. Genève, Suisse. Organisation mondiale de la santé 2001.
2. Processus de soins de l’anémie. Le processus d’anémie. Proceso asistencial integrado (Séville) Conserjería de Salud 2013. http://hdl.handle.net/10668/1683.
3. ministère de la Santé publique. Guide de pratique clinique. Diagnostic et traitement de l’anémie pendant la grossesse. 1ère édition, Quito. Direction nationale de la normalisation. 2014. http://saludgob.ec.
4. Matthew W, Domagalski, JE. Anémie ferriprive : évaluation et prise en charge. American Family Physician 2013, vol 87, 2, 98-104.
5. Baker RD. Rapport clinique Diagnostic et prévention de la carence en fer et de l’anémie ferriprive chez les nourrissons et les Jeunes enfants (0-3 ans) Pediatrics vol 126 : %, 1040-1051, 2010. http://www.bcguidelines.ca/pdf/iron_deficiency.pdf.
6. Lukens J N. Métabolisme du fer et carence en fer. Chapitre 6. Maladies du sang de la petite enfance et de l’enfance. 7-o édition.1995 Mosby.
7. OMS 1993-2005.Prévalence mondiale de l’anémie.- 1993-2005 OMS. Base de données mondiale sur l’anémie. http://whqlibdoc.who.int/publications/2008/978924159657_eng.pdf.
8. Aisen P. Conceptos actuales sobre el metabolismo del hierro1-18 ; Clínica Hematológica ; vol 10/2. Trastorno del metabolismo del hierro 1984. Salvat Editores.
9. Wick M, Pinggera W, Lehmann P. Aspects cliniques et métabolisme du fer en laboratoire, anémies. Novel concepts in the anemias of malignancies and renal and rheumatoid diseases. Cinquième édition augmentée. 2013 Springer Wien New York.
10. Rapaport S.I. Eritropoyesis. Capítulo 1, 2-5 Introducción a la hematología 1974. Salvat Editores.
11. Goddard AF, James MW ; Mcintyre AS, Scott BB ; British Society of Gastroenterology. Lignes directrices pour la prise en charge de l’anémie ferriprive. Gut. 2011 ; 60 (10) : 1309-1316.
12. Mast AE, Blinder MA, Gronosky AM, Chumley C, Scott MG. Utilité clinique du récepteur soluble de la transferrine et comparaison avec la ferritine sérique dans plusieurs populations. Clin Chem. 1998 ; 44(1) : 45-51.
13. Tefferi A, Hansen CA, Inwards DS. Comment interpréter et poursuivre une numération globulaire complète anormale chez les adultes. Mayo Clin Proc 2005, 80 : 923-936.
14. Wick M, Pinggera W, Lehmann P. Aspects cliniques et laboratoire du métabolisme du fer, anémies. Diagnostic des perturbations du métabolisme du fer. Perturbations de l’érythropoïèse. Cinquième édition, élargie.2003. Springer Wien New York.
15. Goddard AF, James MW, Mcintyre AS, Scott BB ; British Society of Gastroenterology. Lignes directrices pour la prise en charge de l’anémie ferriprive. Gut. 2011 ; 60 (10) ; 1309-1316.
16. Orkin HS, Nathan DG. Les thalassémies. Chapitre 21. Hématologie de l’enfance et de l’adolescence de Nathan et Oski. 5a Edition.1998 W. B. Saunders Company.
17. Lee GR. La microcytose et les anémies associées à une altération de la synthèse de l’hémoglobine. Chapitre 25, Wintrobe’s Cllinical Hematology. Ninth Edition.1993. LEA et FEBIGER.
18. Verga M E. Carence en fer dans la petite enfance : un immigré est-il plus à risque ? Swiss Med Wkly 2014 ; 144w14065.
19. Carter RC, Jacobson JL, Burden M et al. Anémie ferriprive et fonction cognitive dans la petite enfance. Pediatrics 2010 ; 126 (2) 427-434.
20. Mohammad Reza Sharif, Davood Kheirkhah, et al. La relation entre la carence en fer et la convulsion fébrile : une étude cas-témoin. Journal mondial des sciences de la santé. Global Journal of Health Science. 2016. Vol 8 (2)185-189.
21. Breyman C. La carence en fer pendant la grossesse. Seminars in hematol;2015 ; vol 52 (4) 339-347.
22. Fraser IS, Langhan S, Uhl- Hochgraeber K. Qualité de vie liée à la santé et poids économique des saignements utérins anormaux. Expert Rev Obstet Gynecol 2009 ; 4 (2):179-189.
23. Ioannou GN, Rockey DC, Bzyson C, Weis NS. Carence en fer et malignité gastro-intestinale : une étude de cohorte basée sur la population. Am J Med 2002. 113(4):276-280.
24. Joosten E, Ghesquiere B, Lindhoudt, et al. Évaluation gastro-intestinale supérieure et inférieure des impatiens âgés qui sont déficients en fer. Am J Med 1999 : 107 : 24.
