 |
|
Les réactions acide-base sont omniprésentes. Dans les solutions aqueuses, les acides augmentent la concentration en ions hydrogène (H+). D’autre part, les bases augmentent la concentration en ion hydroxyde (OH-). Lorsqu’un acide et une base réagissent dans une solution aqueuse, les ions H+ et OH- se combinent pour former de l’eau. Ces ions se « neutralisent » ainsi l’un l’autre :
La plupart des acides ont la formule générale HA, où A- est un anion et la plupart des bases ont la forme BOH, où B+ est un cation approprié. Les acides et les bases peuvent être regroupés en deux types généraux : les acides et les bases forts et les acides et les bases faibles. La différence entre les deux est simple : un acide fort dans une solution aqueuse se décompose à 100% en un proton (H+) et un anion (A-)
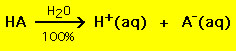
En revanche, la plupart des acides faibles se décomposent nettement moins de 100% dans une solution aqueuse :
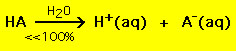 .
.En d’autres termes, la plupart des molécules d’acide faible restent intactes dans l’eau. Des équations chimiques similaires s’appliquent aux bases fortes et faibles.
Il n’y a que quelques acides et bases faibles, ce sont :
| |
|
|
HCl (acide chlorhydrique) HNO3 (acide nitrique) HClO4 (acide perchlorique) . H2SO4 (acide sulfurique) |
NaOH (hydroxyde de sodium) KOH (hydroxyde de potassium) Ca(OH)2 (hydroxyde de calcium) |
Tous les autres acides et bases sont faibles. Un acide faible résulte de n’importe quel anion. Des exemples sont donnés ci-dessous
| |
|
|
F- (fluorure) Br- (bromure) I- (iodure) HCO3- (bicarbonate) C2H3O2- (acétate) MnO4- (permanganate) PO4-3 (phosphate) CrO4-2 (chromate) CN- (cyanure) NO2- (nitrite) SO3-2 (sulfite) |
HF (acide fluorhydrique) HBr (acide bromhydrique) HI (acide iodhydrique) H2CO3 (acide carbonique) HC2H3O2 (acide acétique) HMnO4 (acide permanganique) H3PO4 (acide phosphorique) H2CrO4 (acide chromique) HCN (acide cyanhydrique) HNO2 (acide nitreux) H2SO3 (acide sulfureux) |
Dans une réaction acide/base typique, l’acide et la base réagissent pour former un sel et de l’eau, par ex.g., l’acide cyanhydrique et l’hydroxyde de sodium:
