- o-Xylène Propriétés chimiques, utilisations, production
- Xylène
- Distillation de précision pour la séparation de l’O-xylène et du p-xylène
- Propriétés chimiques
- Utilisations
- Méthode de production
- Catégorie
- Gradation de la toxicité
- Toxicité aiguë
- EXPLOSIFS et CARACTÉRISTIQUES DANGEREUSES
- Inflammabilité et caractéristiques dangereuses
- Caractéristiques de stockage et de transport
- Agent extincteur
- Norme professionnelle
- Propriétés chimiques
- Propriétés physiques
- Utilisations
- Définition
- Référence(s) de synthèse
- Description générale
- Air &Réactions avec l’eau
- Profil de réactivité
- Danger pour la santé
- Danger d’incendie
- Réactivité chimique
- Profil de sécurité
- Source
- Devenir environnemental
- Méthodes de purification
o-Xylène Propriétés chimiques, utilisations, production
Xylène
Le xylène désigne l’hydrocarbure aromatique dont les deux atomes d’hydrogène du cycle benzénique sont substitués par deux groupes méthyles. Il possède trois isomères : o-xylène (1, 2-Diméthylbenzène), m-xylène et p-xylène. Les produits industriels sont les mélanges des trois isomères avec 10% d’o-10%, 70% de m-, et 20% de p-. Dans l’industrie de la cokéfaction, c’est l’un des produits raffinés du benzène brut.
Le xylène est une sorte de liquide inflammable incolore ; le point de fusion du o-, m-et p-xylène est de-25,2 ℃,-47,9 ℃ et 13,3 ℃ ; les points d’ébullition sont respectivement de 144.4 ℃, 139,1 ℃ et 138,3 ℃ tandis que la densité relative est respectivement de 0,8802, 0,8642 et 0,8611 ; il n’est pas soluble dans l’eau mais miscible avec de nombreux types de solvants organiques immiscibles. Lors de l’oxydation catalytique, ils génèrent respectivement, l’anhydride phtalique, l’acide isophtalique et l’acide téréphtalique.
Le xylène est un type de matières premières importantes des produits chimiques organiques, existant naturellement dans le goudron de charbon et certains types de pétrole. Il peut être obtenu par le fractionnement de la partie huile légère du goudron de houille ou par le reformage catalytique de l’essence légère. L’industrie effectue principalement l’extraction en utilisant la fraction C8 dans les reformats de naphta. Il peut également être fabriqué par la réaction de disproportionnement du toluène en présence d’un catalyseur et à haute température et haute pression. À l’heure actuelle, l’industrie applique principalement la méthode de cristallisation cryogénique, d’adsorption et de formation de complexes ou de tamis moléculaires pour les séparer. Le O-xylène a un point d’ébullition relativement élevé, pouvant être séparé par distillation. Le p-xylène a également un point de fusion élevé et peut être purifié par cristallisation fractionnée. Le xylène mélangé sans séparation peut être directement utilisé comme solvant, en étant complété à l’essence capable d’améliorer les propriétés anti-explosives. Ce sont des composants de l’essence d’aviation. L’o-xylène est principalement utilisé pour la préparation de l’anhydride phtalique, qui est une matière première importante pour la fabrication de divers colorants et indicateurs (comme la phénolphtaléine). En outre, l’o-xylène peut également être utilisé pour la préparation de résine polyester, d’insectifuge, de plastifiants et de colorants. Le M-xylène, par nitration et réduction, peut générer la 4,6-diméthyl-1,3-phénylènediamine qui est l’intermédiaire pour les colorants synthétiques. Le M-xylène peut également être utilisé comme matière première pour les parfums synthétiques (tels que le musc de xylène). Le p-xylène est principalement utilisé dans la fabrication de l’acide téréphtalique, qui est une matière première importante pour la fibre de polyester synthétique (polyester).
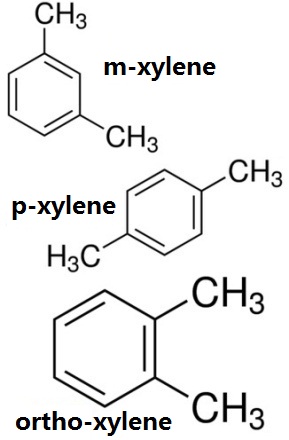
Figure 1 la structure chimique des trois isomères du xylène, ortho-xylène, m-xylène, p-xylène structure chimique.
Les informations ci-dessus sont éditées par Chemicalbook.
Distillation de précision pour la séparation de l’O-xylène et du p-xylène
Le xylène est présenté dans le benzène brut cokéfié et l’huile de craquage de pétrole. Le benzène brut, après une première distillation, un lavage à l’acide sulfurique et une distillation pour la séparation du benzène et du toluène, suivie d’une distillation, on peut obtenir du xylène, également appelé xylène cokéfié. La qualité du xylène cokéfié dépend de la capacité de séparation de la colonne de distillation, de la température en tête de colonne et du taux de reflux. La Chine a classé les produits de xylène cokéfié en trois niveaux. Le xylène de cokéfaction contient généralement 16% d’o-xylène, 50% de m-xylène, 21% de p-xylène et 7% d’éthylbenzène. Le xylène produit dans l’industrie pétrolière a une faible teneur en m-xylène et une forte teneur en éthylbenzène. Le xylène industriel est non seulement le solvant et l’additif de l’industrie du caoutchouc et des revêtements, mais aussi les additifs des carburants pour l’aviation et l’énergie. L’o-xylène, le m-xylène et le p-xylène séparés du xylène industriel sont les matières premières de l’acide phtalique, de l’acide isophtalique et de l’acide téréphtalique, respectivement. L’acide phtalique et l’acide téréphtalique sont utilisés dans la production de plastifiants, de résines de polyester et de fibres de polyester. Le M-xylène peut être utilisé seul comme solvant et additif de carburant. L’o-xylène contenu dans le xylène industriel présente une différence de plus de 5,2 ℃ avec les autres isomères. Avec une distillation de précision, nous pouvons obtenir de l’o-xylène avec une pureté de plus de 95%, suivie de l’utilisation de la sulfonation et de la distillation pour la purification, de sorte que nous pouvons obtenir de l’o-xylène encore plus pur.
Le xylène appartient aux bases de Lewis, qui peuvent former un complexe polaire avec HF-BF3 (acide de Lewis). L’alcalinité du M-xylène est environ 100 fois plus forte que celle des autres aromatiques C8. Lorsque le mélange d’isomères du xylène entre en contact avec le solvant HF-BF3, le m-xylène peut former un complexe avec le fluorure et est extrait préférentiellement dans la phase fluorée. La phase fluorure contenant du m-xylène est chauffée à une pression plus faible pour décomposer le complexe, séparant ainsi le m-xylène du mélange. Le solvant HF-BF3 peut être récupéré par distillation pour être recyclé. Si la matière première est un mélange d’ortho-xylène, de m-xylène et de p-xylène, après l’extraction du m-xylène, on peut encore utiliser la distillation de précision pour séparer l’o-xylène et le p-xylène.
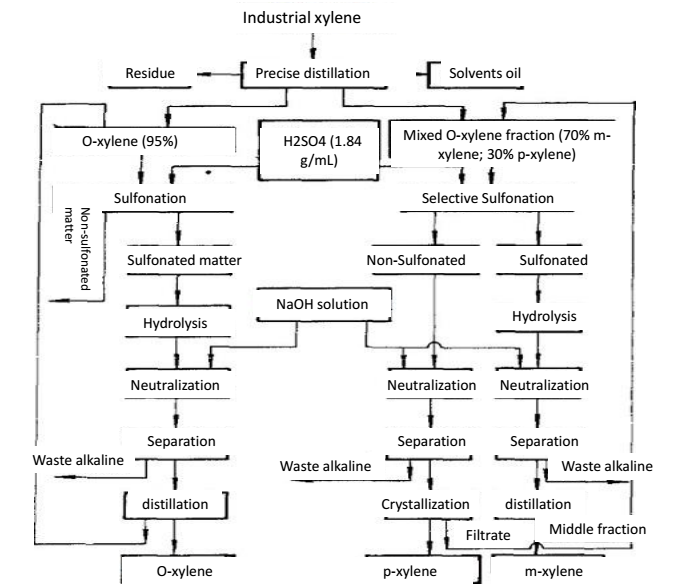
Figure 2 la méthode de distillation de précision pour la séparation de l’o-xylène et du p-xylène.
Propriétés chimiques
Il se présente comme un liquide transparent incolore avec une odeur aromatique. Il est miscible avec l’éthanol, l’éther éthylique, l’acétone et le benzène mais insoluble dans l’eau.
Utilisations
(1) Il est principalement utilisé dans la production d’anhydride phtalique
(2) L’O-xylène est la matière première pour la production du germicide fenramine, du peptide tétrachlorophényle et de l’herbicide bensulfuron-méthyle. Il est utilisé comme intermédiaire pour la fabrication de l’acide o-méthyl benzoïque.
(3) Il est principalement utilisé comme matière première chimique et comme solvant. Il peut être utilisé pour produire de l’anhydride phtalique, des colorants, des pesticides et des médicaments, tels que des vitamines. Il peut également être utilisé comme additifs pour l’essence d’aviation.
(4) Utilisé comme normes chromatographiques et solvants
(5) Comme matières premières de la synthèse de l’anhydride et d’autres synthèses organiques ;
Méthode de production
L’industrie a appliqué la méthode de super-distillation pour séparer l’o-xylène du xylène mixte. L’o-xylène a une différence de plus de 5 ℃ dans le point d’ébullition par rapport aux autres composants du xylène mixte. Pour la distillation, le nombre de plateaux requis est d’environ 150 ; le taux de reflux étant de 5-8 et consomme relativement beaucoup d’énergie.
L’o-xylène était à l’origine principalement produit à partir de goudron de houille. Actuellement, la plupart de la production nationale et étrangère d’o-xylène se fait principalement par extraction à partir du reformage catalytique du pétrole et du craquage thermique des hydrocarbures aromatiques. Les structures de l’o-xylène, du p-xylène et du m-xylène dans le xylène étant très similaires, leurs paramètres physiques sont également assez semblables. La séparation industrielle de l’o-xylène adopte principalement la méthode de super-distillation ; d’abord séparer l’o-xylène et l’éthylbenzène du xylène mélangé qui demande l’utilisation d’une tour de distillation de 100~150 plateaux ; ensuite la séparation de l’o-xylène et de l’éthylbenzène pour obtenir l’o-xylène pur.
Catégorie
Liquides inflammables
Gradation de la toxicité
empoisonnement
Toxicité aiguë
DL0 orale-rat : 5000 mg/kg ; DL50 injection abdominale-souris : 1364 mg/kg
EXPLOSIFS et CARACTÉRISTIQUES DANGEREUSES
étant explosif lorsqu’il est mélangé à l’air
Inflammabilité et caractéristiques dangereuses
étant inflammable à la flamme, à la chaleur, à l’oxydant Inflammable à la combustion libérant une fumée irritante
Caractéristiques de stockage et de transport
entrepôt : ventilé, à basse température et sec ; charger et décharger doucement ; le stocker séparément des oxydants et des acides.
Agent extincteur
eau en brouillard, mousse, sable, dioxyde de carbone, 1211 agent extincteur
Norme professionnelle
TLV-TWA 100 PPM (440 mg/m 3) ; STEL 150 ; PPM (655 mg/m 3)
Propriétés chimiques
liquide incolore
Propriétés physiques
Liquide clair et incolore avec une odeur aromatique. Une concentration seuil de l’odeur de 380 ppbv a été rapportée par Nagata et Takeuchi (1990).
Utilisations
Préparation de l’acide phtalique, de l’anhydride phtalique, de l’acide téréphtalique, de l’acide isophtalique ; solvant pour les résines alkydes, les laques, les émaux, les ciments de caoutchouc ; fabrication de colorants, de produits pharmaceutiques et d’insecticides ; carburants.
Définition
ChEBI : Un xylène substitué par des groupes méthyles en positions 1 et 3.
Référence(s) de synthèse
Journal of the American Chemical Society, 97, p. 7262, 1975 DOI : 10.1021/ja00858a011
The Journal of Organic Chemistry, 44, p. 2185, 1979 DOI : 10.1021/jo01327a032
Description générale
Liquide aqueux incolore à odeur douce. Moins dense que l’eau. Insoluble dans l’eau. Vapeur irritante.
Air &Réactions avec l’eau
Facilement inflammable. Insoluble dans l’eau.
Profil de réactivité
Le 1,2-diméthylbenzène peut réagir avec les matières oxydantes. .
Danger pour la santé
Les vapeurs provoquent des maux de tête et des vertiges. Le liquide irrite les yeux et la peau. En cas de pénétration dans les poumons, provoque une toux grave, une détresse et un œdème pulmonaire à développement rapide. En cas d’ingestion, provoque des nausées, des vomissements, des crampes, des maux de tête et le coma. Peut être mortel. Des lésions rénales et hépatiques peuvent survenir.
Danger d’incendie
Comportement en cas d’incendie : Les vapeurs sont plus lourdes que l’air et peuvent parcourir une distance considérable jusqu’à une source d’inflammation et provoquer un retour de flamme.
Réactivité chimique
Réactivité avec l’eau Aucune réaction ; Réactivité avec les matériaux communs : Aucune réaction ; Stabilité pendant le transport : Stable ; Agents de neutralisation des acides et des caustiques : Non pertinent ; Polymérisation : Non pertinent ; Inhibiteur de polymérisation : Non pertinent.
Profil de sécurité
Modérément toxique bj7voie intrapéritonéale. Modérément toxique par ingestion et inhalation. Un agent tératogène expérimental. Un contaminant commun de l’air. Très dangereux en cas d’exposition à la chaleur ou aux flammes. Explosif sous forme de vapeur lorsqu’il est exposé à la chaleur ou aux flammes. Pour combattre le feu, utiliser de la mousse, du CO2, de la poudre chimique. Incompatible avec les matériaux oxydants. Lorsqu’il est chauffé jusqu’à décomposition, il émet une fumée âcre et des fumées irritantes. Émis par les matériaux de construction modernes (CENEAR69,22,91). Voir aussi les autres entrées relatives au xylène.
Source
Détecté dans les fractions solubles dans l’eau distillée de l’essence 87 octane (3,83 mg/L), de l’essence 94 octane (11,4 mg/L), du Gasohol (8,49 mg/L), du mazout no 2 (1,73 mg/L), du carburéacteur A (0.87 mg/L),carburant diesel (1,75 mg/L), carburéacteur militaire JP-4 (1,99 mg/L) (Potter, 1996), huile moteur neuve (16,2 à 17,5 μg/L) et huile moteur usagée (294 à 308 μg/L) (Chen et al, 1994). Le pourcentage volumique moyen et la fraction molaire estimée dans l’essence PS-6 de l’American Petroleum Institute sont respectivement de 2,088 et 0,01959 (Poulsen et al., 1992). Schauer et al. (1999) ont signalé la présence d’o-xylène dans les gaz d’échappement d’un camion moyen à moteur diesel à un taux d’émission de 830 μg/km. Le carburant diesel obtenu d’une station-service à Schlieren, en Suisse, contenait de l’o-xylène à une concentration de 223 mg/L (Schluep etal., 2001).
L’essence reformulée Phase II de la Californie contenait de l’o-xylène à une concentration de 19,7 g/kg.
Les taux d’émission d’échappement en phase gazeuse d’automobiles à essence avec et sans convertisseur catalytique étaient de 5,41 et 562 mg/km, respectivement (Schauer et al, Thomas et Delfino (1991) ont mis en équilibre des eaux souterraines exemptes de contaminants recueillies à Gainesville, en Floride, avec des fractions individuelles de trois produits pétroliers à 24-25 °C pendant 24 heures. Les concentrations moyennes de m+p-xylène rapportées dans les fractions hydrosolubles de l’essence sans plomb, du kérosène et du carburant diesel étaient de 8,611, 0,658 et 0,228 mg/L, respectivement. Lorsque les auteurs ont analysé la phase aqueuse au moyen de la méthode d’essai 610 approuvée par l’EPA des États-Unis, les concentrations moyennes de m+p-xylène dans les fractions hydrosolubles de l’essence sans plomb, du kérosène et du carburant diesel étaient inférieures, soit 6,068, 0,360 et 0,222 mg/L respectivement. D’après l’analyse en laboratoire de 7 échantillons de goudron de houille, les concentrations d’o-xylène variaient de 2 à 2 000 ppm (EPRI, 1990). Un goudron de houille à haute température contenait de l’o-xylène à une concentration moyenne de 0,04 % en poids (McNeil, 1983).
Schauer et al. (2001) ont mesuré les taux d’émission de composés organiques volatils, de composés organiques semi-volatils en phase gazeuse et de composés organiques en phase particulaire provenant de la combustion résidentielle (foyer) de pins, de chênes et d’eucalyptus. Le taux d’émission d’o-xylène en phase gazeuse était de 18,1 mg/kg de pin brûlé. Les taux d’émission d’o-xylène n’ont pas été mesurés lors de la combustion du chêne et de l’eucalyptus.
Norme pour l’eau potable (finale) : Pour tous les xylènes, la MCLG et la MCL sont toutes deux de 10 mg/l. En outre, une DWEL de 70 mg/L a été recommandée (U.S. EPA, 2000).
Devenir environnemental
Biologique. Les produits de biodégradation signalés du produit commercial contenant du xylène comprennent l’acide α-hydroxy-p-toluique, l’alcool p-méthylbenzylique, l’alcool benzylique, le 4-méthylcatéchol, les acides mandp-toluiques (Fishbein, 1985). L’o-xylène a également été cométabolisé, entraînant la formation d’acide o-toluique (Pitter et Chudoba, 1990). Dans les eaux souterraines anoxiques près de Bemidji, MI, l’o-xylène s’est biodégradé de façon aérobie en acide o-toluique intermédiaire (Cozzarelli et al., 1990). Dans les eaux souterraines contaminées par de l’essence, l’acide méthylbenzylsuccinique a été identifié comme le premier intermédiaire au cours de la dégradation anaérobie des xylènes (Reusser et Field, 2002).
Photolytique. Cox et al. (1980) ont signalé une constante de vitesse de 1,33 x 10-11 cm3/molécule?sec pour la réaction de l’o-xylène gazeux avec les radicaux OH, en se basant sur une valeur de 8 x 10-12 cm3/molécule?sec pour la réaction de l’éthylène avec les radicaux OH.
Eau de surface. La demi-vie d’évaporation de l’o-xylène dans les eaux de surface (1 m de profondeur) à 25 °C est estimée à 5,18 h (Mackay et Leinonen, 1975).
Eau souterraine. Nielsen et al. (1996) ont étudié la dégradation de l’o-xylène dans un aquifère sableux non confiné, peu profond et fluvioglaciaire du Jutland, au Danemark. Dans le cadre de l’étude in situ du microcosme, un cylindre ouvert au fond et grillagé au sommet a été installé dans un trou de forage tubé à environ 5 m sous le niveau du sol. Cinq litres d’eau ont été aérés avec de l’air atmosphérique pour s’assurer que les conditions aérobies étaient maintenues. Les eaux souterraines ont été analysées chaque semaine pendant environ 3 mois pour déterminer les concentrations d’o-xylène en fonction du temps. La constante de vitesse de biodégradation de premier ordre déterminée expérimentalement et la demi-vie correspondante après une phase de latence de 7 jours étaient respectivement de 0,1/d et 6,93 d.
Photolytique. Lorsque de l’air synthétique contenant de l’acide nitreux gazeux et de l’o-xylène a été exposé à une lumière solaire artificielle (λ = 300-450 nm), le biacétyle, le nitrate de peroxyacétal et le nitrate de méthyle se sont formés comme produits (Cox et al., 1980). Une solution de n-hexane contenant de l’o-xylène et étalée sous forme de film mince (4mm) sur de l’eau froide (10 °C) a été irradiée par une lampe à moyenne pression au mercure. En 3 heures, 13,6% de l’o-xylène s’est photooxydé en o-méthylbenzaldéhyde, alcool o-benzylique, acide o-benzoïque et ométhylacétophénone (Moza et Feicht, 1989). L’irradiation de l’o-xylène à ≈ 2537 ? à 35 °C et 6 mmHg s’isomérise en m-xylène (Calvert et Pitts, 1966). Le glyoxal, le méthylglyoxal et le biacétyle ont été produits par la photooxydation de l’o-xylène par les radicaux OH dans l’air à 25 °C (Tuazon et al.,1986a).
Chimique/Physique. Dans des conditions atmosphériques, la réaction en phase gazeuse de l’o-xylène avec des radicaux OH et des oxydes d’azote a entraîné la formation d’o-tolualdéhyde, de nitrate d’o-méthylbenzyle,de nitro-o-xylènes, de 2,3-et de 3,4-diméthylphénol (Atkinson, 1990). Kanno et al. (1982) ont étudié la réaction aqueuse de l’o-xylène et d’autres hydrocarbures aromatiques (benzène, toluène, m- et p-xylène, et naphtalène) avec l’acide hypochloreux en présence d’ions ammonium. Ils ont rapporté que le cycle aromatique n’a pas été chloré comme prévu mais a été clivé par la chloramine en formant du chlorure de cyanogène. La quantité de chlorure de cyanogène formée augmentait à des pH plus faibles (Kanno et al., 1982). En phase gazeuse, l’o-xylène a réagi avec les radicaux nitrates dans l’air purifié en formant les produits suivants :5-nitro-2-méthyltoluène et 6-nitro-2-méthyltoluène, o-méthylbenzaldéhyde et un nitrate d’aryle(Chiodini et al., 1993).
Méthodes de purification
o-Xylène (4,4Kg) est sulfoné par agitation pendant 4h avec 2,5L de H2SO4 conc à 95o. Après refroidissement, et séparation de la matière non sulfonée, le produit est dilué avec 3L d’eau et neutralisé avec 40% de NaOH. Après refroidissement, l’o-xylène sulfonate de sodium se sépare et est recristallisé à partir de la moitié de son poids d’eau. Le sel est dissous dans la quantité minimale d’eau froide, puis mélangé avec la même quantité d’eau froide et avec le même volume de H2SO4 conc et chauffé à 110o. L’o-xylène est régénéré et la vapeur est distillée. Le distillat est saturé avec du NaCl, la couche organique est séparée, séchée et redistillée.
