Dénomination générique : chlorhydrate de lidocaïne
Formation posologique : gelée topique
Médicalement examinée par Drugs.com. Dernière mise à jour le 1er octobre 2020.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Plus
Rx only
- DESCRIPTION
- PHARMACOLOGIE CLINIQUE
- INDICATIONS ET USAGE
- CONTRAINDICATIONS
- MISES EN GARDE
- PRECAUTIONS
- Utilisation pendant la grossesse:
- Réactions indésirables
- SURDOSAGE
- DOSAGE ET ADMINISTRATION
- DOSAGE MAXIMAL
- COMMENT FOURNIR
- Plus d’informations sur la lidocaïne topique
- Ressources pour les consommateurs
- Ressources pour les professionnels
- Guides de traitement associés
DESCRIPTION
Lidocaïne HCI 2% en gelée est un produit stérile, aqueux qui contient un agent anesthésique local et qui est administré par voie topique. (Voir INDICATIONS pour les utilisations spécifiques.)
Lidocaïne HCI 2% Gelée contient de la lidocaïne HCI qui est chimiquement désignée comme acétamide, 2-(diéthylamino)-N-(2,6-diméthylphényl)-,monochlorure et a la formule structurelle suivante:
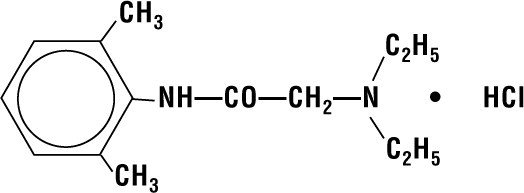
Sa formule moléculaire est C14H22N2O – HCI et son poids moléculaire est 270.80.
La gelée de lidocaïne HCI à 2% contient également de l’hypromellose, et le mélange résultant maximise le contact avec la muqueuse et fournit une lubrification pour l’instrumentation. La partie non utilisée doit être jetée après la première utilisation.
Composition de la gelée de lidocaïne HCI 2% Tubes de 30 mL et de 5 mL : Chaque mL contient 20 mg de lidocaïne HCI. La formulation contient également du méthylparabène, du propylparabène, de l’hypromellose et de l’hydroxyde de sodium et/ou de l’acide chlorhydrique pour ajuster le pH entre 6,0 et 7,0.
PHARMACOLOGIE CLINIQUE
Mécanisme d’action : La lidocaïne stabilise la membrane neuronale en inhibant les flux ioniques nécessaires à l’initiation et à la conduction des impulsions, effectuant ainsi une action anesthésique locale.
Début d’action : Le début de l’action est de 3 à 5 minutes. Il est inefficace lorsqu’il est appliqué sur une peau intacte.
Hémodynamique : Des taux sanguins excessifs peuvent entraîner des modifications du débit cardiaque, de la résistance périphérique totale et de la pression artérielle moyenne. Ces changements peuvent être attribuables à un effet dépresseur direct de l’agent anesthésique local sur divers composants du système cardiovasculaire.
Pharmacocinétique et métabolisme : La lidocaïne peut être absorbée après une administration topique sur les muqueuses, son taux et son étendue d’absorption dépendant de la concentration et de la dose totale administrée, du site spécifique d’application et de la durée d’exposition. En général, le taux d’absorption des agents anesthésiques locaux après une application topique est plus rapide après une administration intratrachéale. La lidocaïne est également bien absorbée à partir du tractus gastro-intestinal, mais peu de médicament intact peut apparaître dans la circulation en raison de la biotransformation dans le foie.
La lidocaïne est rapidement métabolisée par le foie et les métabolites et le médicament inchangé sont excrétés par les reins. La biotransformation comprend la N-déalkylation oxydative, l’hydroxylation du cycle, le clivage de la liaison amide et la conjugaison. La N-désalkylation, une voie majeure de biotransformation, donne les métabolites monoéthylglycinexylidide et glycinexylidide. Les actions pharmacologiques/toxicologiques de ces métabolites sont similaires, mais moins puissantes, que celles de la lidocaïne. Environ 90 % de la lidocaïne administrée est excrétée sous forme de divers métabolites, et moins de 10 % est excrétée sous forme inchangée. Le principal métabolite dans l’urine est un conjugué de la 4-hydroxy-2, 6-diméthylaniline.
La liaison plasmatique de la lidocaïne dépend de la concentration du médicament, et la fraction liée diminue avec l’augmentation de la concentration. A des concentrations de 1 à 4 mcg de base libre par mL, 60 à 80 % de la lidocaïne est liée aux protéines. La liaison dépend également de la concentration plasmatique de l’alpha-I-glycoprotéine acide.
La lidocaïne traverse les barrières hémato-encéphalique et placentaire, vraisemblablement par diffusion passive.
Les études sur le métabolisme de la lidocaïne après injection intraveineuse en bolus ont montré que la demi-vie d’élimination de cet agent est généralement de 1,5 à 2,0 heures. En raison de la vitesse rapide à laquelle la lidocaïne est métabolisée, toute affection qui affecte la fonction hépatique peut modifier la cinétique de la lidocaïne. La demi-vie peut être multipliée par deux ou plus chez les patients souffrant de dysfonctionnement hépatique. Le dysfonctionnement rénal n’affecte pas la cinétique de la lidocaïne mais peut augmenter l’accumulation des métabolites.
Des facteurs tels que l’acidose et l’utilisation de stimulants et de dépresseurs du SNC affectent les niveaux de lidocaïne dans le SNC nécessaires pour produire des effets systémiques manifestes. Les manifestations indésirables objectives deviennent de plus en plus apparentes avec l’augmentation des niveaux plasmatiques veineux au-dessus de 6 mcg de base libre par mL. Chez le singe rhésus, il a été démontré que des taux sanguins artériels de 18 à 21 mcg/mL sont le seuil de l’activité convulsive.
INDICATIONS ET USAGE
La gelée de lidocaïne HCI 2% est indiquée pour la prévention et le contrôle de la douleur dans les procédures impliquant l’urètre masculin et féminin, pour le traitement topique de l’urétrite douloureuse et comme lubrifiant anesthésique pour l’intubation endotrachéale (orale et nasale).
CONTRAINDICATIONS
La lidocaïne est contre-indiquée chez les patients ayant des antécédents connus d’hypersensibilité aux anesthésiques locaux de type amide ou à d’autres composants de la gelée de lidocaïne HCI 2%.
MISES EN GARDE
Une posologie excessive, ou des intervalles courts entre les doses, peuvent entraîner des niveaux élevés de la PLASMA et des effets indésirables graves. LES PATIENTS DOIVENT ÊTRE INFORMÉS QU’ILS DOIVENT SE CONFORMER STRICTEMENT À LA POSOLOGIE RECOMMANDÉE ET AUX DIRECTIVES D’ADMINISTRATION TELLES QU’ÉNONCÉES DANS CETTE NOTICE. LA PRISE EN CHARGE DES EFFETS INDÉSIRABLES GRAVES PEUT NÉCESSITER L’UTILISATION D’ÉQUIPEMENT RESUSCITATIF, D’OXYGÈNE ET D’AUTRES MÉDICAMENTS RESUSCITATIFS.
La gelée de lidocaïne HCI 2% doit être utilisée avec une extrême prudence en présence d’une septicémie ou d’une muqueuse gravement traumatisée dans la zone d’application, car dans ces conditions, il existe un potentiel d’absorption systémique rapide.
Lorsqu’elle est utilisée pour la lubrification des tubes endotrachéaux, des précautions doivent être prises pour éviter d’introduire le produit dans la lumière du tube. Ne pas utiliser la gelée pour lubrifier les stylettes endotrachéales. Si elle est introduite dans la lumière interne, la gelée peut sécher sur la surface interne en laissant un résidu qui a tendance à s’agglomérer avec la flexion, rétrécissant ainsi la lumière. De rares cas ont été rapportés où ce résidu a provoqué l’occlusion de la lumière. (Voir aussi RÉACTIONS INDÉSIRABLES et POSOLOGIE ET ADMINISTRATION.)
PRECAUTIONS
Généralités : La sécurité et l’efficacité de la lidocaïne dépendent d’un dosage approprié, d’une technique correcte, de précautions adéquates et de la préparation aux urgences. (Voir MISES EN GARDE et RÉACTIONS INDÉSIRABLES.) Il faut utiliser la plus faible dose permettant d’obtenir une anesthésie efficace afin d’éviter des taux plasmatiques élevés et des effets indésirables graves. L’administration de doses répétées de lidocaïne peut entraîner une augmentation importante des concentrations sanguines à chaque dose répétée en raison de l’accumulation lente du médicament ou de ses métabolites. La tolérance aux taux sanguins élevés varie selon l’état du patient. Les patients affaiblis, les personnes âgées, les patients gravement malades et les enfants doivent recevoir des doses réduites en fonction de leur âge et de leur état physique. La lidocaïne doit également être utilisée avec prudence chez les patients présentant un choc sévère ou un bloc cardiaque.
Lidocaïne HCI 2 % en gelée doit être utilisée avec prudence chez les patients présentant des sensibilités médicamenteuses connues. Les patients allergiques aux dérivés de l’acide para-aminobenzoïque (procaïne, tétracaïne, benzocaïne, etc.) n’ont pas montré de sensibilité croisée à la lidocaïne.
Plusieurs médicaments utilisés pendant la conduite de l’anesthésie sont considérés comme des agents déclencheurs potentiels de l’hyperthermie maligne familiale. Comme on ne sait pas si les anesthésiques locaux de type amide peuvent déclencher cette réaction et que la nécessité d’une anesthésie générale complémentaire ne peut être prévue à l’avance, il est suggéré de disposer d’un protocole standard de prise en charge. Des signes précoces et inexpliqués de tachycardie, de tachypnée, de tension artérielle labile et d’acidose métabolique peuvent précéder l’élévation de la température. Le succès de l’issue dépend d’un diagnostic précoce, de l’arrêt rapide du ou des agents déclencheurs suspects et de l’institution d’un traitement, incluant l’oxygénothérapie, les mesures de soutien indiquées et le dantrolène (consulter la notice du dantrolène sodique intraveineux avant utilisation).
Information pour les patients : Lorsque des anesthésiques topiques sont utilisés dans la bouche, le patient doit être conscient que la production de l’anesthésie topique peut altérer la déglutition et ainsi augmenter le danger d’aspiration. Pour cette raison, il ne faut pas ingérer de nourriture dans les 60 minutes suivant l’utilisation de préparations anesthésiques locales dans la bouche ou la gorge. Ceci est particulièrement important chez les enfants en raison de leur fréquence d’alimentation.
L’engourdissement de la langue ou de la muqueuse buccale peut augmenter le risque de traumatisme involontaire par morsure. Il ne faut pas prendre de nourriture ou de chewing-gum pendant que la région de la bouche ou de la gorge est anesthésiée.
Carcinogenèse – Aucune étude à long terme n’a été réalisée chez l’animal pour évaluer le potentiel cancérigène de la lidocaïne.
Mutagenèse – Le potentiel mutagène de la lidocaïne a été testé dans le test de mutation inverse d’Ames Salmonella, et dans le test d’aberrations chromosomiques in vitro sur des lymphocytes humains et dans un test du micronoyau in vivo chez la souris. Aucune indication d’un quelconque effet mutagène n’a été relevée dans ces études.
Impact sur la fertilité – L’effet de la lidocaïne sur la fertilité a été examiné dans le modèle du rat. L’administration de 30 mg/kg, s.c. (180 mg/m2) au couple d’accouplement n’a pas produit d’altération de la fertilité ou de la performance reproductive générale des rats. Aucune étude n’a examiné l’effet de la lidocaïne sur les paramètres du sperme. Il n’y a pas eu de preuve d’altération de la fertilité.
Utilisation pendant la grossesse:
Effets tératogènes : Catégorie de grossesse B.
Des études de reproduction de la lidocaïne ont été réalisées chez le rat et le lapin. Il n’y a pas eu de preuve d’effet nocif pour le fœtus à des doses sous-cutanées allant jusqu’à 50 mg/kg de lidocaïne (300 mg/m2 sur la base de la surface corporelle) dans le modèle de rat. Dans le modèle de lapin, il n’y a pas eu de preuve d’effet nocif sur le fœtus à une dose de 5 mg/kg, s.c. (60 mg/m2 sur la base de la surface corporelle). Le traitement de lapins avec 25 mg/kg (300 mg/m2) a produit des preuves de toxicité maternelle et des preuves de retard de développement foetal, y compris une diminution non significative du poids foetal (7 %) et une augmentation des anomalies squelettiques mineures (défaut du crâne et du sternum, ossification réduite des phalanges). L’effet de la lidocaïne sur le développement post-natal a été examiné chez le rat en traitant quotidiennement des femelles gravides par voie sous-cutanée à des doses de 2, 10 et 50 mg/kg (12, 60 et 300 mg/m2) à partir du 15e jour de la gestation et jusqu’à 20 jours après la naissance. Aucun signe d’effet indésirable n’a été observé ni chez les mères ni chez les petits jusqu’à la dose de 10 mg/kg (60 mg/m2) incluse ; toutefois, le nombre de petits survivants était réduit à la dose de 50 mg/kg (300 mg/m2), tant à la naissance que pendant la durée de la période de lactation, l’effet étant très probablement secondaire à la toxicité maternelle. Aucun autre effet sur la taille et le poids des portées, sur les anomalies des petits et sur leur développement physique n’a été observé dans cette étude.
Une deuxième étude a examiné les effets de la lidocaïne sur le développement post-natal chez le rat qui comprenait l’évaluation des petits du sevrage à la maturité sexuelle. Les rats ont été traités pendant 8 mois avec 10 ou 30 mg/kg, s.c. de lidocaïne (60 mg/m2 et 180 mg/m2 sur une base de surface corporelle, respectivement). Cette période a englobé 3 périodes d’accouplement. Il n’y a pas eu de preuve d’altération du développement post-natal de la progéniture ; cependant, les deux doses de lidocaïne ont réduit de manière significative le nombre moyen de petits par portée survivant jusqu’au sevrage de la progéniture des 2 premières périodes d’accouplement.
Il n’existe cependant pas d’études adéquates et bien contrôlées chez la femme enceinte. Les études de reproduction chez l’animal n’étant pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse que si cela est clairement nécessaire.
L’accouchement : La lidocaïne n’est pas contre-indiquée dans le travail et l’accouchement. Si la gelée de lidocaïne HCl 2% est utilisée en même temps que d’autres produits contenant de la lidocaïne, la dose totale apportée par toutes les formulations doit être gardée à l’esprit.
Mères allaitantes : La lidocaïne est sécrétée dans le lait maternel. La signification clinique de cette observation est inconnue. La prudence est de mise lorsque la lidocaïne est administrée à une femme qui allaite.
Utilisation pédiatrique : Bien que l’innocuité et l’efficacité de la gelée de lidocaïne à 2 % chez les patients pédiatriques n’aient pas été établies, une étude menée auprès de 19 nouveau-nés prématurés (âge gestationnel <33 semaines) n’a révélé aucune corrélation entre la concentration plasmatique de lidocaïne ou de monoéthylglycinexylidide et le poids corporel du nourrisson lorsque des quantités modérées de lidocaïne (c.-à-d. 0,3 mL/kg de gel de lidocaïne à 20 mg/mL) étaient utilisées pour lubrifier les tubes intranasaux et endotrachéaux. Aucun nouveau-né n’a présenté des taux plasmatiques de lidocaïne supérieurs à 750 mcg/L. Chez les enfants, les doses doivent être réduites en fonction de l’âge, du poids corporel et de la condition physique. (Voir POSOLOGIE ET ADMINISTRATION.)
Réactions indésirables
Les expériences indésirables suivant l’administration de la lidocaïne sont de nature similaire à celles observées avec d’autres agents anesthésiques locaux de type amide. Ces effets indésirables sont, en général, liés à la dose et peuvent résulter de taux plasmatiques élevés causés par une dose excessive ou une absorption rapide, ou peuvent résulter d’une hypersensibilité, d’une idiosyncrasie ou d’une tolérance diminuée de la part du patient. Les effets indésirables graves sont généralement de nature systémique. Les types suivants sont ceux qui sont le plus fréquemment rapportés :
On a rapporté de rares cas d’occlusion de tube endotrachéal associés à la présence de résidus de gelée séchée dans la lumière interne du tube. (Voir aussi MISES EN GARDE et POSOLOGIE ET ADMINISTRATION.)
Système nerveux central : Les manifestations du SNC sont excitatrices et/ou dépressives et peuvent être caractérisées par une sensation de tête légère, de la nervosité, de l’appréhension, de l’euphorie, de la confusion, des étourdissements, de la somnolence, des acouphènes, une vision floue ou double, des vomissements, des sensations de chaleur, de froid ou d’engourdissement, des secousses, des tremblements, des convulsions, une perte de conscience, une dépression respiratoire et un arrêt. Les manifestations excitatrices peuvent être très brèves ou ne pas se produire du tout, auquel cas la première manifestation de toxicité peut être une somnolence se confondant avec une perte de conscience et un arrêt respiratoire.
La somnolence après l’administration de lidocaïne est généralement un signe précoce d’un taux sanguin élevé du médicament et peut se produire en conséquence d’une absorption rapide.
Système cardiovasculaire : Les manifestations cardiovasculaires sont généralement dépressives et se caractérisent par une bradycardie, une hypotension et un collapsus cardiovasculaire pouvant conduire à un arrêt cardiaque.
Allergique : Les réactions allergiques se caractérisent par des lésions cutanées, une urticaire, un œdème ou des réactions anaphylactoïdes. Les réactions allergiques peuvent survenir à la suite d’une sensibilité soit à l’agent anesthésique local, soit à d’autres composants de la formulation. Les réactions allergiques résultant d’une sensibilité à la lidocaïne sont extrêmement rares et, si elles se produisent, elles doivent être prises en charge par des moyens conventionnels. La détection de la sensibilité par des tests cutanés a une valeur douteuse.
SURDOSAGE
Les urgences aiguës dues aux anesthésiques locaux sont généralement liées aux taux plasmatiques élevés rencontrés lors de l’utilisation thérapeutique des anesthésiques locaux. (Voir RÉACTIONS INDÉSIRABLES, MISES EN GARDE et PRÉCAUTIONS.)
Gestion des urgences liées aux anesthésiques locaux : La première considération est la prévention, le meilleur moyen d’y parvenir est de surveiller attentivement et constamment les signes vitaux cardiovasculaires et respiratoires ainsi que l’état de conscience du patient après chaque administration d’anesthésique local. Au premier signe de changement, il faut administrer de l’oxygène.
La première étape de la prise en charge des convulsions consiste à accorder une attention immédiate au maintien d’une voie aérienne perméable et à une ventilation assistée ou contrôlée avec de l’oxygène et un système d’administration capable de permettre une pression positive immédiate des voies aériennes par masque. Immédiatement après la mise en place de ces mesures de ventilation, il faut évaluer l’adéquation de la circulation, en gardant à l’esprit que les médicaments utilisés pour traiter les convulsions peuvent parfois déprimer la circulation lorsqu’ils sont administrés par voie intraveineuse. Si les convulsions persistent malgré une assistance respiratoire adéquate, et si l’état de la circulation le permet, de petites doses d’un barbiturique à action ultra-courte (comme le thiopental ou le thiamylal) ou d’une benzodiazépine (comme le diazépam) peuvent être administrées par voie intraveineuse. Le clinicien doit connaître ces anticonvulsivants avant d’utiliser les anesthésiques locaux. Le traitement de soutien de la dépression circulatoire peut nécessiter l’administration de liquides intraveineux et, le cas échéant, d’un vasopresseur en fonction de la situation clinique (par exemple, éphédrine).
Si elles ne sont pas traitées immédiatement, les convulsions et la dépression cardiovasculaire peuvent toutes deux entraîner une hypoxie, une acidose, une bradycardie, des arythmies et un arrêt cardiaque. Si un arrêt cardiaque devait se produire, des mesures de réanimation cardio-pulmonaire standard devraient être instituées.
La dialyse a une valeur négligeable dans le traitement du surdosage aigu de lidocaïne.
La DL50 orale de la lidocaïne HCI chez les rats femelles non à jeun est de 459 (346 à 773) mg/kg (sous forme de sel) et de 214 (159 à 324) mg/kg (sous forme de sel) chez les rats femelles à jeun.
DOSAGE ET ADMINISTRATION
Lorsque la gelée de lidocaïne HCI 2% est utilisée en concomitance avec d’autres produits contenant de la lidocaïne, la dose totale apportée par toutes les formulations doit être gardée à l’esprit.
La posologie varie et dépend de la zone à anesthésier, de la vascularisation des tissus, de la tolérance individuelle et de la technique d’anesthésie. La dose la plus faible nécessaire pour obtenir une anesthésie efficace doit être administrée. Les doses doivent être réduites chez les enfants, les personnes âgées et les patients débilités. Bien que l’incidence des effets indésirables avec la gelée de Lidocaïne HCI 2 % soit assez faible, il convient d’être prudent, en particulier lors de l’emploi de grandes quantités, car l’incidence des effets indésirables est directement proportionnelle à la dose totale d’agent anesthésique local administrée.
Pour l’anesthésie de surface de l’urètre de l’adulte mâle : Lors de l’utilisation de tubes de 30 mL de gelée de lidocaïne à 2 %, stériliser le cône en plastique pendant 5 minutes dans l’eau bouillante, le refroidir et le fixer au tube. Le cône peut être stérilisé au gaz ou à froid, selon les préférences. Instillez lentement environ 15 ml (300 mg de lidocaïne HCI) dans l’urètre ou jusqu’à ce que le patient ait une sensation de tension. Un clamp pénien est ensuite appliqué pendant plusieurs minutes au niveau de la couronne. Une dose supplémentaire ne dépassant pas 15 mL (300 mg) peut être instillée pour une anesthésie adéquate.
Avant le sondage ou la cystoscopie, un clampage pénien doit être appliqué pendant 5 à 10 minutes pour obtenir une anesthésie adéquate. Une dose totale de 30 ml (600 mg) est généralement nécessaire pour remplir et dilater l’urètre masculin.
Avant le sondage, des volumes plus faibles de 5 à 10 ml (100 à 200 mg) sont généralement suffisants pour la lubrification.
Pour l’anesthésie de surface de l’urètre de la femme adulte : Lors de l’utilisation de tubes de 30 mL de gelée de lidocaïne à 2 %, stériliser le cône en plastique pendant 5 minutes dans l’eau bouillante, le refroidir et le fixer au tube. Le cône peut être stérilisé au gaz ou à froid, selon les préférences. Instiller lentement 3 à 5 ml (60 à 100 mg de lidocaïne HCI) de gelée dans l’urètre. Si on le souhaite, une partie de la gelée peut être déposée sur un coton-tige et introduite dans l’urètre. Afin d’obtenir une anesthésie adéquate, il faut laisser passer plusieurs minutes avant d’effectuer des procédures urologiques.
Lubrification pour l’intubation endotrachéale : Appliquer une quantité modérée de gelée sur la surface externe du tube endotrachéal peu avant son utilisation. Il faut veiller à ne pas introduire le produit dans la lumière de la sonde. Ne pas utiliser la gelée pour lubrifier les stylettes endotrachéales. Voir les sections MISES EN GARDE et EFFETS INDÉSIRABLES concernant les rares cas d’occlusion de la lumière interne. Il est également recommandé d’éviter l’utilisation de tubes endotrachéaux dont la surface externe est recouverte de gelée séchée en raison du manque d’effet lubrifiant.
DOSAGE MAXIMAL
On ne doit pas administrer plus de 600 mg de lidocaïne HCI par période de 12 heures.
Enfants : Il est difficile de recommander une posologie maximale de tout médicament pour les enfants car celle-ci varie en fonction de l’âge et du poids. Pour les enfants de moins de dix ans qui ont une masse corporelle maigre normale et un développement normal du corps maigre, la dose maximale peut être déterminée par l’application d’une des formules pédiatriques standard pour les médicaments (par exemple, la règle de Clark). Par exemple, chez un enfant de cinq ans pesant 50 livres, la dose de chlorhydrate de lidocaïne ne doit pas dépasser 75 à 100 mg lorsqu’elle est calculée selon la règle de Clark. Dans tous les cas, la quantité maximale de Lidocaïne HCI administrée ne doit pas dépasser 4,5 mg/kg (2 mg/lb) de poids corporel.
COMMENT FOURNIR
La gelée de lidocaïne HCI à 2% est fournie dans les formes posologiques énumérées.
NDC 17478-840-30 Tube en aluminium de 30 ml
NDC 17478-840-05 Tube en aluminium de 5 ml
Un cône applicateur détachable et une clé pour exprimer le contenu sont inclus dans le carton de 30 ml.
Stockage : Conserver entre 20° et 25°C (68° et 77°F) .
PREMIERProRx®
Fabriqué par :
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® est une marque déposée de Premier Inc, utilisée sous licence.
PLD00N Rev. 10/15
Texte du panneau d’affichage principal pour l’étiquette du contenant :
NDC 17478-840-05 Logo Premier
Gelée de chlorhydrate de lidocaïne USP, 2%
Rx seulement
Stérile 5 mL

Texte du panneau d’affichage principal pour l’étiquette du carton :
NDC 17478-840-05 Stérile 5 mL
Gelée de chlorhydrate de lidocaïne USP, 2%
Rx only
Premier Logo

| LIDOCAINE chlorhydrate de lidocaïne en gelée |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Étiqueteur – Akorn, Inc. (117696770)
Déclarant – Akorn Operating Company LLC (117693100)
| Etablissement | |||
| Nom | Adresse | ID/FEI | Opérations |
| Akorn, Inc | 117696840 | Fabrication(17478-840), ANALYSE(17478-840), STERILISATION(17478-840), EMBALLAGE(17478-840), ETIQUETAGE(17478-840) | |
Plus d’informations sur la lidocaïne topique
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations sur la posologie
- Interactions médicamenteuses
- Comparer les alternatives
- Prix &Coupons
- En Español
- 208 Reviews
- Classe de médicaments : Anesthésiques topiques
- Alertes de la FDA (5)
.
Ressources pour les consommateurs
- Information pour les patients
- Lidocaïne application topique (Lecture avancée)
Ressources pour les professionnels
.
- Information posologique
- Lidocaïne (application topique) (Conseils professionnels aux patients)
- Crème de lidocaïne (FDA)
- Gel de lidocaïne (FDA)
- Solution laryngotrachéale de lidocaïne (FDA)
- … +9 more
Autres marques Lidocaine Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 more
Guides de traitement associés
- Démangeaisons anales
- Chirurgie gastro-intestinale
- Anesthésie
- Brûlures externes
- … +9 autres
Avis médical
