Introduction de la cycline
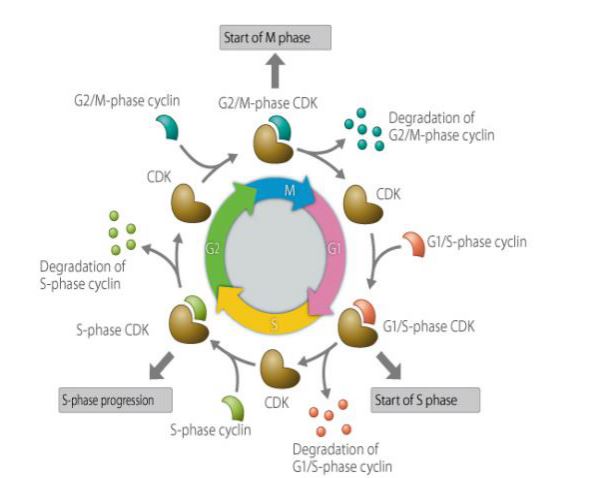
La cycline est un type de protéine qui s’exprime, s’accumule et se décompose dans un cycle cellulaire, et elle interagit avec les kinases dépendantes de la cycline pour affecter la fonction du cycle cellulaire. La cycline est impliquée dans les protéines régulées par le cycle cellulaire, et sa concentration est cyclique et cyclique dans le cycle cellulaire. Selon l’étape du cycle cellulaire, sa concentration peut parfois atteindre plusieurs milliers de fois, et parfois elle tombe à zéro. En tant que sous-unité régulatrice, la cycline se lie aux protéines kinases dépendantes de la cycline et les active. Différentes cyclines sont exprimées à différentes périodes du cycle cellulaire. Dans les cellules de mammifères, la cycline A commence à s’exprimer et s’accumule progressivement au début de la phase G1, atteignant la jonction G1/S, et le contenu atteint le maximum et reste dans la phase G2/M. La cycline B est exprimée à partir de la fin de la phase G1 et s’accumule progressivement. Elle atteint le maximum à la fin de la phase G2 et se maintient jusqu’au milieu de la phase M, puis se dégrade rapidement. La cycline D, qui est une cycline de la phase G1, est continuellement exprimée dans le cycle cellulaire, tandis que la cycline E commence à s’exprimer et s’accumule progressivement à la fin de la phase M et au début de la phase G1, atteignant le maximum à la fin de la phase G1, puis se maintient jusqu’à la fin de la phase G2. Les cyclines jouent un rôle important dans la régulation du cycle cellulaire. L’étude du mécanisme des cyclines a une grande importance pour le traitement du cancer.
Les membres de la famille des cyclines et leurs fonctions respectives
Jusqu’à présent, les cyclines humaines ont été isolées et nommées dans un total de 8 catégories, à savoir A à H, et comprennent quelques sous-classes (comme la cycline D1, D2, D3), dont F, G, H sont les dernières découvertes. Toutes les cyclines présentent certaines similitudes de séquence d’acides aminés et servent ainsi de marqueurs structurels moléculaires des cyclines. Cette région d’acides aminés homologues dans la cycline est ce qu’on appelle la cassette de la cycline, qui est une région de séquence de 100 à 150 acides aminés hautement conservée entre les cyclines de divers organismes. La cycline humaine contient également une cassette défectueuse ou une région de séquence d’acides aminés riche en résidus de proline, d’acide glutamique, d’acide aspartique, de sérine et de thréonine (ci-après dénommée région de séquence d’acides aminés PEST). La liaison de la cycline B à la kinase cycline-dépendante p34CDC2 contrôle l’entrée et la sortie de la mitose. La cycline B est synthétisée de la phase S à la phase G2 /M, et s’accumule progressivement et se lie à p34CDC2. Dans la phase M, elle se dégrade progressivement ; au contraire, la sortie de la phase M dépend de la dégradation rapide de la cycline dans la phase tardive de la division, ce qui entraîne la libération de la sous-unité inactive p34CDC2. Dans les cellules humaines, la cycline B s’accumule dans le cytoplasme et pénètre dans le noyau avant la disparition de la membrane nucléaire. Une fois activée, la cycline B/CDC phosphoryle un groupe de protéines, dont la lamine, la vimentine et le calcium, ce qui joue un rôle important dans la concentration des chromosomes, la désintégration de la membrane nucléaire, la dépolymérisation des filaments intermédiaires et la réorganisation des microfilaments. La cycline B joue également un rôle important dans la transition de phase de la mitose, qui est une protéine classique du cycle de clivage. La cycline A joue un rôle à la fois dans les transitions de phase G2/M et G1/S. Elle apparaît avant le début de la synthèse de l’ADN, et elle augmente progressivement jusqu’au stade de pré-coupure et se dégrade au stade intermédiaire. Lorsqu’elle induit la mitose, elle diffère de la véritable cycline B mitotique par de nombreux aspects. La teneur en cycline C change peu tout au long du cycle cellulaire, avec seulement une légère augmentation au début de G1. L’ARNm de la cycline C atteint un pic au milieu de G1 dans les cellules HeLa synchronisées, ce qui est plus précoce que la cycline A, qui peut avoir un rôle dans G1. La cycline E a une expression périodique distincte dans le cycle cellulaire, et son pic se situe dans la transition de phase G1 /S. Elle a pour fonction de contrôler le cycle cellulaire. Elle a pour fonction de contrôler l’entrée de la cellule dans la phase S, ce qui peut être le facteur limitant la vitesse de la transition de phase G1 /S. Dans les cellules de mammifères, comme la cycline A, elle se lie à p33CDK2, un complexe qui a une activité de kinase de l’histone H1 au début de la G1 et de la S, mais la cycline A et E peut interagir avec la protéine du rétinoblastome pour séparer les complexes, ce qui suggère que les complexes CDK2/cycline A ou E peuvent réguler indirectement l’expression des gènes dans les phases G1 et S. La cycline E peut jouer un rôle dans la cycline D, qui joue un rôle important dans l’initiation de la réplication de l’ADN, la conversion G1 /S, et sa surexpression accélère l’entrée des cellules en phase S. La cycline D peut contrôler le début de la phase G1 du processus, avant ou en même temps que la cycline E. La cycline D a trois sous-types (D1, D2, D3), et son expression varie d’une cellule à l’autre, et est contrôlée par différentes régions chromosomiques (D1 : 11q13 ; D2 : 12p13 ; D3 : 6p21). Les sous-types peuvent avoir des effets différents. Les caractéristiques remarquables de la cycline D sont les suivantes : son expression est induite en réponse à des stimuli externes, montrant une forte inductibilité aux facteurs de croissance, agissant comme un capteur de facteurs de croissance, qui joue un rôle important dans la liaison des signaux externes avec le cycle cellulaire interne. Ce rôle, à son tour, déduit son expression incontrôlée rend le cycle cellulaire plus ou moins dépendant des facteurs de croissance et peut induire un cancer. Le complexe cycline D-CDK est le meilleur candidat pour la protéine kinase du rétinoblastome (Rb) au stade G1. La cycline D se lie à la région N-terminale de la protéine Rb, phosphoryle Rb à la fin de la phase G1, et la synthèse et l’activation de la cycline D1 entraînent l’inactivation de la phosphorylation de Rb et la régulation négative de la cycline D1, et le complexe D1-CDK4 forme une rétroaction négative dans la phase G1, ce qui a pour effet d’inhiber l’expression de la cycline D1. La cycline D et Rb jouent un rôle important dans la prolifération et la différenciation des cellules, lorsque la cycline D1 est différente en phase G1. Dans l’expression de la source, la phosphorylation de Rb est plus précoce que la normale ; la phase G1 est accélérée, et l’anticorps anti-cycline D1 est micro-injecté dans les cellules en G1 au début de la métaphase ; la plupart des cellules sont arrêtées avant la phase S, et l’absence de Rb fonctionnelle ne peut pas provoquer ce blocage ; on en conclut que le rôle important de la cycline D1 est d’inactiver la phosphorylation de Rb, induisant ainsi l’entrée en phase S et la réplication de l’ADN. CyclinF est la protéine cycline la plus abondante (poids moléculaire 87 kDa), et son ARNm est universellement exprimé dans diverses cellules de tissus humains, et il y a des changements significatifs dans le cycle cellulaire. Le pic se situe dans la phase G2, comme la cycline A, et diminue avant que le niveau de l’ARNm de la cycline B ne diminue. La protéine cycline F s’accumule dans la phase intercellulaire et est détruite pendant la phase de mitose. Elle se trouve dans le noyau de la plupart des cellules. Une surexpression ou une mutation dans les cellules humaines entraîne un manque de régions de la séquence d’acides aminés PEST, ce qui conduit à une augmentation des cellules en phase G2. La cycline G ressemble le plus à la cycline B de la levure de fission, qui joue un rôle dans la conversion G1/S, mais l’ARNm de la cycline G n’a pas de dépendance cellulaire évidente mais peut être stimulé par la croissance cellulaire. Le facteur induit et maintient un niveau élevé. Le gène de la cycline g contient deux sites de liaison différents de p53, dont l’un se trouve en amont du site d’initiation de la transcription, ce qui suggère que p53 a le potentiel d’activer efficacement le gène de la cycline g. La cycline H, qui est un médiateur en aval de p53, du moins en ce qui concerne l’effet biologique, est une protéine d’un poids moléculaire de 37 kD trouvée en isolant et en purifiant la kinase activatrice de CDK (CAK).
Fonction de la cycline
L’étude de la relation entre le cycle cellulaire et le cancer a une importance directrice pour la recherche clinique en oncologie. Elle peut fournir certaines cibles pour le traitement clinique, comme le blocage de la cycline D, ou imiter l’action des inhibiteurs du cycle cellulaire pour inhiber la division des cellules cancéreuses, et fournir certains indicateurs pour le diagnostic clinique, le diagnostic différentiel et le pronostic. Michaelet al ont analysé le réarrangement du gène bcl-1 et l’expression de la protéine cycline D1 dans 32 cas de lymphome à cellules du manteau, 17 cas de réarrangement du gène bcl-1, et 24 cas d’expression cytoplasmique de la cycline D1, et 40 cas du groupe témoin, seulement 9 cas de lymphome à cellules B non-MCL étaient positifs. Ils estiment que la cycline D1 peut être utilisée comme diagnostic différentiel du MCL et comme diagnostic différentiel du lymphome à cellules B. La cycline est exprimée périodiquement dans le cycle cellulaire, et certains complexes cycline-CDK spécifiques sont nécessaires au passage par un certain cycle cellulaire, ce qui suggère que la cycline peut être utilisée comme indicateur de l’état prolifératif des cellules. Le taux d’expression d’une certaine cycline peut prédire la proportion de cellules dans un certain tissu dans un certain cycle cellulaire. Plus la malignité des cellules tumorales est élevée, plus le trouble du cycle cellulaire est grave, de sorte qu’il est possible de refléter le pronostic des patients à travers les informations présentées dans le cycle cellulaire, et d’agir comme un indicateur pronostique possible. Keyomarsi et al. ont utilisé 9 cas de spécimens chirurgicaux de cancer du sein et des tissus adjacents non cancéreux comme études de contrôle : Dans 8 cas de tissus cancéreux, la cycline E était anormalement exprimée en qualité et en quantité, et il existait au moins 3 poids moléculaires différents. La cycline E était surexprimée, tandis que c-erbB2 n’était surexprimé que dans 3 cas. Avec l’augmentation du stade de la tumeur, le contenu de la protéine cycline E a augmenté de manière significative, tandis que le niveau de l’antigène nucléaire des cellules proliférantes (PCNA) n’a augmenté que légèrement. La structure de la cycline E a été observée dans 4 des stades les plus élevés. Dutta et al. ont utilisé des anticorps anti-cycline A, B, E pour détecter 48 sections en paraffine de cancer du sein et ont constaté que l’indice positif moyen de la cycline A et B augmentait significativement avec l’augmentation de la phase S (P < 0,05). La cycline A était positivement corrélée à Ki-67 et à la fraction de phase S (P < 0,05). Bellacosaet al ont étudié 51 cas de carcinome épidermoïde laryngé primaire et les ont suivis pendant 29 mois. On pense que l’amplification du gène de la cycline peut être utilisée comme un indicateur pronostique indépendant pour le cancer du larynx. Cependant, Bettiche et al. ont étudié 53 cas de cancer du poumon non à petites cellules avec résection chirurgicale, et 25 cas présentaient une surexpression de la cycline D1, qui était associée à une faible différenciation des tissus, à une moindre infiltration lymphocytaire dans la tumeur et à un taux de récidive locale plus faible (P < 0. 05). Ils estiment que des études cliniques plus importantes sont nécessaires pour tester davantage la signification pronostique de l’expression de la cycline D1.
Référence
- He G, Kuang J, Koomen J, et al. Recrutement de l’antigène nucléaire trimérique des cellules proliférantes par les kinases cycline-dépendantes en phase G1 après des dommages à l’ADN avec des agents antitumoraux à base de platine. British Journal of Cancer. 2013, 109(9):2378-2388.
- Gang W, Cao J, Chen P, et al. Expression temporelle et spatiale de la cycline H dans les lésions de la moelle épinière chez le rat. Médecine neuromoléculaire. 2011, 13(3):187-196.
- Ibrahim N, Nazimi A J, Ajura A J, et al. Les caractéristiques cliniques et l’expression de bcl-2, Cyclin D1, p53, et Proliferating Cell Nuclear Antigen dans la tumeur kératocystique odontogène syndromique et non syndromique. Journal of Craniofacial Surgery. 2016, 27(5):1.
- Wang X, Wolgemuth D J, Baxi L V. Surexpression de HOXB5, cycline D1 et PCNA dans la malformation adénomatoïde kystique congénitale. Diagnostic fœtal & Thérapie. 2011, 29(4):315-320.
