Résultats d’apprentissage
- Définir la règle de l’octet et son rôle dans les liaisons chimiques
Tous les éléments n’ont pas assez d’électrons pour remplir leurs coquilles les plus externes, mais un atome est le plus stable lorsque toutes les positions des électrons dans la coquille la plus externe sont remplies. En raison de ces vacances dans les coquilles les plus externes, nous assistons à la formation de liaisons chimiques, ou d’interactions entre deux ou plusieurs éléments identiques ou différents qui aboutissent à la formation de molécules. Pour atteindre une plus grande stabilité, les atomes auront tendance à remplir complètement leurs coquilles externes et se lieront à d’autres éléments pour atteindre cet objectif en partageant des électrons, en acceptant des électrons d’un autre atome ou en donnant des électrons à un autre atome. Comme les coquilles extérieures des éléments de faible numéro atomique (jusqu’au calcium, dont le numéro atomique est 20) peuvent contenir huit électrons, on parle de la règle de l’octuor. Un élément peut donner, accepter ou partager des électrons avec d’autres éléments pour remplir sa coquille externe et satisfaire à la règle de l’octuor.
Un premier modèle de l’atome a été développé en 1913 par le scientifique danois Niels Bohr (1885-1962). Le modèle de Bohr montre l’atome comme un noyau central contenant des protons et des neutrons, avec les électrons dans des coquilles électroniques circulaires à des distances spécifiques du noyau, semblables à des planètes en orbite autour du soleil. Chaque enveloppe électronique possède un niveau d’énergie différent, les enveloppes les plus proches du noyau étant moins énergétiques que celles qui en sont plus éloignées. Par convention, on attribue à chaque couche un numéro et le symbole n. Par exemple, la couche d’électrons la plus proche du noyau est appelée 1n. Pour passer d’une coquille à l’autre, un électron doit absorber ou libérer une quantité d’énergie correspondant exactement à la différence d’énergie entre les coquilles. Par exemple, si un électron absorbe l’énergie d’un photon, il peut devenir excité et passer à une coquille d’énergie plus élevée ; à l’inverse, lorsqu’un électron excité redescend dans une coquille d’énergie inférieure, il libère de l’énergie, souvent sous forme de chaleur.
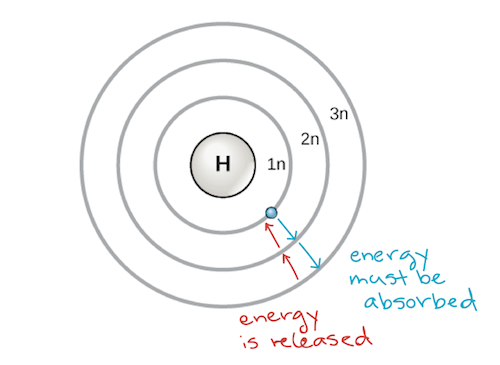
Modèle de Bohr d’un atome, montrant les niveaux d’énergie sous forme de cercles concentriques entourant le noyau. De l’énergie doit être ajoutée pour déplacer un électron vers l’extérieur vers un niveau d’énergie plus élevé, et de l’énergie est libérée lorsqu’un électron descend d’un niveau d’énergie plus élevé vers un niveau plus proche. Crédit image : modifié à partir de OpenStax Biology
Les atomes, comme d’autres choses régies par les lois de la physique, ont tendance à prendre la configuration la plus stable et la moins énergétique possible. Ainsi, les coquilles électroniques d’un atome sont peuplées de l’intérieur vers l’extérieur, les électrons remplissant les coquilles de faible énergie les plus proches du noyau avant de se déplacer dans les coquilles de plus haute énergie plus éloignées. La coquille la plus proche du noyau, 1n, peut contenir deux électrons, tandis que la coquille suivante, 2n, peut en contenir huit, et la troisième coquille, 3n, peut en contenir jusqu’à dix-huit.
Le nombre d’électrons dans la coquille la plus externe d’un atome particulier détermine sa réactivité, ou sa tendance à former des liaisons chimiques avec d’autres atomes. Cette coquille la plus externe est connue sous le nom de coquille de valence, et les électrons qui s’y trouvent sont appelés électrons de valence. En général, les atomes sont les plus stables, les moins réactifs, lorsque leur coquille électronique la plus externe est pleine. La plupart des éléments importants en biologie ont besoin de huit électrons dans leur coquille la plus externe pour être stables, et cette règle empirique est connue sous le nom de règle de l’octet. Certains atomes peuvent être stables avec un octet même si leur coquille de valence est la coquille 3n, qui peut contenir jusqu’à 18 électrons. Nous explorerons la raison de ceci lorsque nous discuterons des orbitales électroniques ci-dessous.
Les exemples de certains atomes neutres et leurs configurations électroniques sont présentés ci-dessous. Dans ce tableau, vous pouvez voir que l’hélium a une coquille de valence complète, avec deux électrons dans sa première et unique, 1n, coquille. De même, le néon possède une couche externe 2n complète contenant huit électrons. Ces configurations électroniques rendent l’hélium et le néon très stables. Bien que l’argon n’ait pas techniquement une coquille externe complète, puisque la coquille 3n peut contenir jusqu’à dix-huit électrons, il est stable comme le néon et l’hélium car il possède huit électrons dans la coquille 3n et satisfait donc à la règle de l’octuor. En revanche, le chlore n’a que sept électrons dans sa coquille la plus externe, tandis que le sodium n’en a qu’un seul. Ces configurations ne remplissent pas la coquille la plus externe ou ne satisfont pas la règle de l’octet, ce qui rend le chlore et le sodium réactifs, désireux de gagner ou de perdre des électrons pour atteindre une configuration plus stable.
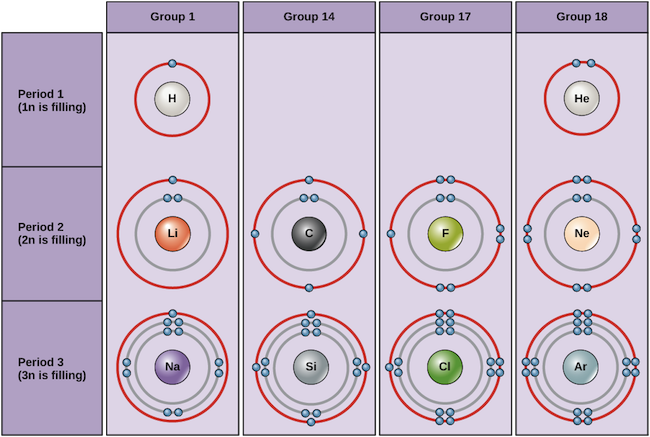
Diagrammes de Bohr de divers éléments Crédit image : OpenStax Biology
Configurations électroniques et tableau périodique
Les éléments sont placés dans l’ordre sur le tableau périodique en fonction de leur numéro atomique, c’est-à-dire du nombre de protons qu’ils possèdent. Dans un atome neutre, le nombre d’électrons sera égal au nombre de protons, nous pouvons donc facilement déterminer le nombre d’électrons à partir du numéro atomique. En outre, la position d’un élément dans le tableau périodique – sa colonne, ou groupe, et sa rangée, ou période – fournit des informations utiles sur la façon dont ces électrons sont disposés.
Si l’on considère uniquement les trois premières rangées du tableau, qui comprennent les principaux éléments importants pour la vie, chaque rangée correspond au remplissage d’une coquille électronique différente : l’hélium et l’hydrogène placent leurs électrons dans la coquille 1n, tandis que les éléments de deuxième rangée comme Li commencent à remplir la coquille 2n, et les éléments de troisième rangée comme Na continuent avec la coquille 3n. De même, le numéro de colonne d’un élément donne des informations sur son nombre d’électrons de valence et sa réactivité. En général, le nombre d’électrons de valence est le même dans une colonne et augmente de gauche à droite dans une rangée. Les éléments du groupe 1 n’ont qu’un seul électron de valence et ceux du groupe 18 en ont huit, à l’exception de l’hélium, qui n’a que deux électrons au total. Ainsi, le numéro de groupe est un bon prédicteur de la réactivité de chaque élément :
- L’hélium (He), le néon (Ne) et l’argon (Ar), en tant qu’éléments du groupe 18, ont des coquilles électroniques externes qui sont pleines ou qui satisfont à la règle de l’octuor. Cela les rend très stables en tant qu’atomes simples. En raison de leur non-réactivité, on les appelle les gaz inertes ou gaz nobles.
- L’hydrogène (H), le lithium (Li) et le sodium (Na), en tant qu’éléments du groupe 1, n’ont qu’un seul électron dans leurs coquilles externes. Ils sont instables en tant qu’atomes simples, mais peuvent devenir stables en perdant ou en partageant leur électron de valence. Si ces éléments perdent complètement un électron – comme le font généralement Li et Na – ils deviennent des ions chargés positivement : Li+, Na+.
- Le fluor (F) et le chlore (Cl), en tant qu’éléments du groupe 17, ont sept électrons dans leurs coquilles les plus externes. Ils ont tendance à atteindre un octuor stable en prenant un électron d’autres atomes, devenant ainsi des ions chargés négativement : F- et Cl-.
- Le carbone (C), en tant qu’élément du groupe 14, possède quatre électrons dans sa coquille externe. Le carbone partage généralement les électrons pour obtenir une coquille de valence complète, formant des liaisons avec plusieurs autres atomes.
Ainsi, les colonnes du tableau périodique reflètent le nombre d’électrons trouvés dans la coquille de valence de chaque élément, ce qui détermine à son tour la façon dont l’élément réagira.
Essayez-le
Contribuez !
Améliorer cette pageEn savoir plus
