15.4 Physikalische Eigenschaften von Carbonsäuren
Lernziele
- Vergleichen Sie die Siedepunkte von Carbonsäuren mit Alkoholen ähnlicher Molmasse.
- Vergleiche die Löslichkeit von Carbonsäuren in Wasser mit der Löslichkeit von vergleichbaren Alkanen und Alkoholen in Wasser.
Viele Carbonsäuren sind farblose Flüssigkeiten mit unangenehmem Geruch. Die Carbonsäuren mit 5 bis 10 Kohlenstoffatomen haben alle einen „ziegenartigen“ Geruch (was den Geruch von Limburger Käse erklärt). Diese Säuren werden auch durch die Wirkung von Hautbakterien auf den menschlichen Talg (Hautfett) gebildet, was den Geruch von schlecht belüfteten Umkleideräumen erklärt. Die Säuren mit mehr als 10 Kohlenstoffatomen sind wachsartige Feststoffe, deren Geruch mit zunehmender Molmasse und damit abnehmender Flüchtigkeit abnimmt.
Carbonsäuren weisen starke Wasserstoffbrückenbindungen zwischen den Molekülen auf. Daher haben sie im Vergleich zu anderen Substanzen mit vergleichbarer Molmasse hohe Siedepunkte.
Die Carboxylgruppe geht leicht Wasserstoffbrückenbindungen mit Wassermolekülen ein (Abbildung 15.3 „Wasserstoffbrückenbindungen zwischen einem Essigsäuremolekül und Wassermolekülen“). Die Säuren mit einem bis vier Kohlenstoffatomen sind vollständig mit Wasser mischbar. Die Löslichkeit nimmt mit zunehmender Länge der Kohlenstoffkette ab, da die Dipolkräfte an Bedeutung verlieren und die Dispersionskräfte überwiegen. Hexansäure ist in Wasser kaum löslich (etwa 1,0 g/100 g Wasser). Palmitinsäure mit ihrer großen unpolaren Kohlenwasserstoffkomponente ist im Wesentlichen unlöslich in Wasser. Die Carbonsäuren sind im Allgemeinen in organischen Lösungsmitteln wie Ethanol, Toluol und Diethylether löslich.
Abbildung 15.3 Wasserstoffbrückenbindungen zwischen einem Essigsäuremolekül und Wassermolekülen
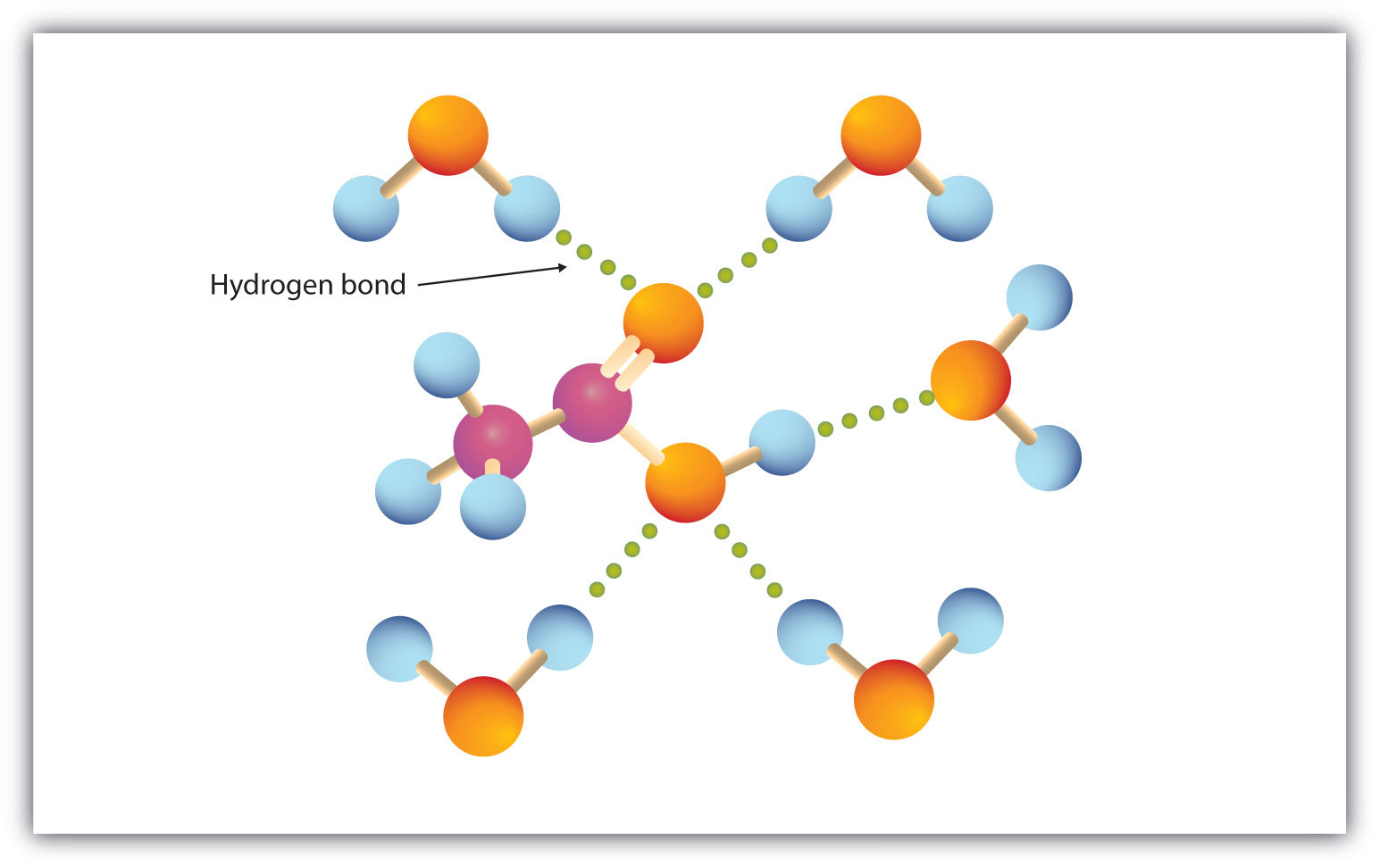
Carbonsäuren mit geringer Molmasse sind gut in Wasser löslich.
Tabelle 15.2 „Physikalische Konstanten von Carbonsäuren“ listet einige physikalische Eigenschaften für ausgewählte Carbonsäuren auf. Die ersten sechs sind Homologe. Man beachte, dass die Siedepunkte mit zunehmender Molmasse ansteigen, aber die Schmelzpunkte zeigen kein regelmäßiges Muster.
Tabelle 15.2 Physikalische Konstanten von Carbonsäuren
| Kondensierte Strukturformel | Name der Säure | Schmelzpunkt (°C) | Siedepunkt (°C) | Löslichkeit (g/100 g Wasser) |
|---|---|---|---|---|
| HCOOH | Ameisensäure | 8 | 100 | mischbar |
| CH3COOH | Essigsäure | 17 | 118 | mischbar |
| CH3CH2COOH | Propionsäure | -22 | 141 | mischbar |
| CH3(CH2)2COOH | Buttersäure | -5 | 163 | mischbar |
| CH3(CH2)3COOH | Valeriansäure | -35 | 187 | 5 |
| CH3(CH2)4COOH | Branntweinsäure | -3 | 205 | 1.1 |
| C6H5COOH | Benzoesäure | 122 | 249 | 0.29 |
Konzeptüberprüfungsübungen
-
Welche Verbindung hat den höheren Siedepunkt – Butansäure (molare Masse 88) oder 2-Pentanon (molare Masse 86)? Erläutern Sie.
-
Würden Sie erwarten, dass Buttersäure (Butansäure) in Wasser mehr oder weniger löslich ist als 1-Butanol? Erkläre.
Antworten
-
Buttersäure aufgrund von Wasserstoffbrückenbindungen (Es gibt keine intermolekularen Wasserstoffbrückenbindungen in 2-Pentanon.)
-
höher löslich, weil es eine stärkere Wasserstoffbindung gibt
Key Takeaways
- Carbonsäuren haben hohe Siedepunkte im Vergleich zu anderen Substanzen mit vergleichbarer Molmasse. Die Siedepunkte steigen mit der molaren Masse.
- Carbonsäuren mit einem bis vier Kohlenstoffatomen sind vollständig mit Wasser mischbar. Die Löslichkeit nimmt mit der molaren Masse ab.
Übungen
-
Welche Verbindung hat den höheren Siedepunkt – CH3CH2CH2OCH2CH3 oder CH3CH2CH2COOH? Erkläre.
-
Welche Verbindung hat den höheren Siedepunkt-CH3CH2CH2CH2CH2OH oder CH3CH2CH2COOH? Erkläre.
-
Welche Verbindung ist besser in Wasser löslich – CH3COOH oder CH3CH2CH2CH3? Erkläre.
-
Welche Verbindung ist besser in Wasser löslich – CH3CH2COOH oder CH3CH2CH2CH2CH2COOH? Erkläre.
Antworten
-
CH3CH2CH2COOH aufgrund von Wasserstoffbrückenbindungen (Es gibt keine intermolekulare Wasserstoffbrückenbindung mit CH3CH2CH2OCH2CH3.)
-
CH3COOH wegen der Wasserstoffbrückenbindung mit Wasser (Es gibt keine intermolekulare Wasserstoffbrückenbindung mit CH3CH2CH2CH3.)
