- o-Xylol Chemische Eigenschaften, Verwendung, Herstellung
- Xylol
- Präzisionsdestillation zur Trennung von O-Xylol und p-Xylol
- Chemische Eigenschaften
- Verwendungen
- Produktionsverfahren
- Kategorie
- Toxizitätseinstufung
- Akute Toxizität
- EXPLOSIVSTOFFE und GEFÄHRLICHE EIGENSCHAFTEN
- Entflammbarkeit und gefährliche Eigenschaften
- Lager- und Transporteigenschaften
- Feuerlöschmittel
- Arbeitsschutznorm
- Chemische Eigenschaften
- Physikalische Eigenschaften
- Verwendungen
- Definition
- Synthese Referenz(en)
- Allgemeine Beschreibung
- Luft &Wasserreaktionen
- Reaktivitätsprofil
- Gesundheitsgefährdung
- Brandgefahr
- Chemische Reaktivität
- Sicherheitsprofil
- Quelle
- Umweltverträglichkeit
- Reinigungsmethoden
o-Xylol Chemische Eigenschaften, Verwendung, Herstellung
Xylol
Xylol ist ein aromatischer Kohlenwasserstoff, bei dem die beiden Wasserstoffatome am Benzolring durch zwei Methylgruppen ersetzt sind. Es hat drei Isomere: o-Xylol (1,2-Dimethylbenzol), m-Xylol und p-Xylol. Die Industrieprodukte sind Gemische der drei Isomere mit 10% o-10%, 70% m- und 20% p-. In der Kokerei-Industrie, ist es eines der rohen Benzol raffinierte Produkte.
Xylol ist eine Art farblose brennbare Flüssigkeit; der Schmelzpunkt von o-, m-und p-Xylol ist-25,2 ℃,-47,9 ℃ und 13,3 ℃; die Siedepunkte sind jeweils 144.4 ℃, 139,1 ℃ und 138,3 ℃, während die relative Dichte ist 0,8802, 0,8642 und 0,8611, bzw.; Es ist nicht löslich in Wasser, sondern mischbar mit vielen Arten von organischen Lösungsmitteln Unmischbarkeit. Bei der katalytischen Oxidation entstehen Phthalsäureanhydrid, Isophthalsäure und Terephthalsäure.
Xylol ist ein wichtiger Rohstoff für organische Chemikalien, der natürlich in Steinkohlenteer und einigen Erdölsorten vorkommt. Es kann durch die Fraktionierung des Leichtölanteils des Steinkohlenteers oder durch katalytische Reformierung von Leichtbenzin gewonnen werden. In der Industrie wird hauptsächlich die C8-Fraktion in den Naphtha-Reformaten zur Gewinnung verwendet. Alternativ kann es auch durch die Disproportionierungsreaktion von Toluol in Gegenwart eines Katalysators und bei hoher Temperatur und hohem Druck hergestellt werden. Gegenwärtig wendet die Industrie hauptsächlich die Methode der kryogenen Kristallisation, der Adsorption und der Bildung von Komplexen oder Molekularsieben an, um sie zu trennen. O-Xylol hat einen relativ hohen Siedepunkt und kann durch Destillation getrennt werden. p-Xylol hat ebenfalls einen hohen Schmelzpunkt und kann durch fraktionierte Kristallisation gereinigt werden. Misch-Xylol kann ohne Abtrennung direkt als Lösungsmittel verwendet werden, wobei es dem Benzin zugesetzt werden kann, um die explosionshemmenden Eigenschaften zu verbessern. Sie sind Bestandteile von Flugbenzin. O-Xylol wird hauptsächlich zur Herstellung von Phthalsäureanhydrid verwendet, das ein wichtiger Rohstoff für die Herstellung einer Reihe von Farbstoffen und Indikatoren (wie Phenolphthalein) ist. Darüber hinaus kann o-Xylol auch für die Herstellung von Polyesterharz, Insektenschutzmitteln, Weichmachern und Farbstoffen verwendet werden. M-Xylol kann durch Nitrierung und Reduktion 4,6-Dimethyl-1,3-phenylendiamin erzeugen, das als Zwischenprodukt für synthetische Farbstoffe dient. M-Xylol kann auch als Rohstoff für synthetische Duftstoffe (wie Xylol-Moschus) verwendet werden. P-Xylol wird hauptsächlich zur Herstellung von Terephthalsäure verwendet, die ein wichtiger Rohstoff für synthetische Polyesterfasern (Polyester) ist.
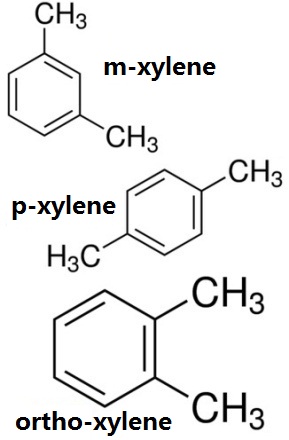
Abbildung 1 zeigt die chemische Struktur der drei Isomere von Xylol, ortho-xylol, m-xylol, p-xylol chemische Struktur.
Die obigen Informationen werden von Chemicalbook bearbeitet.
Präzisionsdestillation zur Trennung von O-Xylol und p-Xylol
Xylol wird in verkoktem Rohbenzol und gecracktem Erdöl dargestellt. Aus Rohbenzol wird nach der ersten Destillation, dem Waschen mit Schwefelsäure und der Destillation zur Trennung von Benzol und Toluol und der anschließenden Destillation Xylol gewonnen, das auch als verkoktes Xylol bezeichnet wird. Die Qualität des verkokten Xylols hängt von der Trennkapazität der Destillationskolonne, der Temperatur am Kopf der Kolonne und dem Rückflussverhältnis ab. China hat die Produkte des verkokten Xylols in drei Stufen eingeteilt. Das verkokte Xylol enthält im Allgemeinen 16% o-Xylol, 50% m-Xylol, 21% p-Xylol und 7% Ethylbenzol. Das in der Erdölindustrie hergestellte Xylol hat einen geringen Gehalt an m-Xylol und einen hohen Gehalt an Ethylbenzol. Industrielles Xylol wird nicht nur als Lösungsmittel und Zusatzstoff in der Gummi- und Lackindustrie verwendet, sondern auch als Zusatzstoff in der Luftfahrt und in Kraftstoffen. O-Xylol, m-Xylol und p-Xylol, die von Industrie-Xylol abgetrennt werden, sind die Rohstoffe für Phthalsäure, Isophthalsäure bzw. Terephthalsäure. Phthalsäure und Terephthalsäure werden für die Herstellung von Weichmachern, Polyesterharzen und Polyesterfasern verwendet. M-Xylol kann allein als Lösungsmittel und Kraftstoffadditiv verwendet werden. Das im industriellen Xylol enthaltene o-Xylol unterscheidet sich um mehr als 5,2 ℃ von den anderen Isomeren. Durch Präzisionsdestillation können wir o-Xylol mit einem Reinheitsgrad von über 95 % erhalten, gefolgt von der Verwendung von Sulfonierung und Destillation zur Reinigung, so dass wir noch reineres o-Xylol erhalten können.
Xylol gehört zu den Lewis-Basen, die mit HF-BF3 (Lewis-Säure) einen polaren Komplex bilden können. Die Alkalität von M-Xylol ist etwa 100 Mal so stark wie die anderer C8-Aromaten. Wenn das Isomerengemisch von Xylol mit dem Lösungsmittel HF-BF3 in Kontakt kommt, kann m-Xylol einen Komplex mit Fluorid bilden und wird bevorzugt in die Fluoridphase extrahiert. Die m-Xylol enthaltende Fluoridphase wird bei niedrigerem Druck erhitzt, um den Komplex zu zersetzen, wodurch m-Xylol aus dem Gemisch abgetrennt wird. Das HF-BF3-Lösungsmittel kann durch Destillation für das Recycling zurückgewonnen werden. Handelt es sich bei dem Rohstoff um ein Gemisch aus ortho-Xylol, m-Xylol und p-Xylol, so kann nach der Extraktion des m-Xylols eine weitere Präzisionsdestillation zur Abtrennung von o-Xylol und p-Xylol durchgeführt werden.
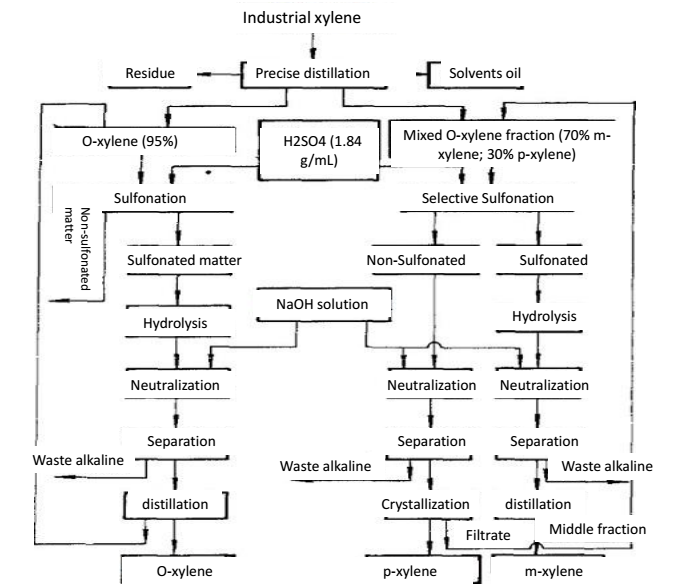
Abbildung 2: Präzisionsdestillationsverfahren zur Trennung von o-Xylol und p-Xylol.
Chemische Eigenschaften
Es erscheint als farblose transparente Flüssigkeit mit aromatischem Geruch. Es ist mischbar mit Ethanol, Ethylether, Aceton und Benzol, aber unlöslich in Wasser.
Verwendungen
(1) Es wird hauptsächlich für die Herstellung von Phthalsäureanhydrid verwendet
(2) O-Xylol ist der Rohstoff für die Herstellung des Germizids Fenramin, des Tetrachlorphenylpeptids und des Herbizids Bensulfuron-Methyl. Es wird als Zwischenprodukt für die Herstellung von o-Methylbenzoesäure verwendet.
(3) Es wird hauptsächlich als chemischer Rohstoff und Lösungsmittel verwendet. Es kann zur Herstellung von Phthalsäureanhydrid, Farbstoffen, Pestiziden und Arzneimitteln wie Vitaminen verwendet werden. Es kann auch als Zusatzstoff für Flugbenzin verwendet werden.
(4) Wird als chromatographischer Standard und Lösungsmittel verwendet
(5) Als Rohstoff für die Synthese von Anhydrid und anderen organischen Synthesen;
Produktionsverfahren
Die Industrie wendet die Superdestillationsmethode an, um das o-Xylol aus dem gemischten Xylol abzutrennen. O-Xylol hat einen um mehr als 5 ℃ unterschiedlichen Siedepunkt im Vergleich zu den anderen Bestandteilen des gemischten Xylols. Für die Destillation sind etwa 150 Böden erforderlich; das Rückflussverhältnis beträgt 5-8 und verbraucht relativ viel Energie.
O-Xylol wurde ursprünglich hauptsächlich aus Kohlenteer hergestellt. Gegenwärtig wird o-Xylol im In- und Ausland hauptsächlich durch katalytisches Reformieren und thermisches Cracken von aromatischen Kohlenwasserstoffen aus Öl gewonnen. Da die Strukturen von o-Xylol, p-Xylol und m-Xylol im Xylol sehr ähnlich sind, sind auch ihre physikalischen Parameter recht ähnlich. Industrielle o-xylene Trennung nimmt hauptsächlich super-distillation Methode an; zuerst trennen Sie heraus das o-xylene und das ethylbenzene vom gemischten xylene, das den Gebrauch von 100~150 Fachdestillationsturm verlangt; gefolgt von Trennung des o-xylene und des ethylbenzene, um reines o-xylene zu erhalten.
Kategorie
Entzündbare Flüssigkeiten
Toxizitätseinstufung
Vergiftung
Akute Toxizität
Oral-Ratte LDL0: 5000 mg/kg; Bauchinjektion-Maus LD50: 1364 mg/kg
EXPLOSIVSTOFFE und GEFÄHRLICHE EIGENSCHAFTEN
in Verbindung mit Luft explosiv
Entflammbarkeit und gefährliche Eigenschaften
entflammbar bei Flammen, Hitze, Oxidationsmittel entflammbar bei Verbrennung unter Freisetzung von reizendem Rauch
Lager- und Transporteigenschaften
Lager: belüftet, bei niedriger Temperatur und trocken; vorsichtig be- und entladen; getrennt von Oxidationsmitteln und Säuren lagern.
Feuerlöschmittel
Nebelwasser, Schaum, Sand, Kohlendioxid, 1211 Löschmittel
Arbeitsschutznorm
TLV-TWA 100 PPM (440 mg/m 3); STEL 150; PPM (655 mg/m 3)
Chemische Eigenschaften
farblose Flüssigkeit
Physikalische Eigenschaften
Klare, farblose Flüssigkeit mit einem aromatischen Geruch. Eine Geruchsschwellenkonzentration von 380 ppbv wurde von Nagata und Takeuchi (1990) angegeben.
Verwendungen
Herstellung von Phthalsäure, Phthalsäureanhydrid, Terephthalsäure, Isophthalsäure; Lösungsmittel für Alkydharze, Lacke, Emaille, Gummizemente; Herstellung von Farbstoffen, Arzneimitteln und Insektiziden; Kraftstoffe.
Definition
ChEBI: Ein Xylol, das an den Positionen 1 und 3 durch Methylgruppen substituiert ist.
Synthese Referenz(en)
Journal of the American Chemical Society, 97, S. 7262, 1975 DOI: 10.1021/ja00858a011
The Journal of Organic Chemistry, 44, S. 2185, 1979 DOI: 10.1021/jo01327a032
Allgemeine Beschreibung
Eine farblose wässrige Flüssigkeit mit süßem Geruch. Geringere Dichte als Wasser. Unlöslich in Wasser. Irritierende Dämpfe.
Luft &Wasserreaktionen
Leichtentzündlich. Unlöslich in Wasser.
Reaktivitätsprofil
1,2-Dimethylbenzol kann mit oxidierenden Materialien reagieren. .
Gesundheitsgefährdung
Dämpfe verursachen Kopfschmerzen und Schwindelgefühl. Flüssigkeit reizt Augen und Haut. Wenn es in die Lunge gelangt, verursacht es starken Husten, Atemnot und ein sich schnell entwickelndes Lungenödem. Bei Verschlucken: Übelkeit, Erbrechen, Krämpfe, Kopfschmerzen und Koma. Kann tödlich sein. Nieren- und Leberschäden können auftreten.
Brandgefahr
Verhalten im Brandfall: Dämpfe sind schwerer als Luft und können eine beträchtliche Strecke bis zu einer Zündquelle zurücklegen und zurückschlagen.
Chemische Reaktivität
Reaktivität mit Wasser Keine Reaktion; Reaktivität mit üblichen Materialien: Keine Reaktion; Stabilität beim Transport: Stabil; Neutralisationsmittel für Säuren und Ätzmittel: Nicht zutreffend; Polymerisation: Nicht zutreffend; Polymerisationsinhibitor: Nicht sachdienlich.
Sicherheitsprofil
Mäßig giftig bj7intraperitonealer Weg. Mäßig giftig durch Verschlucken und Einatmen. Ein experimentelles Teratogen. Häufiger Luftverunreiniger. Sehr feuergefährlich bei Einwirkung von Hitze oder Flammen. Explosiv in Form von Dämpfen, wenn es Hitze oder Flammen ausgesetzt wird. Unverträglich mit oxidierenden Materialien. Entwickelt bei Erhitzung bis zur Zersetzung scharfen Rauch und reizende Dämpfe. Wird von modernen Baumaterialien emittiert (CENEAR69,22,91). Siehe auch andere Xylol-Einträge.
Quelle
Nachgewiesen in destillierten wasserlöslichen Fraktionen von 87-Oktan-Benzin (3,83 mg/L), 94-Oktan-Benzin (11,4 mg/L), Gasohol (8,49 mg/L), Heizöl Nr. 2 (1,73 mg/L), Jet Fuel A (0.87 mg/L), Dieselkraftstoff (1,75 mg/L), militärischer Düsenkraftstoff JP-4 (1,99 mg/L) (Potter, 1996), neues Motoröl (16,2 bis 17,5 μg/L) und gebrauchtes Motoröl (294 bis 308 μg/L) (Chen et al., 1994). Der durchschnittliche Volumenprozentsatz und die geschätzte Molfraktion in American Petroleum Institute PS-6-Benzin betragen 2,088 bzw. 0,01959 (Poulsen et al., 1992). Schauer et al. (1999) berichteten über o-Xylol in den Abgasen eines dieselbetriebenen Lastkraftwagens mittlerer Größe mit einer Emissionsrate von 830 μg/km. Dieselkraftstoff aus einer Tankstelle in Schlieren, Schweiz, enthielt o-Xylol in einer Konzentration von 223 mg/L (Schluep etal., 2001).
Reformuliertes Benzin der Phase II aus Kalifornien enthielt o-Xylol in einer Konzentration von 19,7 g/kg.
Die Abgasemissionsraten von benzinbetriebenen Kraftfahrzeugen mit und ohne Katalysator betrugen 5,41 bzw. 562 mg/km (Schauer et al., 2002).
Thomas und Delfino (1991) brachten schadstofffreies Grundwasser aus Gainesville, FL, mit einzelnen Fraktionen dreier Erdölprodukte bei 24-25 °C für 24 h ins Gleichgewicht. Die wässrige Phase wurde mit der von der US-EPA genehmigten Testmethode602 auf organische Verbindungen untersucht. Die durchschnittlichen m+p-Xylol-Konzentrationen in den wasserlöslichen Fraktionen von unverbleitem Benzin, Kerosin und Dieselkraftstoff betrugen 8,611, 0,658 bzw. 0,228 mg/L. Als die Autoren die wässrige Phase mit der von der US-EPA genehmigten Testmethode 610 analysierten, waren die durchschnittlichen m+p-Xylenkonzentrationen in den wasserlöslichen Fraktionen von bleifreiem Benzin, Kerosin und Dieselkraftstoff niedriger, d.h. 6,068, 0,360 bzw. 0,222 mg/L. Auf der Grundlage von Laboranalysen von 7 Kohlenteerproben lagen die o-Xylenkonzentrationen zwischen 2 und 2.000 ppm (EPRI, 1990). Ein Hochtemperatur-Steinkohlenteer enthielt o-Xylol in einer durchschnittlichen Konzentration von 0,04 Gew.-% (McNeil, 1983).
Schauer et al. (2001) maßen die Emissionsraten für flüchtige organische Verbindungen, halbflüchtige organische Verbindungen in der Gasphase und organische Verbindungen in der Partikelphase bei der Verbrennung von Kiefern-, Eichen- und Eukalyptusholz in Privathaushalten (Kamin). Die Gasphasenemissionsrate von o-Xylol betrug 18,1 mg/kg verbrannte Kiefer. Bei der Verbrennung von Eiche und Eukalyptus wurden die Emissionsraten von o-Xylol nicht gemessen.
Trinkwassernorm (endgültig): Für alle Xylole betragen der MCLG und der MCL jeweils 10 mg/L. Darüber hinaus wurde ein DWEL von 70 mg/L empfohlen (U.S. EPA, 2000).
Umweltverträglichkeit
Biologisch. Zu den berichteten biologischen Abbauprodukten des xylolhaltigen Handelsprodukts gehören α-Hydroxy-p-Toluylsäure, p-Methylbenzylalkohol, Benzylalkohol, 4-Methylcatechin und p-Toluylsäuren (Fishbein, 1985). o-Xylol wurde auch kometabolisiert, was zur Bildung von o-Toluylsäure führte (Pitter und Chudoba, 1990). In anoxischem Grundwasser in der Nähe von Bemidji, MI, wurde o-Xylol biologisch zu dem Zwischenprodukt o-Toluylsäure abgebaut (Cozzarelli et al., 1990). In benzinkontaminiertem Grundwasser wurde Methylbenzylbernsteinsäure als erstes Zwischenprodukt beim anaeroben Abbau von Xylol identifiziert (Reusser und Field, 2002).
Photolytisch. Cox et al. (1980) berichteten über eine Geschwindigkeitskonstante von 1,33 x 10-11 cm3/Molekül?s für die Reaktion von gasförmigem o-Xylol mit OH-Radikalen, basierend auf einem Wert von 8 x 10-12 cm3/Molekül?s für die Reaktion von Ethylen mit OH-Radikalen.
Oberflächenwasser. Die Verdunstungshalbwertszeit von o-Xylol in Oberflächenwasser (1 m Tiefe) bei 25 °C wird auf 5,18 h geschätzt (Mackay und Leinonen, 1975).
Grundwasser. Nielsen et al. (1996) untersuchten den Abbau von o-Xylol in einem flachen, glazifluvialen, nicht begrenzten sandigen Aquifer in Jütland, Dänemark. Im Rahmen der In-situ-Mikrokosmos-Studie wurde ein unten offener und oben abgeschirmter Zylinder durch ein verrohrtes Bohrloch etwa 5 m unter der Oberfläche installiert. Fünf Liter Wasser wurden mit atmosphärischer Luft belüftet, um sicherzustellen, dass aerobe Bedingungen herrschten. Das Grundwasser wurde etwa 3 Monate lang wöchentlich analysiert, um die o-Xylol-Konzentration im Laufe der Zeit zu bestimmen. Die experimentell ermittelte Abbaugeschwindigkeitskonstante erster Ordnung und die entsprechende Halbwertszeit nach einer Verzögerungsphase von 7 Tagen betrugen 0,1 Tage bzw. 6,93 Tage.
Photolytisch. Wenn synthetische Luft, die gasförmige salpetrige Säure und o-Xylol enthält, künstlichem Sonnenlicht (λ = 300-450 nm) ausgesetzt wurde, bildeten sich Biacetyl, Peroxyacetalnitrat und Methylnitrat als Produkte (Cox et al., 1980). Eine o-Xylol enthaltende n-Hexanlösung, die als dünner Film (4 mm) auf kaltem Wasser (10 °C) aufgetragen war, wurde mit einer Quecksilber-Mitteldrucklampe bestrahlt. Innerhalb von 3 Stunden wurden 13,6 % des o-Xylols zu o-Methylbenzaldehyd, o-Benzylalkohol, o-Benzoesäure und o-Methylacetophenon photooxidiert (Moza und Feicht, 1989). Die Bestrahlung von o-Xylol bei ≈ 2537 ? bei 35 °C und 6 mmHg zu m-Xylol isomerisiert (Calvert und Pitts, 1966). Glyoxal, Methylglyoxal und Biacetyl wurden aus der Photooxidation von o-Xylol durch OH-Radikale in Luft bei 25 °C gebildet (Tuazon et al.,1986a).
Chemisch/Physikalisch. Unter atmosphärischen Bedingungen führte die Gasphasenreaktion von o-Xylol mit OH-Radikalen und Stickoxiden zur Bildung von o-Tolualdehyd, o-Methylbenzylnitrat, Nitro-o-xylenen, 2,3- und 3,4-Dimethylphenol (Atkinson, 1990). Kanno et al. (1982) untersuchten die wässrige Reaktion von o-Xylol und anderen aromatischen Kohlenwasserstoffen (Benzol, Toluol, m- und p-Xylol und Naphthalin) mit unterchloriger Säure in Gegenwart von Ammoniumionen. Sie berichteten, dass der aromatische Ring nicht wie erwartet chloriert wurde, sondern durch Chloramin unter Bildung von Chlorcyan gespalten wurde. Die Menge des gebildeten Chlorcyans nahm bei niedrigeren pH-Werten zu (Kanno et al., 1982). In der Gasphase reagierte o-Xylol mit Nitratradikalen in gereinigter Luft und bildete die folgenden Produkte: 5-Nitro-2-methyltoluol und 6-Nitro-2-methyltoluol, o-Methylbenzaldehyd und ein Arylnitrat (Chiodini et al., 1993).
Reinigungsmethoden
o-Xylol (4,4 kg) wird durch 4stündiges Rühren mit 2,5 l konz. H2SO4 bei 95o sulfoniert. Nach dem Abkühlen und der Abtrennung des nicht sulfonierten Materials wird das Produkt mit 3 l Wasser verdünnt und mit 40 % NaOH neutralisiert. Beim Abkühlen trennt sich das Natrium-oxylensulfonat ab und wird aus der Hälfte seines Gewichts an Wasser umkristallisiert. Das Salz wird in der Mindestmenge an kaltem Wasser gelöst, dann mit der gleichen Menge an kaltem Wasser und mit dem gleichen Volumen an konz. H2SO4 gemischt und auf 110o erhitzt. o-Xylol wird regeneriert und mit Dampf destilliert. Das Destillat wird mit NaCl gesättigt, die organische Schicht wird abgetrennt, getrocknet und redestilliert.
