Generischer Name: Lidocain-Hydrochlorid
Dosierung Form: topische Gelee
Medically reviewed by Drugs.com. Last updated on Oct 1, 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professionell
- Interaktionen
- Mehr
Nur Rx
- BESCHREIBUNG
- KLINISCHE PHARMAKOLOGIE
- ANWENDUNG UND EINSATZBEREICH
- KONTRAINDIKATIONEN
- WARNHINWEISE
- VORSICHTSMASSNAHMEN
- Verwendung in der Schwangerschaft:
- Nebenwirkungen
- ÜBERDOSIERUNG
- DOSIERUNG UND ANWENDUNG
- HÖCHSTDOSIERUNG
- VERSORGUNGSWEISE
- Mehr über Lidocain topisch
- Ressourcen für Verbraucher
- Ressourcen für Fachleute
- Verwandte Behandlungsleitfäden
BESCHREIBUNG
Lidocain HCI 2% Gelee ist ein steriles, wässriges Produkt, das ein Lokalanästhetikum enthält und topisch verabreicht wird. (Siehe INDIKATIONEN für spezifische Anwendungen.)
Lidocain HCI 2% Gelee enthält Lidocain HCI, das chemisch als Acetamid, 2-(Diethylamino)-N-(2,6-dimethylphenyl)-, Monohydrochlorid bezeichnet wird und die folgende Strukturformel hat:
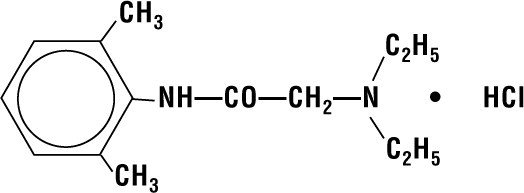
Seine Summenformel ist C14H22N2O – HCI und sein Molekulargewicht beträgt 270.80.
Lidocain HCI 2% Gelee enthält auch Hypromellose, und die resultierende Mischung maximiert den Kontakt mit der Schleimhaut und bietet eine Schmierung für die Instrumentierung. Der unbenutzte Teil sollte nach dem ersten Gebrauch verworfen werden.
Zusammensetzung von Lidocain HCI 2% Gelee 30 mL und 5 mL Tuben: Jeder mL enthält 20 mg Lidocain HCI. Die Formulierung enthält außerdem Methylparaben, Propylparaben, Hypromellose und Natriumhydroxid und/oder Salzsäure, um den pH-Wert auf 6,0 bis 7,0 einzustellen.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus: Lidocain stabilisiert die Neuronenmembran durch Hemmung der Ionenflüsse, die für die Einleitung und Weiterleitung von Impulsen erforderlich sind, und bewirkt dadurch eine lokalanästhetische Wirkung.
Wirkungseintritt: Der Wirkungseintritt liegt bei 3 bis 5 Minuten. Es ist unwirksam, wenn es auf intakter Haut angewendet wird.
Hämodynamik: Überhöhte Blutspiegel können zu Veränderungen des Herzzeitvolumens, des gesamten peripheren Widerstands und des mittleren arteriellen Drucks führen. Diese Veränderungen können auf eine direkte depressive Wirkung des Lokalanästhetikums auf verschiedene Komponenten des kardiovaskulären Systems zurückzuführen sein.
Pharmakokinetik und Metabolismus: Lidocain kann nach topischer Verabreichung auf die Schleimhäute absorbiert werden, wobei die Geschwindigkeit und das Ausmaß der Absorption von der Konzentration und der verabreichten Gesamtdosis, der spezifischen Applikationsstelle und der Dauer der Exposition abhängen. Im Allgemeinen erfolgt die Absorption von Lokalanästhetika nach örtlicher Anwendung am schnellsten nach intratrachealer Verabreichung. Lidocain wird auch aus dem Magen-Darm-Trakt gut resorbiert, doch kann es sein, dass aufgrund der Biotransformation in der Leber nur wenig intaktes Arzneimittel in den Blutkreislauf gelangt.
Lidocain wird von der Leber rasch metabolisiert, und die Metaboliten sowie das unveränderte Arzneimittel werden über die Nieren ausgeschieden. Die Biotransformation umfasst oxidative N-Dealkylierung, Ringhydroxylierung, Spaltung der Amidbindung und Konjugation. Die N-Dealkylierung, ein Hauptweg der Biotransformation, führt zu den Metaboliten Monoethylglycinexylidid und Glycinexylidid. Die pharmakologischen/toxikologischen Wirkungen dieser Metaboliten ähneln denen von Lidocain, sind aber weniger stark als diese. Etwa 90 % des verabreichten Lidocains werden in Form verschiedener Metaboliten ausgeschieden, und weniger als 10 % werden unverändert ausgeschieden. Der primäre Metabolit im Urin ist ein Konjugat von 4-Hydroxy-2,6-dimethylanilin.
Die Plasmabindung von Lidocain ist abhängig von der Wirkstoffkonzentration, und die gebundene Fraktion nimmt mit steigender Konzentration ab. Bei Konzentrationen von 1 bis 4 mcg freier Base pro ml sind 60 bis 80 Prozent des Lidocains proteingebunden. Die Bindung hängt auch von der Plasmakonzentration des Alpha-I-Säure-Glykoproteins ab.
Lidocain überwindet die Blut-Hirn-Schranke und die Plazentaschranke, vermutlich durch passive Diffusion.
Studien zum Lidocain-Metabolismus nach intravenösen Bolusinjektionen haben gezeigt, dass die Eliminationshalbwertszeit dieses Wirkstoffs typischerweise 1,5 bis 2,0 Stunden beträgt. Aufgrund der schnellen Metabolisierung von Lidocain kann jeder Zustand, der die Leberfunktion beeinflusst, die Kinetik von Lidocain verändern. Die Halbwertszeit kann sich bei Patienten mit Leberfunktionsstörungen um das Zweifache oder mehr verlängern. Nierenfunktionsstörungen haben keinen Einfluss auf die Lidocain-Kinetik, können aber die Akkumulation von Metaboliten erhöhen.
Faktoren wie Azidose und die Einnahme von ZNS-Stimulanzien und Depressiva beeinflussen die ZNS-Spiegel von Lidocain, die erforderlich sind, um sichtbare systemische Wirkungen hervorzurufen. Objektive unerwünschte Wirkungen werden mit zunehmenden venösen Plasmaspiegeln von mehr als 6 mcg freier Base pro mL immer deutlicher. Beim Rhesusaffen haben sich arterielle Blutspiegel von 18 bis 21 mcg/ml als Schwellenwert für krampfartige Aktivität erwiesen.
ANWENDUNG UND EINSATZBEREICH
Lidocain HCI 2% Gelee ist indiziert zur Vorbeugung und Kontrolle von Schmerzen bei Eingriffen an der männlichen und weiblichen Harnröhre, zur topischen Behandlung von schmerzhafter Harnröhrenentzündung und als anästhesierendes Gleitmittel bei endotrachealer Intubation (oral und nasal).
KONTRAINDIKATIONEN
Lidocain ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen Lokalanästhetika des Amidtyps oder gegen andere Bestandteile von Lidocain HCI 2% Gelee.
WARNHINWEISE
Eine übermäßige Dosierung oder kurze Intervalle zwischen den Dosen können zu hohen Plasmaspiegeln und schwerwiegenden unerwünschten Wirkungen führen. DIE PATIENTEN SOLLTEN ANGEWIESEN WERDEN, SICH STRIKT AN DIE EMPFOHLENEN DOSIERUNGS- UND VERABREICHUNGSRICHTLINIEN ZU HALTEN, WIE SIE IN DIESER PACKUNGSBEILAGE AUFGEFÜHRT SIND. DIE BEHANDLUNG SCHWERER UNERWÜNSCHTER REAKTIONEN KANN DEN EINSATZ VON ERSATZMITTELN, OXYGEN UND ANDEREN ERSATZMITTELN ERFORDERLICH MACHEN.
Lidocain HCI 2% Gelee sollte bei Vorliegen einer Sepsis oder einer schwer traumatisierten Schleimhaut im Anwendungsgebiet mit äußerster Vorsicht angewendet werden, da unter solchen Bedingungen die Möglichkeit einer schnellen systemischen Resorption besteht.
Bei der Verwendung zur Schmierung des Endotrachealtubus ist darauf zu achten, dass das Produkt nicht in das Lumen des Tubus eingeführt wird. Verwenden Sie das Gelee nicht zum Schmieren der Endotrachealtubenstilettes. Wenn das Gelee in das innere Lumen gelangt, kann es auf der inneren Oberfläche antrocknen und einen Rückstand hinterlassen, der dazu neigt, bei Flexion zu verklumpen und das Lumen zu verengen. In seltenen Fällen wurde berichtet, dass dieser Rückstand zu einem Verschluss des Lumens geführt hat. (Siehe auch UNERWÜNSCHTE REAKTIONEN und DOSIERUNG UND ANWENDUNG.)
VORSICHTSMASSNAHMEN
Allgemein: Die Sicherheit und Wirksamkeit von Lidocain hängen von der richtigen Dosierung, der korrekten Technik, angemessenen Vorsichtsmaßnahmen und der Bereitschaft für Notfälle ab. (Siehe WARNHINWEISE und UNERWÜNSCHTE REAKTIONEN.) Die niedrigste Dosis, die zu einer wirksamen Anästhesie führt, sollte verwendet werden, um hohe Plasmaspiegel und schwere unerwünschte Wirkungen zu vermeiden. Wiederholte Gaben von Lidocain können aufgrund der langsamen Akkumulation des Arzneimittels oder seiner Metaboliten mit jeder wiederholten Gabe zu einem erheblichen Anstieg der Blutspiegel führen. Die Toleranz gegenüber erhöhten Blutspiegeln variiert mit dem Zustand des Patienten. Geschwächte, ältere Patienten, akut kranke Patienten und Kinder sollten eine ihrem Alter und Gesundheitszustand entsprechende reduzierte Dosis erhalten. Lidocain sollte auch bei Patienten mit schwerem Schock oder Herzblock mit Vorsicht angewendet werden.
Lidocain HCI 2% Gelee sollte bei Patienten mit bekannten Arzneimittelüberempfindlichkeiten mit Vorsicht angewendet werden. Bei Patienten, die gegen para-Aminobenzoesäure-Derivate (Procain, Tetracain, Benzocain usw.) allergisch sind, wurde keine Kreuzsensitivität gegenüber Lidocain festgestellt.
Viele Arzneimittel, die bei der Durchführung einer Anästhesie verwendet werden, gelten als potentielle Auslöser einer familiären malignen Hyperthermie. Da nicht bekannt ist, ob Lokalanästhetika vom Amid-Typ diese Reaktion auslösen können, und da die Notwendigkeit einer zusätzlichen Allgemeinanästhesie nicht vorhergesagt werden kann, wird vorgeschlagen, dass ein Standardprotokoll für die Behandlung zur Verfügung stehen sollte. Frühe unerklärliche Anzeichen wie Tachykardie, Tachypnoe, labiler Blutdruck und metabolische Azidose können einem Temperaturanstieg vorausgehen. Der Erfolg hängt von einer frühzeitigen Diagnose, dem unverzüglichen Absetzen des/der verdächtigen Auslöser(s) und der Einleitung einer Behandlung ab, die eine Sauerstofftherapie, angezeigte unterstützende Maßnahmen und Dantrolen einschließt (lesen Sie vor der Anwendung die Packungsbeilage von Dantrolen-Natrium intravenös).
Informationen für Patienten: Bei der Anwendung von Lokalanästhetika im Mund sollte sich der Patient darüber im Klaren sein, dass die Erzeugung der Lokalanästhesie das Schlucken beeinträchtigen und damit die Gefahr der Aspiration erhöhen kann. Aus diesem Grund sollte nach der Anwendung von Lokalanästhetika im Mund- oder Rachenraum 60 Minuten lang keine Nahrung aufgenommen werden. Dies ist besonders wichtig bei Kindern, da sie häufig essen.
Eine Taubheit der Zunge oder der Wangenschleimhaut kann die Gefahr eines unbeabsichtigten Beißtraumas erhöhen. Essen oder Kaugummi sollten nicht eingenommen werden, während der Mund- oder Rachenraum betäubt ist.
Karzinogenese – Es wurden keine Langzeitstudien an Tieren durchgeführt, um das karzinogene Potenzial von Lidocain zu bewerten.
Mutagenese – Das mutagene Potential von Lidocain wurde im Ames-Salmonella-Rückmutationstest, im In-vitro-Chromosomenaberrations-Test an menschlichen Lymphozyten und in einem In-vivo-Mikronukleustest an Mäusen getestet. In diesen Studien ergaben sich keine Hinweise auf eine mutagene Wirkung.
Beeinträchtigung der Fruchtbarkeit – Die Wirkung von Lidocain auf die Fruchtbarkeit wurde im Rattenmodell untersucht. Die Verabreichung von 30 mg/kg, s.c. (180 mg/m2) an das Paarungspaar führte nicht zu Veränderungen der Fruchtbarkeit oder der allgemeinen Reproduktionsleistung von Ratten. Es gibt keine Studien, die die Wirkung von Lidocain auf die Spermienparameter untersuchen. Es gab keine Hinweise auf eine veränderte Fruchtbarkeit.
Verwendung in der Schwangerschaft:
Teratogene Wirkungen: Schwangerschaftskategorie B.
Reproduktionsstudien für Lidocain wurden sowohl an Ratten als auch an Kaninchen durchgeführt. Im Rattenmodell gab es keine Hinweise auf eine Schädigung des Fötus bei subkutanen Dosen von bis zu 50 mg/kg Lidocain (300 mg/m2 bezogen auf die Körperoberfläche). Im Kaninchenmodell gab es keine Hinweise auf eine Schädigung des Fötus bei einer Dosis von 5 mg/kg, s.c. (60 mg/m2 auf Basis der Körperoberfläche). Die Behandlung von Kaninchen mit 25 mg/kg (300 mg/m2) erbrachte Hinweise auf maternale Toxizität und Hinweise auf eine verzögerte fetale Entwicklung, einschließlich einer nicht signifikanten Abnahme des fetalen Gewichts (7 %) und einer Zunahme kleinerer Skelettanomalien (Schädel- und Sternebraldefekt, verminderte Verknöcherung der Phalangen). Die Wirkung von Lidocain auf die postnatale Entwicklung wurde bei Ratten untersucht, indem trächtige weibliche Ratten ab dem 15. Tag der Schwangerschaft und bis zu 20 Tage post partum täglich subkutan mit Dosen von 2, 10 und 50 mg/kg (12, 60 und 300 mg/m2) behandelt wurden. Bis einschließlich der Dosis von 10 mg/kg (60 mg/m2) wurden weder bei den Muttertieren noch bei den Welpen Anzeichen für schädliche Wirkungen festgestellt; allerdings war die Zahl der überlebenden Welpen bei 50 mg/kg (300 mg/m2) sowohl bei der Geburt als auch während der Laktationsperiode reduziert, wobei diese Wirkung höchstwahrscheinlich auf die mütterliche Toxizität zurückzuführen ist. In dieser Studie wurden keine weiteren Auswirkungen auf die Wurfgröße, das Wurfgewicht, Anomalien bei den Welpen und die körperliche Entwicklung der Welpen festgestellt.
In einer zweiten Studie wurden die Auswirkungen von Lidocain auf die postnatale Entwicklung bei Ratten untersucht, wobei die Welpen von der Entwöhnung bis zur Geschlechtsreife beobachtet wurden. Die Ratten wurden 8 Monate lang mit 10 oder 30 mg/kg s.c. Lidocain (60 mg/m2 bzw. 180 mg/m2 auf Basis der Körperoberfläche) behandelt. Dieser Zeitraum erstreckte sich über 3 Paarungsperioden. Es gab keine Hinweise auf eine veränderte postnatale Entwicklung bei den Nachkommen; beide Lidocain-Dosen verringerten jedoch signifikant die durchschnittliche Anzahl der Welpen pro Wurf, die bis zur Entwöhnung der Nachkommen aus den ersten beiden Paarungsperioden überlebten.
Es gibt jedoch keine angemessenen und gut kontrollierten Studien an schwangeren Frauen. Da Reproduktionsstudien an Tieren nicht immer auf die Reaktion beim Menschen schließen lassen, sollte dieses Arzneimittel während der Schwangerschaft nur bei eindeutigem Bedarf angewendet werden.
Geburtshilfe: Lidocain ist bei Wehen und Entbindung nicht kontraindiziert. Sollte Lidocain HCl 2% Gelee gleichzeitig mit anderen Lidocain-haltigen Produkten angewendet werden, muss die Gesamtdosis aller Formulierungen berücksichtigt werden.
Stillende Mütter: Lidocain wird in die Muttermilch ausgeschieden. Die klinische Bedeutung dieser Beobachtung ist nicht bekannt. Bei der Verabreichung von Lidocain an eine stillende Frau ist Vorsicht geboten.
Pädiatrische Anwendung: Obwohl die Sicherheit und Wirksamkeit von Lidocain 2% Gelee bei pädiatrischen Patienten nicht erwiesen ist, wurde in einer Studie mit 19 Frühgeborenen (Gestationsalter <33 Wochen) keine Korrelation zwischen der Plasmakonzentration von Lidocain oder Monoethylglycinexylidid und dem Körpergewicht des Säuglings festgestellt, wenn mäßige Mengen Lidocain (d.h. 0,3 ml/kg Lidocain-Gel 20 mg/ml) zur Schmierung sowohl der intranasalen als auch der endotrachealen Tuben verwendet wurden. Bei keinem Neugeborenen wurden Lidocain-Plasmaspiegel über 750 mcg/L festgestellt. Die Dosierung bei Kindern sollte entsprechend dem Alter, dem Körpergewicht und der körperlichen Verfassung reduziert werden. (Siehe DOSIERUNG UND ANWENDUNG.)
Nebenwirkungen
Nebenwirkungen nach der Verabreichung von Lidocain sind von ähnlicher Art wie bei anderen Amid-Lokalanästhetika. Diese unerwünschten Wirkungen sind im Allgemeinen dosisabhängig und können auf hohe Plasmaspiegel infolge einer übermäßigen Dosierung oder einer schnellen Resorption zurückzuführen sein oder auf eine Überempfindlichkeit, Idiosynkrasie oder eine verminderte Toleranz seitens des Patienten. Schwerwiegende unerwünschte Wirkungen sind im Allgemeinen systemischer Natur. Die folgenden Arten sind die am häufigsten berichteten:
Es gab seltene Berichte über einen Verschluss des Endotrachealtubus in Verbindung mit dem Vorhandensein von getrockneten Gelee-Resten im inneren Lumen des Tubus. (Siehe auch WARNHINWEISE und DOSIERUNG UND ANWENDUNG.)
Zentralnervensystem: ZNS-Manifestationen sind erregend und/oder depressiv und können gekennzeichnet sein durch Benommenheit, Nervosität, Beklemmung, Euphorie, Verwirrung, Schwindel, Schläfrigkeit, Tinnitus, verschwommenes oder doppeltes Sehen, Erbrechen, Hitze-, Kälte- oder Taubheitsgefühle, Zuckungen, Zittern, Krämpfe, Bewusstlosigkeit, Atemdepression und Atemstillstand. Die Erregungserscheinungen können sehr kurz sein oder überhaupt nicht auftreten; in diesem Fall kann die erste Manifestation der Toxizität Schläfrigkeit sein, die in Bewusstlosigkeit und Atemstillstand übergeht.
Schläfrigkeit nach der Verabreichung von Lidocain ist in der Regel ein frühes Anzeichen für einen hohen Blutspiegel des Arzneimittels und kann als Folge einer schnellen Resorption auftreten.
Kardiovaskuläres System: Kardiovaskuläre Manifestationen sind in der Regel depressiv und zeichnen sich durch Bradykardie, Hypotonie und kardiovaskulären Kollaps aus, der zum Herzstillstand führen kann.
Allergisch: Allergische Reaktionen sind durch Hautveränderungen, Urtikaria, Ödeme oder anaphylaktoide Reaktionen gekennzeichnet. Allergische Reaktionen können als Folge einer Überempfindlichkeit gegenüber dem Lokalanästhetikum oder anderen Bestandteilen der Formulierung auftreten. Allergische Reaktionen infolge einer Überempfindlichkeit gegenüber Lidocain sind äußerst selten und sollten, wenn sie auftreten, mit konventionellen Mitteln behandelt werden. Der Nachweis der Empfindlichkeit durch Hauttests ist von zweifelhaftem Wert.
ÜBERDOSIERUNG
Akute Notfälle durch Lokalanästhetika stehen im Allgemeinen im Zusammenhang mit hohen Plasmaspiegeln, die bei der therapeutischen Anwendung von Lokalanästhetika auftreten. (Siehe UNERWÜNSCHTE REAKTIONEN, WARNUNGEN und VORSICHTSMASSNAHMEN.)
Management von Lokalanästhetika-Notfällen: An erster Stelle steht die Vorbeugung, die am besten durch sorgfältige und ständige Überwachung der kardiovaskulären und respiratorischen Vitalzeichen und des Bewusstseinszustandes des Patienten nach jeder Lokalanästhesie-Verabreichung erreicht wird. Bei den ersten Anzeichen einer Veränderung sollte Sauerstoff verabreicht werden.
Der erste Schritt bei der Behandlung von Krämpfen besteht in der sofortigen Aufrechterhaltung eines freien Atemweges und einer assistierten oder kontrollierten Beatmung mit Sauerstoff und einem System, das einen sofortigen positiven Atemwegsdruck per Maske ermöglicht. Unmittelbar nach Einleitung dieser Beatmungsmaßnahmen sollte die Angemessenheit des Kreislaufs beurteilt werden, wobei zu berücksichtigen ist, dass die zur Behandlung von Krämpfen verwendeten Medikamente bei intravenöser Verabreichung manchmal den Kreislauf beeinträchtigen. Sollten die Krämpfe trotz adäquater Atemunterstützung anhalten und der Zustand des Kreislaufs dies zulassen, können kleine Mengen eines ultrakurz wirksamen Barbiturats (wie Thiopental oder Thiamylal) oder eines Benzodiazepins (wie Diazepam) intravenös verabreicht werden. Der Kliniker sollte vor der Anwendung von Lokalanästhetika mit diesen krampflösenden Medikamenten vertraut sein. Die unterstützende Behandlung der Kreislaufdepression kann die Verabreichung von intravenöser Flüssigkeit und gegebenenfalls eines Vasopressors entsprechend der klinischen Situation (z. B. Ephedrin) erfordern.
Wenn sie nicht sofort behandelt werden, können sowohl die Krämpfe als auch die Kreislaufdepression zu Hypoxie, Azidose, Bradykardie, Arrhythmien und Herzstillstand führen. Sollte es zu einem Herzstillstand kommen, sollten die üblichen kardiopulmonalen Wiederbelebungsmaßnahmen eingeleitet werden.
Die Dialyse ist bei der Behandlung einer akuten Überdosierung mit Lidocain von vernachlässigbarem Wert.
Die orale LD50 von Lidocain HCI beträgt bei nicht nüchternen weiblichen Ratten 459 (346 bis 773) mg/kg (als Salz) und 214 (159 bis 324) mg/kg (als Salz) bei nüchternen weiblichen Ratten.
DOSIERUNG UND ANWENDUNG
Wenn Lidocain HCI 2% Jelly gleichzeitig mit anderen Lidocain-haltigen Produkten angewendet wird, muss die Gesamtdosis aller Formulierungen berücksichtigt werden.
Die Dosierung variiert und hängt von dem zu betäubenden Bereich, der Vaskularität des Gewebes, der individuellen Toleranz und der Anästhesietechnik ab. Es sollte die niedrigste Dosis verabreicht werden, die für eine wirksame Anästhesie erforderlich ist. Bei Kindern, älteren und geschwächten Patienten sollte die Dosis reduziert werden. Obwohl die Inzidenz von unerwünschten Wirkungen bei Lidocain HCI 2% Jelly recht gering ist, ist Vorsicht geboten, insbesondere bei der Anwendung großer Mengen, da die Inzidenz von unerwünschten Wirkungen direkt proportional zur Gesamtdosis des verabreichten Lokalanästhetikums ist.
Für die Oberflächenanästhesie der männlichen Harnröhre bei Erwachsenen: Bei Verwendung von 30-mL-Röhrchen mit Lidocain 2% Gelee den Kunststoffkonus 5 Minuten lang in kochendem Wasser sterilisieren, abkühlen lassen und auf das Röhrchen aufstecken. Der Konus kann je nach Wunsch gassterilisiert oder kalt sterilisiert werden. Langsam etwa 15 ml (300 mg Lidocain HCI) in die Harnröhre einträufeln oder bis der Patient ein Spannungsgefühl verspürt. Anschließend wird eine Penisklemme für mehrere Minuten an der Corona angebracht. Eine zusätzliche Dosis von nicht mehr als 15 mL (300 mg) kann für eine ausreichende Anästhesie verabreicht werden.
Vor der Sondierung oder Zystoskopie sollte eine Penisklemme für 5 bis 10 Minuten angelegt werden, um eine ausreichende Anästhesie zu erreichen. Eine Gesamtdosis von 30 ml (600 mg) ist in der Regel erforderlich, um die männliche Harnröhre zu füllen und zu erweitern.
Vor der Katheterisierung sind kleinere Mengen von 5 bis 10 ml (100 bis 200 mg) in der Regel ausreichend für die Schmierung.
Für die Oberflächenanästhesie der weiblichen Harnröhre: Bei der Verwendung von 30-mL-Röhrchen mit Lidocain 2% Gelee den Kunststoffkegel 5 Minuten lang in kochendem Wasser sterilisieren, abkühlen lassen und am Röhrchen befestigen. Der Konus kann je nach Wunsch gassterilisiert oder kalt sterilisiert werden. Langsam 3 bis 5 mL (60 bis 100 mg Lidocain HCI) des Gelees in die Harnröhre einträufeln. Falls gewünscht, kann etwas Gelee auf ein Wattestäbchen aufgetragen und in die Harnröhre eingeführt werden. Um eine adäquate Anästhesie zu erreichen, sollte vor urologischen Eingriffen einige Minuten gewartet werden.
Gleitmittel für die endotracheale Intubation: Tragen Sie kurz vor der Anwendung eine mäßige Menge Gelee auf die Außenfläche des Endotrachealtubus auf. Es sollte darauf geachtet werden, dass das Produkt nicht in das Lumen des Tubus gelangt. Verwenden Sie das Gelee nicht zum Schmieren von Endotrachealtuben. Siehe WARNHINWEISE und UNERWÜNSCHTE REAKTIONEN zu seltenen Berichten über einen Verschluss des inneren Lumens. Es wird auch empfohlen, die Verwendung von Endotrachealtuben mit getrocknetem Gelee auf der Außenfläche zu vermeiden, da es keine Schmierwirkung hat.
HÖCHSTDOSIERUNG
In einem Zeitraum von 12 Stunden sollten nicht mehr als 600 mg Lidocain-HCI verabreicht werden.
Kinder: Es ist schwierig, eine Höchstdosis eines Arzneimittels für Kinder zu empfehlen, da diese in Abhängigkeit von Alter und Gewicht variiert. Für Kinder unter zehn Jahren, die eine normale fettfreie Körpermasse und eine normale Entwicklung des fettfreien Körpers haben, kann die Höchstdosis durch Anwendung einer der Standardformeln für Kinderarzneimittel (z. B. Clarks Regel) bestimmt werden. Zum Beispiel sollte die Dosis von Lidocainhydrochlorid bei einem fünfjährigen Kind mit einem Gewicht von 50 Pfund nicht mehr als 75 bis 100 mg betragen, wenn sie nach der Clarkschen Regel berechnet wird. In jedem Fall sollte die maximale Menge an verabreichtem Lidocainhydrochlorid 4,5 mg/kg (2 mg/lb) Körpergewicht nicht überschreiten.
VERSORGUNGSWEISE
Lidocainhydrochlorid 2% Gelee wird in den aufgeführten Darreichungsformen geliefert.
NDC 17478-840-30 30-mL-Aluminiumtube
NDC 17478-840-05 5-mL-Aluminiumtube
Im 30-mL-Karton sind ein abnehmbarer Applikatorkegel und ein Schlüssel zum Ausdrücken des Inhalts enthalten.
Lagerung: Bei 20° bis 25°C (68° bis 77°F) lagern.
PREMIERProRx®
Hergestellt von:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® ist ein eingetragenes Warenzeichen von Premier Inc, verwendet unter Lizenz.
PLD00N Rev. 10/15
Hauptanzeigetafeltext für Behälteretikett:
NDC 17478-840-05 Premier Logo
Lidocainhydrochlorid-Gelee USP, 2%
Nur Rx
Steril 5 mL

Hauptanzeigetafeltext für Kartonetikett:
NDC 17478-840-05 Steril 5 mL
Lidocainhydrochlorid-Gelee USP, 2%
Nur Rx
Premier Logo

| LIDOCAINE Lidocainhydrochlorid-Gelee |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler -. Akorn, Inc. (117696770)
Registrant – Akorn Operating Company LLC (117693100)
| Einrichtung | |||
| Name | Adresse | ID/FEI | Operations |
| Akorn, Inc | 117696840 | MANUFACTURE(17478-840), ANALYSIS(17478-840), STERILIZE(17478-840), PACK(17478-840), LABEL(17478-840) | |
Mehr über Lidocain topisch
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungshinweise
- Wechselwirkungen
- Vergleich von Alternativen
- Preisangaben&Gutscheine
- En Español
- 208 Bewertungen
- Medikamentenklasse: Topische Anästhetika
- FDA-Warnungen (5)
Ressourcen für Verbraucher
- Patienteninformationen
- Lidocain Topische Anwendung (Erweiterte Lektüre)
Ressourcen für Fachleute
- Rezeptinformationen
- Lidocain (topische Anwendung) (Professionelle Patientenberatung)
- Lidocain Creme (FDA)
- Lidocain Gel (FDA)
- Lidocain Laryngotracheal Lösung (FDA)
- … +9 mehr
Andere Marken Lidocaine Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 mehr
Verwandte Behandlungsleitfäden
- Anal Juckreiz
- Magen-Darm-Chirurgie
- Anästhesie
- Verbrennungen, externe
- … +9 mehr
Medizinischer Haftungsausschluss
