Einführung in Cyclin
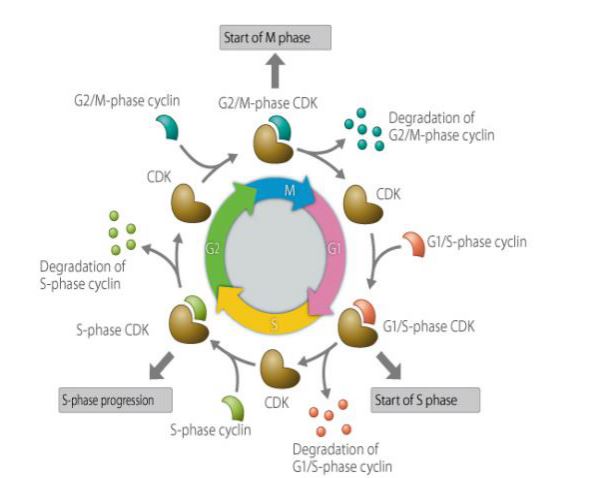
Cyclin ist eine Art von Protein, das im Zellzyklus exprimiert, akkumuliert und abgebaut wird, und es interagiert mit Cyclin-abhängigen Kinasen, um die Zellzyklusfunktion zu beeinflussen. Cyclin ist an zellzyklusregulierten Proteinen beteiligt, und seine Konzentration ist zyklisch und zyklisch im Zellzyklus. Je nach Stadium des Zellzyklus ist die Konzentration manchmal mehrere tausend Mal so hoch, manchmal sinkt sie auf Null. Als regulatorische Untereinheit bindet das Cyclin an Cyclin-abhängige Proteinkinasen und aktiviert diese. Verschiedene Cycline werden in verschiedenen Phasen des Zellzyklus exprimiert. In Säugetierzellen beginnt Cyclin A in der frühen G1-Phase zu exprimieren und akkumuliert sich allmählich bis zur G1/S-Grenze, und der Gehalt erreicht sein Maximum in der G2/M-Phase. Cyclin B wird ab der späten G1-Phase exprimiert und reichert sich allmählich an. Es erreicht sein Maximum in der späten G2-Phase und verbleibt bis zur Mitte der M-Phase, um dann rasch abgebaut zu werden. Cyclin D, ein Cyclin der G1-Phase, wird im Zellzyklus kontinuierlich exprimiert, während Cyclin E in der späten M-Phase und der frühen G1-Phase zu exprimieren beginnt und sich allmählich anreichert, wobei es in der späten G1-Phase ein Maximum erreicht, dann allmählich seinen Höchstgehalt erreicht und bis zur späten G2-Phase abnimmt. Cyclin spielt eine wichtige Rolle bei der Regulierung des Zellzyklus. Die Erforschung des Mechanismus der Cycline ist für die Behandlung von Krebs von großer Bedeutung.
Die Mitglieder der Cyclin-Familie und ihre jeweiligen Funktionen
Bislang wurden die menschlichen Cycline isoliert und in insgesamt 8 Kategorien, nämlich A bis H, benannt, zu denen auch einige Unterklassen (wie Cyclin D1, D2, D3) gehören, von denen F, G und H die jüngsten Entdecker sind. Alle Cycline weisen bestimmte Ähnlichkeiten in der Aminosäuresequenz auf und dienen somit als molekulare Strukturmarker der Cycline. Diese homologe Aminosäureregion im Cyclin ist die so genannte Cyclin-Kassette, eine hoch konservierte 100-150 Aminosäuren umfassende Sequenzregion zwischen Cyclinen verschiedener Organismen. Das menschliche Cyclin enthält ebenfalls eine defekte Kassette oder eine Aminosäuresequenzregion, die reich an Prolin-, Glutaminsäure-, Asparaginsäure-, Serin- und Threoninresten ist (im Folgenden als PEST-Aminosäuresequenzregion bezeichnet). Die Bindung von Cyclin B an die cyclinabhängige Kinase p34CDC2 steuert den Eintritt und den Austritt aus der Mitose. Cyclin B wird von der S-Phase bis zur G2/M-Phase synthetisiert, reichert sich allmählich an und bindet an p34CDC2. In der M-Phase wird es allmählich abgebaut; das Verlassen der M-Phase hängt dagegen vom schnellen Abbau des Cyclins in der Spätphase der Teilung ab, was zur Freisetzung der inaktiven Untereinheit p34CDC2 führt. In menschlichen Zellen reichert sich Cyclin B im Zytoplasma an und gelangt in den Zellkern, bevor die Kernmembran verschwindet. Nach seiner Aktivierung phosphoryliert Cyclin B/CDC eine Reihe von Proteinen, darunter Lamin, Vimentin und Kalzium, die eine wichtige Rolle bei der Chromosomenkonzentration, dem Zerfall der Kernmembran, der Depolymerisation der Zwischenfilamente und der Reorganisation der Mikrofilamente spielen. Cyclin B spielt auch eine wichtige Rolle beim Phasenübergang der Mitose und ist ein klassisches Spaltungszyklusprotein. Cyclin A spielt sowohl beim G2/M- als auch beim G1/S-Phasenübergang eine Rolle. Es tritt vor dem Beginn der DNA-Synthese auf, steigt allmählich bis zum Stadium vor der Spaltung an und wird in der mittleren Phase abgebaut. Wenn es die Mitose einleitet, unterscheidet es sich in vielerlei Hinsicht von dem echten mitotischen Cyclin B. Der Cyclin-C-Gehalt ändert sich während des gesamten Zellzyklus nur wenig, mit einem leichten Anstieg im frühen G1. Die mRNA von Cyclin C erreicht in synchronisierten HeLa-Zellen ihren Höhepunkt in der Mitte von G1, also früher als Cyclin A, das möglicherweise eine Rolle im G1 spielt. Cyclin E hat eine ausgeprägte periodische Expression im Zellzyklus, und sein Peak liegt beim Übergang von der G1- zur S-Phase. Es hat die Aufgabe, den Eintritt der Zelle in die S-Phase zu steuern, was der geschwindigkeitsbeschränkende Faktor beim Übergang von der G1- zur S-Phase sein kann. In Säugetierzellen bindet es wie Cyclin A an p33CDK2, einen Komplex, der in der frühen G1- und S-Phase Histon-H1-Kinase-Aktivität hat, aber Cyclin A und E können mit Retinoblastom-Protein interagieren, um Komplexe zu trennen, was darauf hindeutet, dass CDK2/Cyclin A- oder E-Komplexe die Genexpression in der G1- und S-Phase indirekt regulieren können. Cyclin E könnte eine Rolle bei Cyclin D spielen, das eine wichtige Rolle bei der Einleitung der DNA-Replikation und der G1/S-Umwandlung spielt und dessen Überexpression den Eintritt der Zelle in die S-Phase beschleunigt. Cyclin D kann die frühe G1-Phase des Prozesses kontrollieren, entweder vor oder gleichzeitig mit Cyclin E. Cyclin D hat drei Subtypen (D1, D2, D3), und seine Expression variiert von Zelle zu Zelle und wird von verschiedenen chromosomalen Regionen kontrolliert (D1: 11q13; D2: 12p13; D3: 6p21). Die Subtypen können unterschiedliche Wirkungen haben. Die bemerkenswerten Merkmale von Cyclin D sind: Es wird als Reaktion auf externe Stimuli zur Expression veranlasst, zeigt eine hohe Wachstumsfaktor-Induzierbarkeit und fungiert als Wachstumsfaktor-Sensor, der eine wichtige Rolle bei der Verknüpfung externer Signale mit dem inneren Zellzyklus spielt. Diese Rolle wiederum führt dazu, dass seine unkontrollierte Expression den Zellzyklus nicht mehr oder weniger abhängig von Wachstumsfaktoren macht und Krebs auslösen kann. Der Cyclin D-CDK-Komplex ist der beste Kandidat für die Retinoblastom (Rb)-Proteinkinase im G1-Stadium. Cyclin D bindet an die N-terminale Region des Rb-Proteins, phosphoryliert Rb in der späten G1-Phase, und die Synthese und Aktivierung von Cyclin D1 führt zur Inaktivierung der Rb-Phosphorylierung und zur Herabregulierung von Cyclin D1, und der D1-CDK4-Komplex bildet in der G1-Phase eine negative Rückkopplung, die wiederum die Expression von Cyclin D1 herunterfährt. Cyclin D und Rb spielen eine wichtige Rolle bei der Zellproliferation und -differenzierung, wenn Cyclin D1 in der G1-Phase unterschiedlich ist. In der Quell-Expression ist die Rb-Phosphorylierung früher als normal; die G1-Phase wird beschleunigt, und der Anti-Cyclin-D1-Antikörper wird in die G1-Früh- bis Metaphase-Zellen mikroinjiziert; die meisten Zellen werden vor der S-Phase arretiert, und das Fehlen von funktionellem Rb kann diese Blockierung nicht verursachen; es wird gefolgert, dass die wichtige Rolle von Cyclin D1 darin besteht, die Phosphorylierung von Rb zu inaktivieren und dadurch den Eintritt in die S-Phase und die DNA-Replikation zu induzieren. CyclinF ist das am häufigsten vorkommende Cyclin-Protein (Molekulargewicht 87 kDa), und seine mRNA wird in verschiedenen menschlichen Gewebezellen universell exprimiert, und es gibt signifikante Veränderungen im Zellzyklus. Der Spitzenwert liegt wie bei Cyclin A in der G2-Phase und nimmt ab, bevor der mRNA-Spiegel von Cyclin B sinkt. Das Cyclin-F-Protein reichert sich in der interzellulären Phase an und wird während der Mitosephase zerstört. In den meisten Zellen befindet es sich im Zellkern. Eine Überexpression oder Mutation in menschlichen Zellen führt zu einem Mangel an PEST-Aminosäuresequenzregionen, was zu einem Anstieg in Zellen der G2-Phase führt. Cyclin G ähnelt am meisten dem Cyclin B der Spalthefe, das eine Rolle bei der G1/S-Umwandlung spielt, aber die mRNA von Cyclin G ist nicht offensichtlich zellabhängig, sondern kann durch Zellwachstum stimuliert werden. Der Faktor induziert und hält einen erhöhten Spiegel aufrecht. Das Cyclin-G-Gen enthält zwei verschiedene p53-Bindungsstellen, von denen eine stromaufwärts der Transkriptionsinitiationsstelle liegt, was darauf hindeutet, dass p53 das Cyclin-G-Gen effizient aktivieren kann. Cyclin H, das zumindest in seiner biologischen Wirkung ein nachgeschalteter Vermittler von p53 ist, ist ein Protein mit einem Molekulargewicht von 37 kD, das durch Isolierung und Reinigung der CDK-aktivierenden Kinase (CAK) gefunden wurde.
Funktion von Cyclin
Die Untersuchung des Zusammenhangs zwischen Zellzyklus und Krebs hat eine wegweisende Bedeutung für die klinische Onkologieforschung. Sie kann bestimmte Ziele für die klinische Behandlung liefern, wie z.B. die Blockierung von Cyclin D, oder die Wirkung von Zellzyklus-Inhibitoren nachahmen, um die Teilung von Krebszellen zu hemmen, und einige Indikatoren für die klinische Diagnose, Differentialdiagnose und Prognose liefern. Michaelet al analysierte das bcl-1-Gen-Rearrangement und die Cyclin-D1-Proteinexpression in 32 Fällen von Mantelzell-Lymphom, 17 Fälle von bcl-1-Gen-Rearrangement und 24 Fälle von zytoplasmatischer Cyclin-D1-Expression, und 40 Fälle der Kontrollgruppe nur 9 Fälle von Non-MCL B-Zell-Lymphom waren positiv. Sie sind der Ansicht, dass Cyclin D1 als Differenzialdiagnose für MCL und als Differenzialdiagnose für B-Zell-Lymphome verwendet werden kann. Cyclin wird im Zellzyklus periodisch exprimiert, und bestimmte spezifische Cyclin-CDK-Komplexe sind für das Durchlaufen eines bestimmten Zellzyklus erforderlich, was darauf hindeutet, dass Cyclin als Indikator für den Proliferationszustand von Zellen verwendet werden kann. Das Expressionsverhältnis eines bestimmten Cyclins kann den Anteil der Zellen in einem bestimmten Gewebe in einem bestimmten Zellzyklus vorhersagen. Je bösartiger die Tumorzellen sind, desto schwerwiegender ist die Störung des Zellzyklus, so dass es möglich ist, die Prognose der Patienten durch die im Zellzyklus angezeigten Informationen wiederzugeben und als möglicher prognostischer Indikator zu dienen. Keyomarsi et al. verwendeten 9 Fälle von chirurgischen Brustkrebsproben und angrenzende nicht krebsartige Gewebe als Kontrollstudien: In 8 Fällen von Krebsgewebe wurde Cyclin E in abnormaler Qualität und Quantität exprimiert, und es gab mindestens 3 verschiedene Molekulargewichte. Cyclin E war überexprimiert, während c-erbB2 nur in 3 Fällen überexprimiert war. Mit zunehmendem Tumorstadium stieg der Gehalt an Cyclin-E-Protein deutlich an, während der Gehalt an proliferierendem Zellkernantigen (PCNA) nur geringfügig zunahm. Die Cyclin-E-Struktur wurde in 4 der höchsten Staging-Grade beobachtet. Dutta et al. verwendeten Anti-Cyclin-A-, -B- und -E-Antikörper zum Nachweis von 48 Paraffinschnitten von Brustkrebs und stellten fest, dass der durchschnittliche positive Index von Cyclin A und B mit der Zunahme der S-Phase deutlich anstieg (P < 0,05). Cyclin A war positiv korreliert mit Ki-67 und mit der S-Phasen-Fraktion (P < 0,05). Bellacosaet al untersuchten 51 Fälle von primären Plattenepithelkarzinomen des Kehlkopfes und verfolgten diese über 29 Monate. Es wird angenommen, dass die Cyclin-Genamplifikation als unabhängiger prognostischer Indikator für Kehlkopfkrebs verwendet werden kann. Bettiche et al. untersuchten jedoch 53 Fälle von nicht-kleinzelligem Lungenkrebs mit chirurgischer Resektion, und 25 Fälle wiesen eine Überexpression von Cyclin D1 auf, die mit einer schlechten Gewebedifferenzierung, einer geringeren lymphozytären Infiltration im Tumor und einer niedrigeren lokalen Rezidivrate verbunden war (P < 0,05). Sie glauben, dass größere klinische Studien erforderlich sind, um die prognostische Bedeutung der Cyclin D1-Expression weiter zu testen.
Referenz
- He G, Kuang J, Koomen J, et al. Recruitment of trimeric proliferating cell nuclear antigen by G1-phase cyclin-dependent kinases following DNA damage with platinum-based antitumour agents. British Journal of Cancer. 2013, 109(9):2378-2388.
- Gang W, Cao J, Chen P, et al. Temporal and Spatial Expression of Cyclin H in Rat Spinal Cord Injury. Neuromolecular Medicine. 2011, 13(3):187-196.
- Ibrahim N, Nazimi A J, Ajura A J, et al. The Clinical Features and Expression of bcl-2, Cyclin D1, p53, and Proliferating Cell Nuclear Antigen in Syndromic and Nonsyndromic Keratocystic Odontogenic Tumor. Journal of Craniofacial Surgery. 2016, 27(5):1.
- Wang X, Wolgemuth D J, Baxi L V. Overexpression of HOXB5, cyclin D1 and PCNA in congenital cystic adenomatoid malformation. Fetal Diagnosis & Therapy. 2011, 29(4):315-320.
