 |
|
Säure-Base-Reaktionen sind allgegenwärtig. In wässrigen Lösungen erhöhen Säuren die Wasserstoffionenkonzentration (H+). Basen hingegen erhöhen die Hydroxidionenkonzentration (OH-). Wenn eine Säure und eine Base in einer wässrigen Lösung reagieren, verbinden sich die H+- und OH- Ionen zu Wasser. Diese Ionen „neutralisieren“ sich also gegenseitig:
Die meisten Säuren haben die allgemeine Formel HA, wobei A- ein Anion ist und die meisten Basen haben die Form BOH, wobei B+ ein entsprechendes Kation ist. Säuren und Basen lassen sich in zwei allgemeine Typen einteilen: starke und schwache Säuren und Basen. Der Unterschied zwischen den beiden ist einfach: Eine starke Säure zerfällt in einer wässrigen Lösung zu 100 % in ein Proton (H+) und ein Anion (A-)
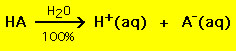
Die meisten schwachen Säuren hingegen zerfallen in einer wässrigen Lösung zu deutlich weniger als 100 %:
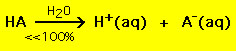 .
.Mit anderen Worten: Die meisten Moleküle schwacher Säuren bleiben in Wasser intakt. Ähnliche chemische Gleichungen gelten für starke und schwache Basen.
Es gibt nur wenige schwache Säuren und Basen, sie sind:
| |
|
|
HCl (Salzsäure) HNO3 (Salpetersäure) HClO4 (Perchlorsäure) H2SO4 (Schwefelsäure) |
NaOH (Natriumhydroxid) KOH (Kaliumhydroxid) Ca(OH)2 (Calciumhydroxid) |
Alle anderen Säuren und Basen sind schwach. Eine schwache Säure entsteht aus einem beliebigen Anion. Beispiele sind unten aufgeführt
| |
|
|
F- (Fluorid) Br- (Bromid) I- (Jodid) HCO3- (Bicarbonat) C2H3O2- (Acetat) MnO4- (Permanganat) PO4-3 (Phosphat) CrO4-2 (Chromat) CN- (Cyanid) NO2- (Nitrit) SO3-2 (Sulfit) |
HF (Flusssäure) HBr (Bromwasserstoffsäure) HI (Jodwasserstoffsäure) H2CO3 (Kohlensäure) HC2H3O2 (Essigsäure) HMnO4 (Permangansäure) H3PO4 (Phosphorsäure Säure) H2CrO4 (Chromsäure) HCN (Blausäure) HNO2 (salpetrige Säure) H2SO3 (schweflige Säure) |
In einer typischen Säure/Base-Reaktion reagieren die Säure und die Base zu einem Salz und Wasser, z.g., Cyanwasserstoffsäure und Natriumhydroxid:
