Lernergebnisse
- Bestimmen Sie die Oktettregel und ihre Rolle bei chemischen Bindungen
Nicht alle Elemente haben genügend Elektronen, um ihre äußersten Schalen zu füllen, aber ein Atom ist am stabilsten, wenn alle Elektronenpositionen in der äußersten Schale besetzt sind. Aufgrund dieser freien Plätze in den äußersten Schalen kommt es zur Bildung chemischer Bindungen oder zu Wechselwirkungen zwischen zwei oder mehr gleichen oder verschiedenen Elementen, die zur Bildung von Molekülen führen. Um eine größere Stabilität zu erreichen, neigen Atome dazu, ihre äußeren Schalen vollständig auszufüllen und sich mit anderen Elementen zu verbinden, um dieses Ziel zu erreichen, indem sie Elektronen teilen, Elektronen von einem anderen Atom aufnehmen oder einem anderen Atom Elektronen spenden. Da die äußersten Schalen der Elemente mit niedriger Ordnungszahl (bis hin zu Kalzium mit der Ordnungszahl 20) acht Elektronen aufnehmen können, wird dies als Oktettregel bezeichnet. Ein Element kann Elektronen abgeben, aufnehmen oder mit anderen Elementen teilen, um seine äußere Schale aufzufüllen und die Oktettregel zu erfüllen.
Ein frühes Modell des Atoms wurde 1913 von dem dänischen Wissenschaftler Niels Bohr (1885-1962) entwickelt. Das Bohrsche Modell zeigt das Atom als einen zentralen Kern mit Protonen und Neutronen, wobei sich die Elektronen in kreisförmigen Elektronenschalen in bestimmten Abständen vom Kern befinden, ähnlich wie Planeten, die die Sonne umkreisen. Jede Elektronenhülle hat ein anderes Energieniveau, wobei die Schalen, die dem Kern am nächsten sind, eine niedrigere Energie haben als die weiter vom Kern entfernten. Konventionell wird jeder Schale eine Nummer und das Symbol n zugewiesen – die Elektronenschale, die dem Kern am nächsten ist, heißt beispielsweise 1n. Um sich zwischen den Schalen bewegen zu können, muss ein Elektron eine Energiemenge aufnehmen oder abgeben, die genau dem Energieunterschied zwischen den Schalen entspricht. Wenn ein Elektron beispielsweise Energie von einem Photon absorbiert, kann es angeregt werden und sich in eine Schale mit höherer Energie bewegen; wenn umgekehrt ein angeregtes Elektron in eine Schale mit niedrigerer Energie zurückfällt, gibt es Energie ab, oft in Form von Wärme.
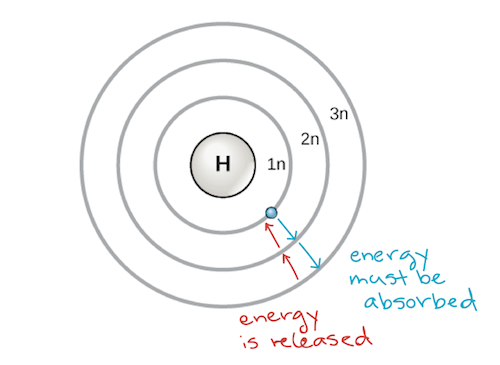
Bohr-Modell eines Atoms, das die Energieniveaus als konzentrische Kreise um den Kern zeigt. Es muss Energie zugeführt werden, um ein Elektron auf ein höheres Energieniveau zu bewegen, und es wird Energie freigesetzt, wenn ein Elektron von einem höheren Energieniveau auf ein niedrigeres fällt. Bildnachweis: modifiziert von OpenStax Biology
Atome neigen, wie andere Dinge, die den Gesetzen der Physik unterliegen, dazu, die energieärmste und stabilste Konfiguration anzunehmen, die sie einnehmen können. So werden die Elektronenschalen eines Atoms von innen nach außen aufgefüllt, wobei die Elektronen die Schalen mit niedriger Energie in der Nähe des Kerns auffüllen, bevor sie in die Schalen mit höherer Energie weiter außen wandern. Die dem Kern am nächsten liegende Schale, 1n, kann zwei Elektronen aufnehmen, die nächste Schale, 2n, acht und die dritte Schale, 3n, bis zu achtzehn.
Die Anzahl der Elektronen in der äußersten Schale eines bestimmten Atoms bestimmt seine Reaktivität oder seine Neigung, chemische Bindungen mit anderen Atomen einzugehen. Diese äußerste Schale wird als Valenzschale bezeichnet, und die darin befindlichen Elektronen werden Valenzelektronen genannt. Im Allgemeinen sind Atome am stabilsten und am wenigsten reaktiv, wenn ihre äußerste Elektronenschale voll ist. Die meisten in der Biologie wichtigen Elemente benötigen acht Elektronen in ihrer äußersten Schale, um stabil zu sein; diese Faustregel wird als Oktettregel bezeichnet. Einige Atome können mit einem Oktett stabil sein, obwohl ihre Valenzschale die 3n-Schale ist, die bis zu 18 Elektronen aufnehmen kann. Wir werden den Grund dafür erforschen, wenn wir weiter unten die Elektronenorbitale besprechen.
Beispiele für einige neutrale Atome und ihre Elektronenkonfigurationen sind unten dargestellt. In dieser Tabelle ist zu sehen, dass Helium eine vollständige Valenzschale hat, mit zwei Elektronen in der ersten und einzigen Schale, 1n,. Ebenso hat Neon eine vollständige äußere 2n-Schale mit acht Elektronen. Diese Elektronenkonfigurationen machen Helium und Neon sehr stabil. Obwohl Argon technisch gesehen keine vollständige äußere Schale hat, da die 3n-Schale bis zu achtzehn Elektronen enthalten kann, ist es wie Neon und Helium stabil, da es acht Elektronen in der 3n-Schale hat und somit die Oktettregel erfüllt. Im Gegensatz dazu hat Chlor nur sieben Elektronen in seiner äußersten Schale, während Natrium nur ein Elektron hat. Diese Muster füllen die äußerste Schale nicht aus und genügen nicht der Oktettregel, wodurch Chlor und Natrium reaktiv sind und gerne Elektronen gewinnen oder verlieren, um eine stabilere Konfiguration zu erreichen.
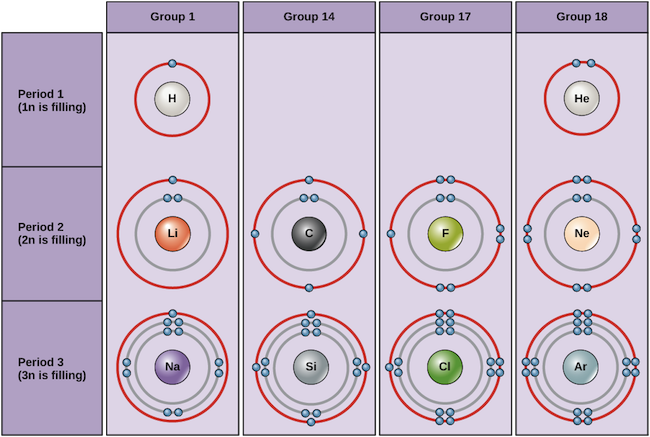
Bohrdiagramme verschiedener Elemente Bildnachweis: OpenStax Biology
Elektronenkonfigurationen und das Periodensystem
Elemente werden im Periodensystem nach ihrer Ordnungszahl geordnet, d. h. danach, wie viele Protonen sie haben. In einem neutralen Atom ist die Anzahl der Elektronen gleich der Anzahl der Protonen, so dass man die Elektronenzahl leicht aus der Ordnungszahl bestimmen kann. Darüber hinaus liefert die Position eines Elements im Periodensystem – seine Spalte oder Gruppe und seine Reihe oder Periode – nützliche Informationen darüber, wie diese Elektronen angeordnet sind.
Betrachten wir nur die ersten drei Reihen der Tabelle, die die wichtigsten Elemente enthalten, die für das Leben wichtig sind, so entspricht jede Reihe der Füllung einer anderen Elektronenschale: Helium und Wasserstoff platzieren ihre Elektronen in der 1n-Schale, während Elemente der zweiten Reihe wie Li damit beginnen, die 2n-Schale zu füllen, und Elemente der dritten Reihe wie Na mit der 3n-Schale fortfahren. In ähnlicher Weise gibt die Spaltennummer eines Elements Auskunft über die Anzahl der Valenzelektronen und die Reaktivität. Im Allgemeinen ist die Anzahl der Valenzelektronen innerhalb einer Spalte gleich und nimmt innerhalb einer Reihe von links nach rechts zu. Elemente der Gruppe 1 haben nur ein Valenzelektron und Elemente der Gruppe 18 haben acht, mit Ausnahme von Helium, das insgesamt nur zwei Elektronen hat. Daher ist die Gruppennummer ein guter Indikator dafür, wie reaktiv die einzelnen Elemente sind:
- Helium (He), Neon (Ne) und Argon (Ar) haben als Elemente der Gruppe 18 volle Außenelektronenschalen oder erfüllen die Oktettregel. Dies macht sie als einzelne Atome sehr stabil. Wegen ihrer Nicht-Reaktivität werden sie als Edelgase bezeichnet.
- Wasserstoff (H), Lithium (Li) und Natrium (Na), als Elemente der Gruppe 1, haben nur ein Elektron in ihrer äußersten Schale. Sie sind als einzelne Atome instabil, können aber stabil werden, indem sie ihr eines Valenzelektron verlieren oder teilen. Wenn diese Elemente ein Elektron vollständig verlieren – was bei Li und Na typischerweise der Fall ist – werden sie zu positiv geladenen Ionen: Li+, Na+.
- Fluor (F) und Chlor (Cl), als Elemente der Gruppe 17, haben sieben Elektronen in ihren äußersten Schalen. Sie neigen dazu, ein stabiles Oktett zu bilden, indem sie ein Elektron von anderen Atomen aufnehmen und zu negativ geladenen Ionen werden: F- und Cl-.
- Kohlenstoff (C), als Element der Gruppe 14, hat vier Elektronen in seiner äußeren Schale. In der Regel teilt Kohlenstoff Elektronen, um eine vollständige Valenzschale zu erhalten, und bildet Bindungen mit mehreren anderen Atomen.
Die Spalten des Periodensystems spiegeln also die Anzahl der Elektronen in der Valenzschale jedes Elements wider, die wiederum bestimmt, wie das Element reagiert.
Versuchen Sie es
Beitrag leisten!
Verbessern Sie diese SeiteMehr erfahren
