Lernziele
- Schreiben Sie die chemische Formel für eine einfache ionische Verbindung.
- Erkennen Sie mehratomige Ionen in chemischen Formeln.
Wir haben bereits einige chemische Formeln für einfache ionische Verbindungen kennengelernt. Eine chemische Formel ist eine übersichtliche Auflistung der Elemente in einer Verbindung und der Verhältnisse dieser Elemente zueinander. Um besser zu verstehen, was eine chemische Formel bedeutet, müssen wir uns ansehen, wie eine ionische Verbindung aus ihren Ionen aufgebaut ist.
Ionische Verbindungen existieren als abwechselnde positive und negative Ionen in regelmäßigen, dreidimensionalen Anordnungen, die Kristalle genannt werden (Abbildung \(\PageIndex{1}\)). Wie Sie sehen können, gibt es in der Anordnung keine einzelnen NaCl-„Teilchen“, sondern ein kontinuierliches Gitter aus abwechselnden Natrium- und Chlorid-Ionen. Wir können jedoch das Verhältnis von Natrium- zu Chlorid-Ionen, ausgedrückt in den kleinstmöglichen ganzen Zahlen, zur Beschreibung der Verbindung verwenden. Im Falle von Natriumchlorid ist das Verhältnis von Natrium- zu Chloridionen, ausgedrückt in den kleinsten ganzen Zahlen, 1:1, so dass wir NaCl (ein Na-Symbol und ein Cl-Symbol) verwenden, um die Verbindung zu beschreiben. NaCl ist also die chemische Formel für Natriumchlorid, die die relative Anzahl der verschiedenen Ionen in der Verbindung kurz und bündig beschreibt. Eine makroskopische Probe besteht aus Myriaden von NaCl-Paaren; jedes Paar wird als Formeleinheit bezeichnet. Obwohl es bequem ist, sich vorzustellen, dass NaCl-Kristalle aus einzelnen NaCl-Einheiten bestehen, zeigt Abbildung \(\PageIndex{1}\), dass kein einzelnes Ion ausschließlich mit einem anderen einzelnen Ion verbunden ist. Jedes Ion ist von Ionen mit entgegengesetzter Ladung umgeben.
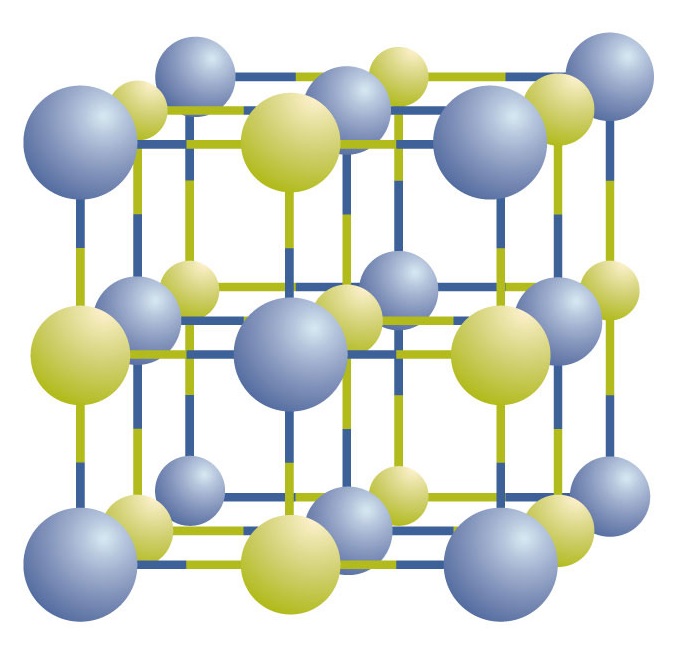
Abbildung \(\PageIndex{1}\) Ein Natriumchloridkristall. Ein Kristall enthält eine dreidimensionale Anordnung von abwechselnd positiven und negativen Ionen. Das genaue Muster hängt von der jeweiligen Verbindung ab. Der hier gezeigte Natriumchloridkristall ist eine Ansammlung von abwechselnd positiven und negativen Natrium- und Chlorionen.
Die Formel für eine ionische Verbindung folgt mehreren Konventionen. Zunächst wird das Kation vor dem Anion geschrieben. Da die meisten Metalle Kationen und die meisten Nichtmetalle Anionen bilden, wird in den Formeln normalerweise zuerst das Metall und dann das Nichtmetall aufgeführt. Zweitens werden Ladungen nicht in eine Formel geschrieben. Denken Sie daran, dass in einer ionischen Verbindung die Bestandteile Ionen und nicht neutrale Atome sind, auch wenn die Formel keine Ladungen enthält. Schließlich gilt für die richtige Formel einer Ionenverbindung immer die folgende Regel: Die gesamte positive Ladung muss gleich der gesamten negativen Ladung sein. Um die richtige Formel für eine beliebige Kombination von Ionen zu ermitteln, bestimmt man, wie viele von jedem Ion benötigt werden, um die gesamten positiven und negativen Ladungen in der Verbindung auszugleichen.
Diese Regel beruht letztlich auf der Tatsache, dass Materie insgesamt elektrisch neutral ist.
Nach der Konvention wird angenommen, dass es nur ein Atom gibt, wenn kein tiefgestelltes Zeichen vorhanden ist. Wir verwenden die 1 nicht als tiefgestellte Zahl.
Betrachten wir die ionische Verbindung, die aus Lithium- und Bromid-Ionen besteht, so sehen wir, dass das Lithium-Ion eine 1+ Ladung und das Bromid-Ion eine 1- Ladung hat. Um diese Ladungen auszugleichen, wird nur ein Ion von beiden benötigt. Die Formel für Lithiumbromid lautet LiBr.
Wenn eine ionische Verbindung aus Magnesium und Sauerstoff gebildet wird, hat das Magnesiumion eine 2+ Ladung und das Sauerstoffatom eine 2-Ladung. Obwohl diese beiden Ionen eine höhere Ladung als die Ionen in Lithiumbromid haben, halten sie sich im Verhältnis 1:1 die Waage. Daher lautet die richtige Formel für diese ionische Verbindung MgO.
Betrachten wir nun die ionische Verbindung, die von Magnesium und Chlor gebildet wird. Ein Magnesium-Ion hat eine 2+ Ladung, während ein Chlor-Ion eine 1-Ladung hat:
Mg2+ Cl-
Die Kombination von je einem Ion gleicht die positiven und negativen Ladungen nicht vollständig aus. Der einfachste Weg, diese Ladungen auszugleichen, ist die Annahme, dass für jedes Magnesiumion zwei Chloridionen vorhanden sind:
Mg2+ Cl- Cl-
Jetzt sind die positiven und negativen Ladungen ausgeglichen. Wir könnten die chemische Formel für diese ionische Verbindung als MgClCl schreiben, aber die Konvention ist, einen numerischen Index zu verwenden, wenn es mehr als ein Ion eines bestimmten Typs gibt – MgCl2. Diese chemische Formel besagt, dass es ein Magnesiumion und zwei Chloridionen in dieser Formel gibt. (Lesen Sie den „Cl2“-Teil der Formel nicht als ein Molekül des zweiatomigen Elements Chlor. Chlor kommt in dieser Verbindung nicht als zweiatomiges Element vor. Vielmehr liegt es in Form von zwei einzelnen Chloridionen vor). Konventionell wird in den Formeln ionischer Verbindungen das kleinste ganzzahlige Verhältnis verwendet. Die Formel Mg2Cl4 hat ausgeglichene Ladungen mit den Ionen im Verhältnis 1:2, aber es ist nicht das kleinste ganzzahlige Verhältnis.
Nach der Konvention wird das kleinste ganzzahlige Verhältnis der Ionen in ionischen Formeln verwendet. Es gibt Ausnahmen für bestimmte Ionen, wie z.B. Hg22+
Beispiel \(\PageIndex{1}\)
Schreiben Sie die chemische Formel für eine ionische Verbindung, die aus jedem Ionenpaar besteht.
- das Natrium-Ion und das Schwefel-Ion
- das Aluminium-Ion und das Fluorid-Ion
- das 3+ Eisen-Ion und das Sauerstoff-Ion
Lösung
- Um ein Valenzschalenoktett zu erhalten, bildet Natrium ein Ion mit einer 1+ Ladung, während das Schwefel-Ion eine 2-Ladung hat. Zwei Natrium-1+-Ionen werden benötigt, um die 2-Ladung des Schwefel-Ions auszugleichen. Anstatt die Formel als NaNaS zu schreiben, kürzen wir sie vereinbarungsgemäß zu Na2S ab.
- Das Aluminium-Ion hat eine 3+-Ladung, während das von Fluor gebildete Fluorid-Ion eine 1-Ladung hat. Es werden drei Fluor-1-Ionen benötigt, um die 3+-Ladung des Aluminium-Ions auszugleichen. Diese Kombination wird als AlF3 geschrieben.
- Eisen kann zwei mögliche Ionen bilden, aber hier wird das Ion mit einer 3+-Ladung angegeben. Das Sauerstoffatom hat als Ion eine 2-Ladung. Um die positiven und negativen Ladungen auszugleichen, wird auf das kleinste gemeinsame Vielfache 6 zurückgegriffen: zwei Eisen-3+-Ionen ergeben 6+, während drei Sauerstoff-2-Ionen 6- ergeben, wodurch die positiven und negativen Ladungen insgesamt ausgeglichen werden. Die Formel für diese ionische Verbindung lautet also Fe2O3.
Übung \(\PageIndex{1}\)
Schreiben Sie die chemische Formel für eine ionische Verbindung, die aus jedem Ionenpaar besteht.
- das Calcium-Ion und das Sauerstoff-Ion
- das 2+ Kupfer-Ion und das Schwefel-Ion
- das 1+ Kupfer-Ion und das Schwefel-Ion
Polyatomare Ionen
Einige Ionen bestehen aus Gruppen von Atomen, die miteinander verbunden sind und eine elektrische Gesamtladung haben. Da diese Ionen mehr als ein Atom enthalten, werden sie polyatomare Ionen genannt. Polyatomare Ionen haben charakteristische Formeln, Namen und Ladungen, die man sich einprägen sollte. NO3- zum Beispiel ist das Nitrat-Ion; es hat ein Stickstoffatom und drei Sauerstoffatome und eine Gesamtladung von 1. Tabelle \(\PageIndex{1}\) listet die häufigsten polyatomaren Ionen auf.
| Name | Formel |
|---|---|
| Ammoniumion | NH4+ |
| Acetat-Ion | C2H3O2- |
| Carbonat-Ion | CO32- |
| Hydrogencarbonat-Ion (Bicarbonat-Ion) | HCO3- |
| Cyanid-Ion | CN- |
| Hydroxid-Ion | OH- |
| Phosphat-Ion | PO43- |
| Phosphatwasserstoff-Ion | HPO42- |
| Dihydrogenphosphat-Ion | H2PO4- |
| Nitrat-Ion | NO3- |
| Sulfit-Ion | SO32- |
Die Regel für die Bildung von Formeln für ionische Verbindungen, die mehratomige Ionen enthalten, ist dieselbe wie für Formeln, die monatomare (einatomige) Ionen enthalten:
.atomaren) Ionen: Die positiven und negativen Ladungen müssen sich ausgleichen. Wenn mehr als ein bestimmtes mehratomiges Ion benötigt wird, um die Ladung auszugleichen, muss die gesamte Formel für das mehratomige Ion in Klammern gesetzt werden, und der tiefgestellte Index wird außerhalb der Klammern platziert. Dies soll zeigen, dass der tiefgestellte Index für das gesamte mehratomige Ion gilt. Ein Beispiel ist Ba(NO3)2.
Beispiel \(\PageIndex{2}\)
Schreiben Sie die chemische Formel für eine ionische Verbindung, die aus jedem Ionenpaar besteht.
- das Kalium-Ion und das Sulfat-Ion
- das Calcium-Ion und das Nitrat-Ion
Lösung
- Kalium-Ionen haben eine Ladung von 1+, während Sulfat-Ionen eine Ladung von 2- haben. Wir brauchen zwei Kalium-Ionen, um die Ladung des Sulfat-Ions auszugleichen, also lautet die richtige chemische Formel K2SO4.
- Calcium-Ionen haben eine Ladung von 2+, während Nitrat-Ionen eine Ladung von 1- haben. Um die Ladung jedes Calcium-Ions auszugleichen, werden zwei Nitrat-Ionen benötigt. Die Formel für Nitrat muss in Klammern gesetzt werden. Wir schreiben also Ca(NO3)2 als Formel für diese ionische Verbindung.
Übung \(\PageIndex{2}\)
Schreiben Sie die chemische Formel für eine ionische Verbindung, die aus jedem Ionenpaar besteht.
- das Magnesium-Ion und das Carbonat-Ion
- das Aluminium-Ion und das Acetat-Ion
Erkennen ionischer Verbindungen
Es gibt zwei Möglichkeiten, ionische Verbindungen zu erkennen. Erstens sind Verbindungen zwischen metallischen und nichtmetallischen Elementen in der Regel ionisch. Zum Beispiel enthält CaBr2 ein metallisches Element (Calcium, ein Metall der Gruppe 2A) und ein nichtmetallisches Element (Brom, ein Nichtmetall der Gruppe 7A). Daher handelt es sich höchstwahrscheinlich um eine ionische Verbindung. (Tatsächlich ist sie ionisch.) Im Gegensatz dazu enthält die Verbindung NO2 zwei Elemente, die beide Nichtmetalle sind (Stickstoff aus der Gruppe 5A und Sauerstoff aus der Gruppe 6A). Sie ist keine ionische Verbindung, sondern gehört zur Kategorie der kovalenten Verbindungen, auf die an anderer Stelle eingegangen wird. Beachten Sie auch, dass diese Kombination von Stickstoff und Sauerstoff keine spezifizierte elektrische Ladung hat, es handelt sich also nicht um ein Nitrit-Ion.
Zweitens, wenn Sie die Formel eines polyatomaren Ions in einer Verbindung erkennen, ist die Verbindung ionisch. Wenn du zum Beispiel die Formel Ba(NO3)2 siehst, kannst du den „NO3“-Teil als das Nitrat-Ion erkennen, \(\rm{NO_3^-}\). (Erinnern Sie sich daran, dass die Konvention beim Schreiben von Formeln für ionische Verbindungen darin besteht, die ionische Ladung nicht anzugeben). Dies ist ein Hinweis darauf, dass der andere Teil der Formel, Ba, eigentlich das Ba2+-Ion ist, wobei die 2+-Ladung die Gesamt-2-Ladung der beiden Nitrat-Ionen ausgleicht. Somit ist diese Verbindung auch ionisch.
Beispiel \(\PageIndex{3}\)
Bestimme jede Verbindung als ionisch oder nicht ionisch.
- Na2O
- PCl3
- NH4Cl
- OF2
Lösung
- Natrium ist ein Metall, und Sauerstoff ist ein Nichtmetall; daher ist Na2O vermutlich ionisch.
- Beide, Phosphor und Chlor, sind Nichtmetalle. Daher ist PCl3 nicht ionisch.
- Das NH4 in der Formel steht für das Ammonium-Ion, NH4+, was bedeutet, dass diese Verbindung ionisch ist.
- Sauerstoff und Fluor sind Nichtmetalle. Daher ist OF2 nicht ionisch.
Übung \(\PageIndex{3}\)
Bestimme jede Verbindung als ionisch oder nicht ionisch.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Sieh genauer hin: Blut und Meerwasser
Die Wissenschaft hat schon lange erkannt, dass Blut und Meerwasser eine ähnliche Zusammensetzung haben. Schließlich sind in beiden Flüssigkeiten ionische Verbindungen aufgelöst. Die Ähnlichkeit mag mehr als nur ein Zufall sein; viele Wissenschaftler glauben, dass die ersten Lebensformen auf der Erde in den Ozeanen entstanden sind. Bei näherer Betrachtung zeigt sich jedoch, dass Blut und Meerwasser recht unterschiedlich sind. Eine 0,9 %ige Natriumchloridlösung entspricht in etwa der Salzkonzentration im Blut. Im Gegensatz dazu besteht Meerwasser hauptsächlich aus einer 3 %igen Natriumchloridlösung, die mehr als dreimal so hoch ist wie die Konzentration im Blut. Hier ein Vergleich der Ionenmengen in Blut und Meerwasser:
| Ion | Prozent im Meerwasser | Prozent im Blut |
|---|---|---|
| Na+ | 2.36 | 0.322 |
| Cl- | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42- | 0.09 | – |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3- | 0.002 | 0.165 |
| HPO42-, H2PO4- | – | 0.01 |
Die meisten Ionen sind im Meerwasser häufiger vorhanden als im Blut, mit einigen wichtigen Ausnahmen. Im Blut gibt es viel mehr Hydrogencarbonat-Ionen (HCO3-) als im Meerwasser. Dieser Unterschied ist von Bedeutung, da das Hydrogencarbonat-Ion und einige verwandte Ionen eine entscheidende Rolle bei der Steuerung der Säure-Basen-Eigenschaften des Blutes spielen. Die Menge an Hydrogenphosphat-Ionen – HPO42- und H2PO4 – ist im Meerwasser sehr gering, während sie im Blut in größeren Mengen vorhanden sind und dort ebenfalls die Säure-Basen-Eigenschaften beeinflussen. Ein weiterer bemerkenswerter Unterschied besteht darin, dass Blut keine nennenswerten Mengen des Sulfat-Ions (SO42-) enthält, während dieses Ion im Meerwasser vorhanden ist.
Key Takeaways
- In korrekten chemischen Formeln für ionische Verbindungen ist die positive Gesamtladung mit der negativen Gesamtladung ausgeglichen.
- Es gibt auch Gruppen von Atomen mit einer Gesamtladung, die als polyatomare Ionen bezeichnet werden.
Beiträger und Zuschreibungen
-
Anonym
