Generisk navn: lidocaine hydrochloride
Doseringsform: topisk gelé
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 1. okt. 2020.
- Overblik
- Sidegevinster
- Dosering
- Professionel
- Interaktioner
- Mere
Kun på recept
- Beskrivelse
- KLINISK FARMAKOLOGI
- INDIKATIONER OG ANVENDELSE
- KONTRAINDIKATIONER
- VARNEMÆRKNINGER
- FORANSTALTNINGER
- Anvendelse under graviditet:
- Bivirkninger
- OVERDOSERING
- DOSERING OG ADMINISTRATION
- MAKSIMUMDOSERING
- Hvordan leveres
- Mere om lidocain aktuelt
- Forbrugerressourcer
- Faglige ressourcer
- Relaterede behandlingsvejledninger
Beskrivelse
Lidocain HCI 2% gelé er en steril, vandigt produkt, der indeholder et lokalbedøvende middel og administreres topisk. (Se INDIKATIONER for specifikke anvendelser.)
Lidocain HCI 2% gelé indeholder lidocain HCI, der kemisk betegnes som acetamid, 2-(diethylamino)-N-(2,6-dimethylphenyl)-, monohydrochlorid og har følgende strukturformel:
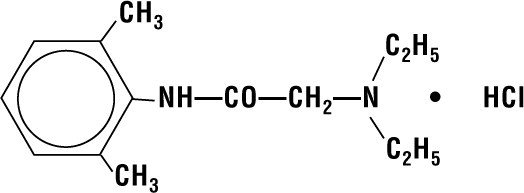
Dets molekylformel er C14H22N2O – HCI, og dets molekylvægt er 270.80.
Lidocain HCI 2% gelé indeholder også hypromellose, og den resulterende blanding maksimerer kontakten med slimhinden og giver smøring ved instrumentering. Den ubrugte del skal kasseres efter første brug.
Sammensætning af Lidocaine HCI 2% Gelé 30 mL og 5 mL tuber: Hver mL indeholder 20 mg lidocain HCI. Formuleringen indeholder også methylparaben, propylparaben, hypromellose og natriumhydroxid og/eller saltsyre til justering af pH mellem 6,0 og 7,0.
KLINISK FARMAKOLOGI
Virkningsmekanisme: Lidocain stabiliserer neuronmembranen ved at hæmme de ioniske strømme, der er nødvendige for initiering og ledelse af impulser, hvorved der opnås en lokalanæstetisk virkning.
Virkningstidspunkt: Virkningstidspunktet er 3 til 5 minutter. Det er ineffektivt, når det anvendes på intakt hud.
Hemodynamik: Overdrevne blodniveauer kan forårsage ændringer i hjertets output, den samlede perifere modstand og det gennemsnitlige arterielle tryk. Disse ændringer kan skyldes en direkte deprimerende virkning af det lokalanæstetiske middel på forskellige komponenter i det kardiovaskulære system.
Pharmakokinetik og metabolisme: Lidocain kan absorberes efter lokal indgift på slimhinder, idet absorptionshastigheden og absorptionsomfanget afhænger af koncentrationen og den samlede dosis, der indgives, det specifikke påføringssted og eksponeringstiden. Generelt sker absorptionen af lokalanæstetiske midler efter topisk anvendelse hurtigst efter intratracheal administration. Lidocain absorberes også godt fra mave-tarmkanalen, men der kan forekomme lidt intakt lægemiddel i kredsløbet på grund af biotransformation i leveren.
Lidocain metaboliseres hurtigt af leveren, og metabolitter og uændret lægemiddel udskilles af nyrerne. Biotransformationen omfatter oxidativ N-dealkylering, ringhydroxylering, spaltning af amidbindingen og konjugering. N-dealkylering, en af de vigtigste biotransformationsveje, giver metabolitterne monoethylglycinexylidididid og glycinexylididid. Den farmakologiske/toksikologiske virkning af disse metabolitter svarer til, men er mindre potent end lidocains virkning. Ca. 90 % af den indgivne lidocain udskilles i form af forskellige metabolitter, og mindre end 10 % udskilles uændret. Den primære metabolit i urinen er et konjugat af 4-hydroxy-2, 6-dimethylanilin.
Plasmabindingen af lidocain i plasma er afhængig af lægemiddelkoncentrationen, og den bundne fraktion falder med stigende koncentration. Ved koncentrationer på 1 til 4 mcg fri base pr. mL er 60 til 80 % af lidocain proteinbundet. Bindingen er også afhængig af plasmakoncentrationen af alfa-I-syre-glykoproteinet.
Lidocain krydser blod-hjerne- og placentabarrieren, formentlig ved passiv diffusion.
Undersøgelser af lidocainmetabolismen efter intravenøse bolusinjektioner har vist, at eliminationshalveringstiden for dette middel typisk er 1,5 til 2,0 timer. På grund af den hurtige hastighed, hvormed lidocain metaboliseres, kan enhver tilstand, der påvirker leverfunktionen, ændre lidocain-kinetikken. Halveringstiden kan være forlænget to gange eller mere hos patienter med leverdysfunktion. Nyrefunktionsforstyrrelser påvirker ikke lidocainkinetikken, men kan øge ophobningen af metabolitter.
Faktorer såsom acidose og brug af CNS-stimulerende og -depressive midler påvirker de CNS niveauer af lidocain, der kræves for at producere åbenlyse systemiske virkninger. Objektive negative manifestationer bliver mere og mere tydelige med stigende venøse plasmaniveauer over 6 mcg fri base pr. mL. Hos rhesusaben har arterielle blodniveauer på 18 til 21 mcg/mL vist sig at være tærskel for krampagtig aktivitet.
INDIKATIONER OG ANVENDELSE
Lidocain HCI 2% gelé er indiceret til forebyggelse og kontrol af smerte ved procedurer, der involverer mandlige og kvindelige urinrør, til lokal behandling af smertefuld urethritis og som anæstetisk smøremiddel ved endotracheal intubation (oral og nasal).
KONTRAINDIKATIONER
Lidocain er kontraindiceret hos patienter med en kendt historie af overfølsomhed over for lokalanæstetika af amidtypen eller over for andre komponenter i Lidocaine HCI 2% gelé.
VARNEMÆRKNINGER
EKSCESSIV DOSERING, ELLER KORTE INTERVALLER MELLEM DOSER, KAN FØRE TIL HØJE PLASMASKINSPÆLER OG SERIØSE BEMÆRKNINGSVIRKNINGER. PATIENTERNE SKAL INSTRUERES OM NØJE AT OVERHOLDE DE ANBEFALEDE DOSERINGS- OG ADMINISTRATIONSRETNINGSLINJER SOM ANFØRT I DENNE INDLÆGSSEDDEL. BEHANDLING AF SERIØSE ADVERSE REAKTIONER KAN KØRE ANVENDELSE AF RESUSCITATIVT UDSTYR, OXYGEN OG ANDRE RESUSCITATIVE DRUGS.
Lidocain HCI 2% gelé bør anvendes med yderste forsigtighed i tilfælde af sepsis eller alvorligt traumatiseret slimhinde i applikationsområdet, da der under sådanne forhold er mulighed for hurtig systemisk absorption.
Ved anvendelse til smøring af endotrachealtube skal man være omhyggelig med at undgå at indføre produktet i tubens lumen. Geléen må ikke anvendes til smøring af de endotracheale styletter. Hvis geléen kommer ind i det indre lumen, kan den tørre ind på den indre overflade og efterlade en rest, som har tendens til at klumpe sammen ved fleksion, hvilket forsnævrer lumenet. Der har været sjældne rapporter om, at denne rest har forårsaget en tillukning af lumenet. (Se også ADVERSE REAKTIONER og DOSERING OG ADMINISTRATION.)
FORANSTALTNINGER
Allmentalt: Sikkerheden og effektiviteten af lidocain afhænger af korrekt dosering, korrekt teknik, passende forholdsregler og beredskab i nødstilfælde. (Se ADVARSEL og BÆREDREREAKTIONER.) Den laveste dosis, der resulterer i effektiv anæstesi, bør anvendes for at undgå høje plasmaniveauer og alvorlige bivirkninger. Gentagne doser af lidocain kan medføre betydelige stigninger i blodniveauet ved hver gentagen dosis på grund af langsom ophobning af lægemidlet eller dets metabolitter. Tolerance over for forhøjede blodniveauer varierer med patientens status. Svækkede, ældre patienter, akut syge patienter og børn bør gives reducerede doser svarende til deres alder og fysiske status. Lidocain bør også anvendes med forsigtighed til patienter med alvorligt chok eller hjerteblokade.
Lidocain HCI 2% gelé bør anvendes med forsigtighed til patienter med kendt lægemiddeloverfølsomhed. Patienter, der er allergiske over for para-aminobenzoesyrederivater (prokain, tetrakain, benzokain osv.) har ikke vist krydsoverfølsomhed over for lidocain.
Mange lægemidler, der anvendes under udførelse af anæstesi, anses for at være potentielle udløsende stoffer for familiær malign hypertermi. Da det ikke vides, om lokalanæstetika af amidtypen kan udløse denne reaktion, og da behovet for supplerende generel anæstesi ikke kan forudsiges på forhånd, foreslås det, at der bør foreligge en standardprotokol for håndtering. Tidlige uforklarlige tegn på takykardi, takypnø, ustabilt blodtryk og metabolisk acidose kan gå forud for temperaturforhøjelsen. Et vellykket resultat afhænger af tidlig diagnose, hurtig ophør af det/de mistænkte udløsende middel(er) og iværksættelse af behandling, herunder iltbehandling, indikerede understøttende foranstaltninger og dantrolen (se indlægsseddel for dantrolenatrium intravenøst før brug).
Information til patienterne: Når topiske anæstetika anvendes i munden, skal patienten være opmærksom på, at produktionen af topisk anæstesi kan svække synkeevnen og dermed øge faren for aspiration. Derfor bør der ikke indtages mad i 60 minutter efter brug af lokalanæstetiske præparater i mund- eller halsområdet. Dette er særlig vigtigt hos børn på grund af deres hyppighed af spisning.
Svækkelse af tungen eller slimhinden i mundvigen kan øge faren for utilsigtet bidetraume. Mad eller tyggegummi bør ikke indtages, mens mund- eller halsområdet er bedøvet.
Carcinogenese – Der er ikke udført langtidsundersøgelser på dyr for at vurdere det carcinogene potentiale af lidocain.
Mutagenese – Lidocains mutagene potentiale er blevet testet i Ames Salmonella reverse mutation assay og in vitro kromosomaberrationer assay i humane lymfocytter og i et in vivo musemikronukleus assay. Der var ingen tegn på en mutagen virkning i disse undersøgelser.
Forringelse af fertiliteten – virkningen af lidocain på fertiliteten blev undersøgt i rottemodellen. Administration af 30 mg/kg, s.c. (180 mg/m2) til parringsparret gav ikke ændringer i fertiliteten eller den generelle reproduktive ydeevne hos rotter. Der findes ingen undersøgelser, der undersøger virkningen af lidocain på sædparametre. Der var ingen tegn på ændret fertilitet.
Anvendelse under graviditet:
Teratogene virkninger: Graviditetskategori B.
Reproduktionsundersøgelser for lidocain er blevet udført i både rotter og kaniner. Der var ingen tegn på skade på fosteret ved subkutane doser på op til 50 mg/kg lidocain (300 mg/m2 på basis af kropsoverfladeareal) i rottemodellen. I kaninmodellen var der ingen tegn på skade på fosteret ved en dosis på 5 mg/kg, s.c. (60 mg/m2 på basis af kropsoverfladeareal). Behandling af kaniner med 25 mg/kg (300 mg/m2) gav tegn på maternel toksicitet og tegn på forsinket fosterudvikling, herunder et ikke-signifikant fald i fostervægt (7 %) og en stigning i mindre skeletanomalier (kranie- og sternebraldefekt, nedsat forbening af phalanges). Virkningen af lidocain på den postnatale udvikling blev undersøgt hos rotter ved at behandle drægtige hunrotter dagligt subkutant i doser på 2, 10 og 50 mg/kg (12, 60 og 300 mg/m2) fra dag 15 i drægtigheden og op til 20 dage post partum. Der blev ikke set tegn på skadelige virkninger hverken hos moderdyrene eller hos hvalpene op til og med dosis på 10 mg/kg (60 mg/m2); antallet af overlevende hvalpe var imidlertid reduceret ved 50 mg/kg (300 mg/m2), både ved fødslen og i laktationsperioden, idet virkningen højst sandsynligt var sekundær til maternel toksicitet. Der blev ikke set andre virkninger på kuldstørrelse, kuldvægt, abnormiteter hos ungerne og ungernes fysiske udvikling i denne undersøgelse.
I en anden undersøgelse blev virkningerne af lidocain på den postnatale udvikling hos rotter undersøgt, som omfattede vurdering af ungerne fra fra fravænning til kønsmodning. Rotter blev behandlet i 8 måneder med 10 eller 30 mg/kg, s.c. lidocain (henholdsvis 60 mg/m2 og 180 mg/m2 på basis af kropsoverfladeareal). Denne periode omfattede 3 parringsperioder. Der var ingen tegn på ændret postnatal udvikling hos noget afkom; begge doser af lidocain reducerede dog signifikant det gennemsnitlige antal hvalpe pr. kuld, der overlevede indtil fravænning af afkom fra de 2 første parringsperioder.
Der findes imidlertid ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder. Da undersøgelser af dyrs reproduktion ikke altid er forudsigende for respons hos mennesker, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Fødsel og fødsel: Lidocain er ikke kontraindiceret ved fødsel og barsel. Hvis Lidocaine HCl 2% gelé anvendes samtidig med andre produkter, der indeholder lidocain, skal man være opmærksom på den samlede dosis, som alle formuleringer bidrager med.
Samlevende mødre: Lidocain udskilles i modermælk. Den kliniske betydning af denne observation er ukendt. Forsigtighed bør udvises, når lidocain administreres til en ammende kvinde.
Pædiatrisk brug: Selv om sikkerheden og effektiviteten af Lidocain 2% gelé til pædiatriske patienter ikke er blevet fastlagt, blev der i en undersøgelse af 19 for tidligt fødte nyfødte (gestationsalder <33 uger) ikke fundet nogen sammenhæng mellem plasmakoncentrationen af lidocain eller monoethylglycinexylididid og spædbarnets kropsvægt, når moderate mængder lidocain (dvs. 0,3 mL/kg lidocain gel 20 mg/mL) blev anvendt til smøring af både intranasale og endotracheale rør. Ingen nyfødte havde plasmaniveauer af lidocain på over 750 mcg/L. Doseringerne til børn bør reduceres i forhold til alder, kropsvægt og fysisk tilstand. (Se DOSERING OG ADMINISTRATION.)
Bivirkninger
Bivirkninger efter indgift af lidocain er af samme art som dem, der er observeret ved andre lokalanæstetiske amidmidler. Disse bivirkninger er generelt dosisrelaterede og kan skyldes høje plasmaniveauer forårsaget af for høj dosis eller hurtig absorption, eller kan skyldes overfølsomhed, idiosynkrasi eller nedsat tolerance hos patienten. Alvorlige bivirkninger er generelt af systemisk karakter. Følgende typer er de hyppigst rapporterede:
Der har været sjældne rapporter om okklusion af endotrachealtube i forbindelse med tilstedeværelsen af tørrede gelérester i tubens indre lumen. (Se også ADVARSEL og DOSERING OG ADMINISTRATION.)
Centralnervesystemet: CNS manifestationer er excitatoriske og/eller depressive og kan være karakteriseret ved svimmelhed, nervøsitet, ængstelse, eufori, forvirring, svimmelhed, døsighed, tinnitus, sløret eller dobbeltsyn, opkastning, fornemmelser af varme, kulde eller følelsesløshed, trækninger, rystelser, kramper, bevidstløshed, åndedrætsdepression og hjertestop. De excitatoriske manifestationer kan være meget korte eller kan slet ikke forekomme, i hvilket tilfælde den første manifestation af toksicitet kan være døsighed, der går over i bevidstløshed og respirationsstop.
Døsighed efter indgift af lidocain er normalt et tidligt tegn på et højt blodniveau af lægemidlet og kan forekomme som følge af hurtig absorption.
Kardiovaskulært system: Kardiovaskulære manifestationer er normalt deprimerende og er karakteriseret ved bradykardi, hypotension og kardiovaskulært kollaps, som kan føre til hjertestop.
Allergisk: Allergiske reaktioner er karakteriseret ved kutane læsioner, urticaria, ødemer eller anafylaktoide reaktioner. Allergiske reaktioner kan opstå som følge af følsomhed over for enten det lokalanæstetiske middel eller andre komponenter i formuleringen. Allergiske reaktioner som følge af følsomhed over for lidocain er ekstremt sjældne, og hvis de forekommer, skal de håndteres med konventionelle midler. Påvisning af følsomhed ved hjælp af hudtest er af tvivlsom værdi.
OVERDOSERING
Akutte nødsituationer som følge af lokalanæstetika er generelt relateret til høje plasmaniveauer, som man støder på under terapeutisk brug af lokalanæstetika. (Se Bivirkninger, advarsler og forsigtighedsregler.)
Håndtering af lokalanæstetiske nødsituationer: Den første overvejelse er forebyggelse, hvilket bedst opnås ved omhyggelig og konstant overvågning af kardiovaskulære og respiratoriske vitale tegn og patientens bevidsthedstilstand efter hver lokalanæstetisk administration. Ved det første tegn på forandring skal der gives ilt.
Det første skridt i håndteringen af kramper består i øjeblikkelig opmærksomhed på opretholdelse af en åben luftvej og assisteret eller kontrolleret ventilation med ilt og et leveringssystem, der er i stand til at muliggøre øjeblikkeligt positivt luftvejstryk via maske. Umiddelbart efter iværksættelse af disse respiratoriske foranstaltninger bør kredsløbets tilstrækkelighed vurderes, idet man skal huske på, at lægemidler, der anvendes til behandling af kramper, undertiden nedsætter kredsløbet, når de administreres intravenøst. Hvis kramperne fortsætter på trods af tilstrækkelig respiratorisk støtte, og hvis kredsløbets tilstand tillader det, kan der indgives små doser af et ultrakortvirkende barbiturat (f.eks. thiopental eller thiamylal) eller et benzodiazepin (f.eks. diazepam) intravenøst. Klinikeren bør være fortrolig med disse antikonvulsive lægemidler, inden lokalbedøvelse anvendes. Understøttende behandling af kredsløbsdepression kan kræve administration af intravenøs væske og, når det er relevant, en vasopressor som anvist af den kliniske situation (f.eks. efedrin).
Hvis de ikke behandles straks, kan både kramper og kardiovaskulær depression resultere i hypoxi, acidose, bradykardi, arytmier og hjertestop. Hvis hjertestop skulle forekomme, skal der iværksættes standard kardiopulmonale genoplivningsforanstaltninger.
Dialyse er af ubetydelig værdi ved behandling af akut overdosering med lidocain.
Den orale LD50 af lidocain HCI hos ikke-næste hunrotter er 459 (346 til 773) mg/kg (som salt) og 214 (159 til 324) mg/kg (som salt) hos ædefødende hunrotter.
DOSERING OG ADMINISTRATION
Når lidocain HCI 2% gelé anvendes samtidig med andre produkter, der indeholder lidocain, skal man være opmærksom på den samlede dosis, som alle formuleringer bidrager med.
Doseringen varierer og afhænger af det område, der skal bedøves, vævets vaskularitet, den individuelle tolerance og anæstesiteknikken. Den laveste dosis, der er nødvendig for at give en effektiv anæstesi, bør administreres. Doseringerne bør reduceres til børn og til ældre og svækkede patienter. Selv om forekomsten af bivirkninger med Lidocaine HCI 2% gelé er ret lav, bør der udvises forsigtighed, især ved anvendelse af store mængder, da forekomsten af bivirkninger er direkte proportional med den samlede dosis af det lokalanæstetiske middel, der administreres.
Til overfladisk anæstesi af den mandlige voksenurethra: Når der anvendes rør med Lidocaine 2% gelé 30 mL, skal plastkeglen steriliseres i 5 minutter i kogende vand, afkøles og fastgøres til røret. Keglen kan gassteriliseres eller koldsteriliseres, alt efter hvad der foretrækkes. Instil langsomt ca. 15 mL (300 mg lidocain HCI) i urethraet eller indtil patienten har en følelse af spænding. Der anbringes derefter en penisklemme i flere minutter ved corona. En yderligere dosis på højst 15 mL (300 mg) kan instilleres for at opnå tilstrækkelig bedøvelse.
Forud for sondering eller cystoskopi bør der anvendes en penisklemme i 5 til 10 minutter for at opnå tilstrækkelig bedøvelse. En samlet dosis på 30 mL (600 mg) er normalt nødvendig for at fylde og dilatere mandens urinrør.
Forud for kateterisation er mindre mængder på 5 til 10 mL (100 til 200 mg) normalt tilstrækkelige til smøring.
Til overfladisk anæstesi af den kvindelige voksne urinrør: Når der anvendes rør med Lidocaine 2% gelé 30 mL, skal plastkeglen steriliseres i 5 minutter i kogende vand, afkøles og sættes på røret. Keglen kan gassteriliseres eller koldsteriliseres, alt efter hvad der foretrækkes. Instil langsomt 3 til 5 mL (60 til 100 mg lidocain HCI) af geléen i urethraet. Hvis det ønskes, kan noget gelé anbringes på en vatpind og indføres i urethraet. For at opnå tilstrækkelig anæstesi bør der gives flere minutter før udførelse af urologiske procedurer.
Lubrication til endotrachealintubation: Påfør en moderat mængde gelé på den udvendige overflade af den endotracheale tube kort før brug. Man skal være forsigtig med at undgå at introducere produktet i tubens lumen. Geléen må ikke bruges til at smøre endotracheale styletter. Se ADVARSLER og BÆREDREREAKTIONER vedrørende sjældne rapporter om okklusion af det indre lumen. Det anbefales også at undgå brug af endotracheale tuber med tørret gelé på den ydre overflade på grund af manglende smøreeffekt.
MAKSIMUMDOSERING
Der bør ikke gives mere end 600 mg lidocain HCI inden for en 12-timers periode.
Børn: Det er vanskeligt at anbefale en maksimal dosis af et lægemiddel til børn, da denne varierer som en funktion af alder og vægt. For børn under 10 år, der har en normal magert kropsmasse og en normal udvikling af den magre krop, kan den maksimale dosis bestemmes ved anvendelse af en af de standardiserede pædiatriske lægemiddelformler (f.eks. Clarks regel). For eksempel bør dosis af lidocainhydrochlorid hos et barn på fem år, der vejer 50 lbs., ikke overstige 75-100 mg, når den beregnes i henhold til Clarks regel. Under alle omstændigheder bør den maksimale mængde lidocain HCI, der administreres, ikke overstige 4,5 mg/kg (2 mg/lb) af kropsvægten.
Hvordan leveres
Lidocain HCI 2% gelé leveres i de anførte doseringsformer.
NDC 17478-840-30 30 mL aluminiumsrør
NDC 17478-840-05 5 mL aluminiumsrør
En aftagelig applikatorkegle og en nøgle til at udtrykke indholdet er inkluderet i 30 mL kartonen.
Opbevaring: Opbevares ved 20° til 25°C (68° til 77°F) .
PREMIERProRx®
Fremstillet af:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® er et registreret varemærke tilhørende Premier Inc., anvendt under licens.
PLD00N Rev. 10/15
Principal Display Panel Text for Container Label:
NDC 17478-840-05 Premier Logo
Lidocaine Hydrochloride Jelly USP, 2%
Rx only
Sterile 5 mL

Principal Display Panel Text for Carton Label:
NDC 17478-840-05 Steril 5 mL
Lidocainhydrochloridgelé USP, 2%
Rx only
Premier Logo

| LIDOCAINE lidocainhydrochloridgelé |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Mærkningssted – Akorn, Inc. (117696770)
Registrant – Akorn Operating Company LLC (117693100)
| Etablering | ||||
| Navn | Adresse | ID/FEI | ID/FEI | Operations |
| Akorn, Inc | 117696840 | FABRIK(17478-840), ANALYSE(17478-840), STERILISERING(17478-840), STERILISERING(17478-840), PAKNING(17478-840), MÆRKNING(17478-840) | ||
Mere om lidocain aktuelt
- Bivirkninger
- Under graviditet eller amning
- Doseringsinformation
- Medikamentinteraktioner
- Sammenlign alternativer
- Priser & Kuponer
- En Español
- 208 anmeldelser
- Lægemiddelklasse: Aktuel bedøvelse
- FDA-advarsler (5)
Forbrugerressourcer
- Patientinformation
- Lidocain Aktuel anvendelse (Avanceret læsning)
Faglige ressourcer
- Oplysningsinformation
- Lidocain (lokal anvendelse) (Professionel patientrådgivning)
- Lidocain creme (FDA)
- Lidocain gel (FDA)
- Lidocain laryngotracheal opløsning (FDA)
- … +9 mere
Andre mærker Lidocaine Viscous, ZTlido, Xylocain Jelly, Xylocain Topical, … +24 mere
Relaterede behandlingsvejledninger
- Anal kløe
- Gastrointestinal kirurgi
- Anæstesi
- Brandsår, eksterne
- … +9 mere
Medicinsk ansvarsfraskrivelse
