 |
|
Syre-base-reaktioner er allestedsnærværende. I vandige opløsninger øger syrer koncentrationen af hydrogenioner (H+). På den anden side øger baser koncentrationen af hydroxidioner (OH-). Når en syre og en base reagerer i en vandig opløsning, kombineres H+- og OH- ionerne og danner vand. Disse ioner “neutraliserer” således hinanden:
De fleste syrer har den generelle formel HA, hvor A- er en anion, og de fleste baser har formen BOH, hvor B+ er et passende kation. Syrer og baser kan inddeles i to generelle typer: stærke og svage syrer og baser. Forskellen mellem de to er ligetil: En stærk syre i en vandopløsning nedbrydes 100 % til en proton (H+) og en anion (A-)
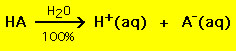
Derimod nedbrydes de fleste svage syrer betydeligt mindre end 100 % i en vandopløsning:
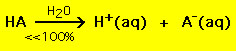 .
.Med andre ord forbliver de fleste svage syremolekyler intakte i vand. Lignende kemiske ligninger gælder for stærke og svage baser.
Der findes kun nogle få svage syrer og baser, de er:
| |
|
|
HCl (saltsyre) HNO3 (salpetersyre) HNO3 (salpetersyre) HClO4 (perchlorsyre) H2SO4 (svovlsyre) |
NaOH (natriumhydroxid) KOH (kaliumhydroxid) Ca(OH)2 (calciumhydroxid) |
Alle andre syrer og baser er svage. En svag syre opstår af en hvilken som helst anion. Eksempler er givet nedenfor
| |
|
|
F- (fluorid) Br- (bromid) Br- (bromid) I- (jodid) HCO3- (bicarbonat) C2H3O2- (acetat) MnO4- (permanganat) PO4-3 (fosfat) CrO4-2 (chromat) CN- (cyanid) NO2- (nitrit) SO3-2 (sulfit) |
HF (flussyre) HBr (bromhvedsyre) HI (jodsyre) HI (jodsyre) H2CO3 (kulsyre) HC2H3O2 (eddikesyre) HMnO4 (permangansyre) H3PO4 (fosforsyre) H3PO4 (fosforsyre syre) H2CrO4 (chromsyre) HCN (cyanhydroxid) HNO2 (salpetersyre) H2SO3 (svovlsyre) |
I en typisk syre/base-reaktion reagerer syren og basen under dannelse af et salt og vand e.g., cyanhydronsyre og natriumhydroxid:
