15.4 Fysiske egenskaber ved carboxylsyrer
Læringsmål
- Sammenlign kogepunkterne for carboxylsyrer med alkoholer med samme molarmasse.
- Sammenlign opløseligheden af carboxylsyrer i vand med opløseligheden af sammenlignelige alkaner og alkoholer i vand.
Mange carboxylsyrer er farveløse væsker med ubehagelige lugte. Carboxylsyrerne med 5 til 10 kulstofatomer har alle en “gedeagtig” lugt (hvilket forklarer lugten af limburgerost). Disse syrer dannes også ved hudbakteriers påvirkning af menneskelig talg (hudolier), hvilket forklarer lugten fra dårligt ventilerede omklædningsrum. Syrer med mere end 10 kulstofatomer er vokslignende faste stoffer, og deres lugt aftager med stigende molarmasse og deraf følgende faldende flygtighed.
Karboxylsyrer udviser stærk brintbinding mellem molekylerne. De har derfor et højt kogepunkt sammenlignet med andre stoffer med tilsvarende molarmasse.
Carboxylgruppen indgår let i hydrogenbinding med vandmolekyler (Figur 15.3 “Hydrogenbinding mellem et eddikesyremolekyle og vandmolekyler”). Syrer med et til fire kulstofatomer er fuldstændig blandbare med vand. Opløseligheden falder, når kulstofkædens længde øges, fordi dipolkræfterne bliver mindre vigtige, og dispersionskræfterne bliver mere fremherskende. Hexansyre er næsten ikke opløseligt i vand (ca. 1,0 g/100 g vand). Palmitinsyre er med sin store upolære kulbrintekomponent stort set uopløselig i vand. Carboxylsyrerne er generelt opløselige i organiske opløsningsmidler som ethanol, toluen og diethylether.
Figur 15.3 Hydrogenbinding mellem et eddikesyremolekyle og vandmolekyler
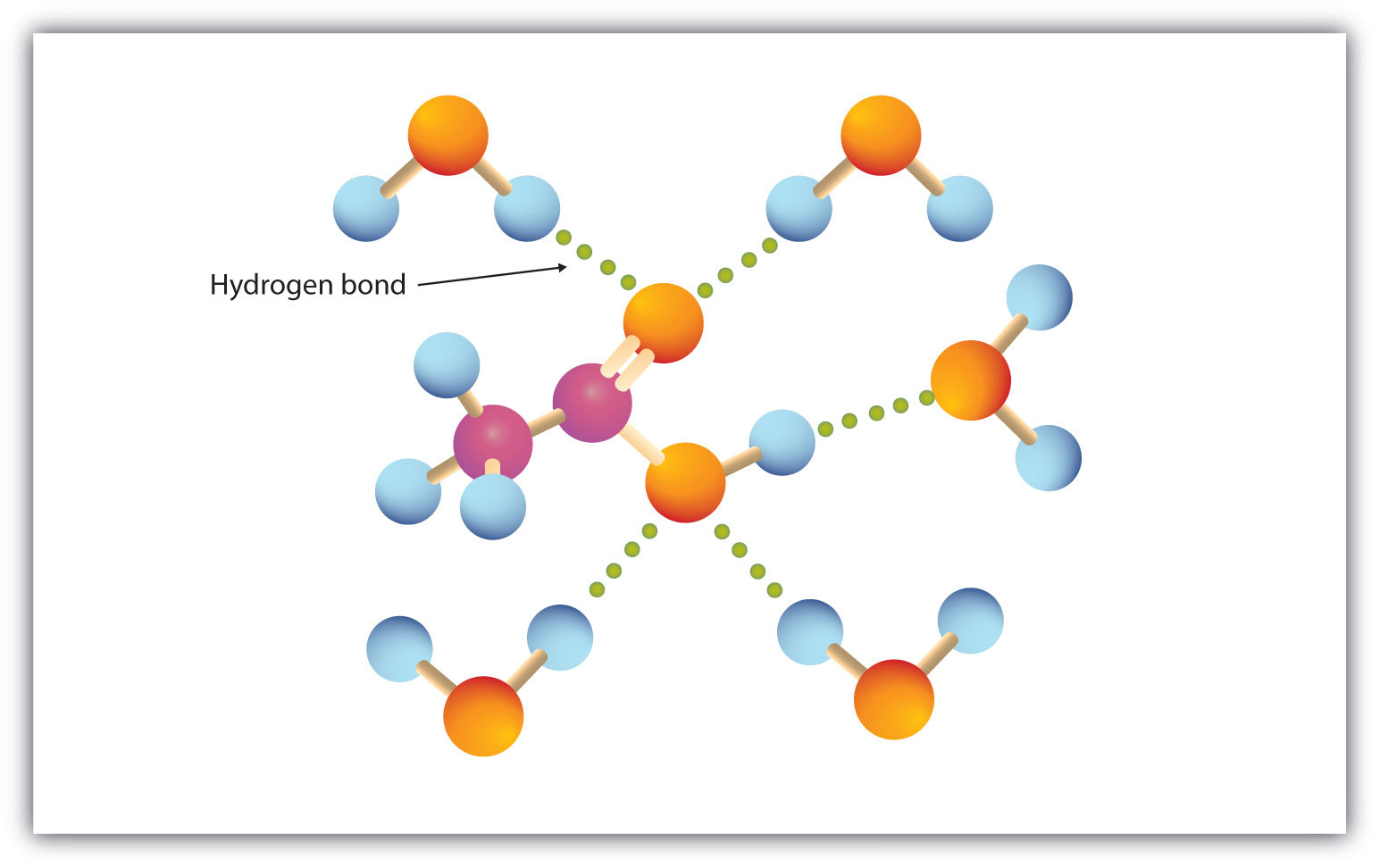
Karboxylsyrer med lav molarmasse er ret opløselige i vand.
Tabel 15.2 “Fysiske konstanter for carboxylsyrer” indeholder en liste over nogle fysiske egenskaber for udvalgte carboxylsyrer. De første seks er homologe. Bemærk, at kogepunkterne stiger med stigende molarmasse, men at smeltepunkterne ikke viser noget regelmæssigt mønster.
Tabel 15.2 Fysiske konstanter for carboxylsyrer
| Kondenseret strukturformel | Syrenavn | Smeltepunkt (°C) | Kogningspunkt (°C) | Løselighed (g/100 g vand) | |
|---|---|---|---|---|---|
| HCOOH | myresyre | 8 | 100 | blandbar | |
| CH3COOH | eddikesyre | 17 | 118 | blandbar | |
| CH3CH3CH2COOH | propionsyre | -22 | 141 | blandbar | |
| CH3(CH2)2COOH | smørsyre | -5 | 163 | blandbar | |
| CH3(CH2)3COOH | valronsyre | -35 | 187 | 5 | |
| CH3(CH2)4COOH | capronsyre | 3 | -3 | 205 | 1.1 |
| C6H5COOH | benzoesyre | 122 | 249 | 0.29 |
Begrebsgennemgang øvelser
-
Hvilken forbindelse har det højere kogepunkt-butansyre (molarmasse 88) eller 2-pentanon (molarmasse 86)? Forklar.
-
Vil du forvente, at smørsyre (butansyre) er mere eller mindre opløseligt end 1-butanol i vand? Forklar.
Svar
-
Buttersyre på grund af hydrogenbinding (Der er ingen intermolekylær hydrogenbinding i 2-pentanon.)
-
mere opløseligt, fordi der er mere omfattende hydrogenbinding
Nøglepunkter
- Karboxylsyrer har høje kogepunkter sammenlignet med andre stoffer med tilsvarende molarmasse. Kogepunktet stiger med molarmassen.
- Karboxylsyrer med et til fire kulstofatomer er fuldstændig blandbare med vand. Opløseligheden falder med molarmassen.
Opgaver
-
Hvilken forbindelse har det højere kogepunkt-CH3CH2CH2CH2OCH2CH3 eller CH3CH2CH2CH2COOH? Forklar.
-
Hvilken forbindelse har det højere kogepunkt-CH3CH2CH2CH2CH2CH2CH2OH eller CH3CH2CH2CH2COOH? Forklar.
-
Hvilken forbindelse er mere opløselig i vand-CH3COOH eller CH3CH2CH2CH2CH3? Forklar.
-
Hvilken forbindelse er mere opløselig i vand-CH3CH2COOH eller CH3CH2CH2CH2CH2CH2CH2COOH? Forklar.
Svar
-
CH3COOH, fordi det indgår i hydrogenbinding med vand (Der er ingen intermolekylær hydrogenbinding med CH3CH2CH2CH3.)
CH3CH2CH2CH2COOH på grund af hydrogenbinding (Der er ingen intermolekylær hydrogenbinding med CH3CH2CH2OCH2CH2CH3.)
