Klinikere har længe været frustrerede over den uforholdsmæssigt store rolle, som det intraokulære tryk (IOP) spiller i behandlingen af glaukom. Som den eneste faktor, der er egnet til medicinsk eller kirurgisk indgreb, er dets rolle afgørende. Alligevel er tonometri i sagens natur begrænset: En enkelt aflæsning, der foretages med få måneders mellemrum, kan ikke skildre IOP’s daglige ebbe og flod. Selv når patienterne får flere tonometriaflæsninger, giver det ikke en ideel fornemmelse af patientens IOP-karakteristika.

|
|
| Denne implanterbare mikrofluidiske 24-timers IOP-overvågningssensor er i øjeblikket under udvikling på Stanford University. Foto: Ishmail E. Araci |
Eksperter mener, at man på et tidspunkt vil udstyre patienter med en lillebitte sensor, der sidder på en kontaktlinse eller et par briller, eller sende dem til en øjenlæge for at få en sådan indopereret i øjet. Den vil løbende måle IOP, hvilket vil øge mængden – og forhåbentlig værdien – af de data, man modtager, eksponentielt. Hvis den nuværende tilgang til IOP-dokumentation svarer til at tage et øjebliksbillede, er kontinuerlig 24-timers IOP-overvågning mere lig med at optage en video, der registrerer ændringer over tid i stedet for blot at give én statisk måling.
Disse gadgets er stadig under udvikling. Er de klar til prime time? Lad os tage et kig på, hvordan IOP svinger, de kliniske udfordringer, det skaber, og de nuværende avancerede teknologier, der forsøger at spore IOP bedre for at give større klinisk forståelse.
Et bevægeligt mål
Det er vanskeligt at opstille en behandlingsplan baseret på opnåelse af et mål for IOP, når selve målet er bevægeligt. IOP svinger i løbet af dagen – time for time, minut for minut og endda sekund for sekund – på grund af en række endogene og eksogene faktorer.
I det okulære system kan IOP afhænge af balancen mellem produktion af kammervæske, udstrømningsfacilitet (hvor let kammervæske forlader øjet), episkleralt venetryk (trykket i venerne på øjets overflade) og uveoskleralt udstrømning (en sekundær vej for kammervæske til at forlade øjet).
For eksempel ville en stigning i udstrømningsfaciliteten eller et fald i produktionen af kammervæske sænke IOP, siger Arthur J. Sit, MD, en glaukomforsker ved Mayo Clinic i Rochester, Minn. Kortvarige spring i IOP kan også forekomme på grund af tryk på øjet fra blink eller gnidning af øjet eller endda under øjenbevægelser eller blodtrykspulsationer.
Intraokulært tryk svinger også på grund af kropsholdning, tidspunktet på dagen (toppe om natten, lavpunkter i løbet af dagen), blodtryk og det relaterede begreb okulært perfusionstryk (OPP), stress- eller smerteniveau, vand- og koffeinforbrug.
Dertil kommer, at kraftig aktivitet og stress kan få blodtrykket, IOP og OPP til at toppe, siger Kaweh Mansouri, MD, MPH, en øjenlæge ved universitetet i Genève og University of Colorado Denver. Måling af blodtryk i forbindelse med IOP har værdi for at fastslå, hvordan blodtrykket påvirker IOP, siger Dr. Mansouri. Forskere bruger i øjeblikket 24-timers IOP-overvågningsapparater til at undersøge disse virkninger på glaukomudvikling.
|
Dos and Don’ts of IOP Measurement Det er ikke nødvendigt at diagnosticere eller behandle efter blot én måling. Dr. Sowka råder optometristerne til ikke at starte behandling med det samme, medmindre trykket er overdrevent højt, eller synsnerverne allerede er alvorligt beskadiget og sårbare; mål i stedet trykket flere gange. Det er også en god idé at få foretaget flere trykmålinger efter påbegyndt behandling for at afgøre, om medicinen virker, siger Dr. Sowka. Én IOP-måling efter påbegyndelse af en medicin er virkelig ikke nok til at bedømme den virkelige effekt. Fortæl patienterne at slappe af. Som tidligere nævnt kan patienterne anstrenge sig eller holde vejret under tonometri. Fortæl dem regelmæssigt, at de skal slappe af og trække vejret normalt under processen, opfordrer Dr. Mansouri indtrængende. Lad ikke din mistanke falde fra dig. Hvis patientens IOP-målinger ikke synes at stemme overens med dine vurderinger af synsfeltet og synsnerven, kan der være mere på færde med patientens IOP, end du var klar over, siger Dr. Hartwick. Bed dem om at komme tilbage og måle deres IOP på et andet tidspunkt af dagen, tilføjer han. Og overvej en døgnkurve hos udvalgte patienter. Registrering af en døgnkurve tonometrisk er upraktisk og besværligt for de fleste patienter. Men hvis IOP-niveauet og skadens omfang synes uoverensstemmende – f.eks. når du har mistanke om normalspændingsglaukom – så overvej muligheden, siger Dr. Davey. Hvis patienten er indforstået med det, kan du tage ham med tidligt om morgenen og registrere IOP hver time i otte til 10 timer. “Det giver dig kontorets døgnkurve, som måske ikke er helt repræsentativ for dag/nat-værdierne, men det giver dig i det mindste mere end én måling”, siger han. |
Her er, hvordan disse variabler påvirker IOP:
– Kroppens position. Afhængigt af patientens stilling i stolen kan trykket stige eller falde. IOP er f.eks. lavest, når patienten sidder i en neutral stilling. “Næsten alt andet får IOP til at stige, herunder at bøje nakken fremad, bøje hovedet bagud, dreje hovedet til siden, ligge ned, bøje sig forover, blinke eller gnide øjnene,” siger Dr. Sit.
– Vandforbrug. Hvis man drikker en stor mængde vand, får man patientens blodvolumen til at stige i kort tid. Det venøse tryk stiger også, når patienten indtager mere vand. “Alt de skal gøre er at indtage 16 til 32 oz, hvilket svarer til en eller to små flasker vand, og inden for fem minutter vil trykket stige med 6 mm Hg,” siger Pinakin Gunvant Davey, PhD, OD, professor og glaukomekspert ved College of Optometry ved Western University of Health Sciences i Pomona, Califona.
– Tidspunkt på dagen. Litteraturen har vist, at det højeste IOP forekommer om natten hos to tredjedele af patienterne. Årsagen er, at der ikke udskilles nok vand i vandet om natten, siger Joseph Sowka, OD, professor i optometri ved Nova Southeastern University College of Optometry i Ft. Lauderdale, Fla.
For eksempel observerede Dr. Mansouri patienter i 24 timer i søvnlaboratorier og fandt de højeste IOP’er om natten. Selv om dine patienter ikke bliver udsat for søvnundersøgelser, kommer de måske til dit kontor om aftenen – hvis det er tilfældet, kan du forvente at se forhøjede IOP’er i forhold til andre tidspunkter af dagen.
– Blodtryk. Baseline IOP er baseret på hjertecyklus, systolisk og diastolisk blodtryk. Den kraft, der bruges til at bringe blodet ind i øjet, er det okulære perfusionstryk, forklarer James L. Fanelli, OD, fra Cape Fear Eye Institute i Wilmington, NC.
Hvis blodtrykket er lavt, er der mindre kraft til at “skubbe” blodet ind i øjet, og derfor er der mindre perfusionstryk til øjet. Faktorer, der får IOP til at stige, vil have en effekt på at sænke perfusionstrykket, og faktorer, der sænker blodtrykket, vil også resultere i et lavere perfusionstryk – eller en kombination af disse faktorer kan spille en rolle, siger Dr. Fanelli. Blodtrykket har tendens til at nedregulere i søvntimerne tidligt om morgenen, hvilket også er det tidspunkt på dagen, hvor IOP har tendens til at være højest.1 Disse to modsatrettede faktorer kan have en dobbeltvirkning ved at reducere OPP i nattetimerne, hvilket kan muliggøre øget skade på okulærnervehovedet.
– Stress. En stigning eller et fald i stress forårsager hormonelle ændringer, som presser IOP-niveauet op eller ned. En af Dr. Mansouris patienter – som blev undersøgt ved hjælp af en 24-timers IOP-overvågningssensor på en kontaktlinse – havde trykspidser, hver gang hendes hund havde epileptiske anfald om natten.
– Generelle “nerver”. Det er muligt, at hos nogle patienter kan stress ved selve øjenundersøgelsen – for eksempel hvis de er bekymrede for at blive diagnosticeret med glaukom – få deres IOP til at stige, siger Andrew Hartwick, OD, PhD, lektor ved Ohio State University College of Optometry i Columbus. De kan f.eks. klemme øjnene sammen, fordi de er stressede over undersøgelsen, og IOP-målingerne stiger i vejret.
– Smerte forårsager også stigninger i IOP, fordi det forårsager stress. En af Dr. Mansouris patienter slog sit ben voldsomt på en parkeringsplads. Der var en stigning i hendes IOP-niveau på det nøjagtige tidspunkt, hvor hun huskede, at ulykken var sket, ifølge 24-timers overvågningsdata.
Følgevirkninger af unøjagtige IOP-aflæsninger
Studier har vist, at toppe i IOP kan bidrage til glaukom-progression.2,3 Men hvis du undersøger en patient, når IOP er på sit laveste eller højeste, kan du overvurdere eller undervurdere diagnosen glaukom eller den behandling, der er nødvendig for patienten.
“Hvis vi fanger en patient i et lavpunkt, hvor IOP er lavest, kan det føre os væk fra en overvejelse af glaukom,” især hvis aflæsningen falder inden for et statistisk normalt område, siger Dr. Sowka. “Andre gange kan vi måske få dem ved en IOP-top, hvor den ligger lidt over normalen – et scenarie, der har tendens til at få behandlere til at bekymre sig unødigt.”
|
|
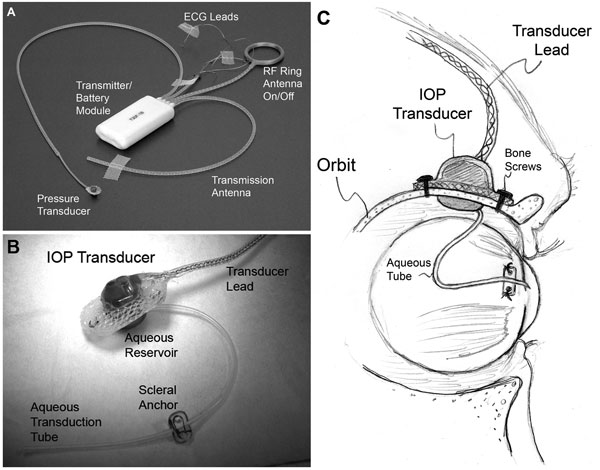
| (A) Et typisk T30F totalimplantatsystem (Konigsberg Instruments). (B) Den ekstraorbitale overflade af det tilpassede IOP-transducerhus. (C) Et 23-gauge silikoneslange leverer vand fra det forreste kammer til et væskebeholder på den intraorbitale side af transduceren (delvist skjult fra synet i B); Slangen (med passende slaphed for at tillade øjenbevægelse) blev trimmet og indsat i det forreste kammer. |
Registrering af et IOP-område ville potentielt muliggøre en forbedring af glaukomdiagnostik og -behandling. “Hvis forskerne kunne vise, at specifikke 24-timers IOP-mønstre er relateret til progression af glaukom, er der håb om, at påvisning af disse mønstre kan hjælpe med at identificere patienter med øget risiko for progression og give os mulighed for at tilpasse deres behandling i overensstemmelse hermed”, siger Dr. Mansouri.
Glaukom kunne identificeres tidligere, hvilket ville gøre det muligt at påbegynde operation eller medicinering hurtigere, tilføjer han. Øjenlæger kunne også afgøre, om IOP-sænkende lægemidler er effektive om natten eller under specifikke aktiviteter, der øger IOP.
Det ville kræve kontinuerlig 24-timers IOP-overvågning at fastlægge et sandt IOP-område. Dette er en udfordring, fordi en enkelt IOP-måling, der indsamles i normal kontortid, ikke indfanger intervallet af en patients IOP, dets toppe eller ændringer i løbet af dagen.4
Det er lige nu muligt at bestemme IOP-området ved hjælp af Goldman-applanationstonometri (GAT) ved hjælp af en døgnspændingskurve (DTC), hvor IOP-aflæsninger opfanges på forskellige tidspunkter i løbet af kliniktiden. Men dette er problematisk for både behandler og patient. Natlige kurver registreres ikke, og færre end 1 % af patienterne gennemgår DTC eller IOP-overvågning i et søvnlaboratorium.4
Forskere målte IOP i 24 timer og dokumenterede ikke blot, at IOP topper om natten, men at IOP-svingningerne var langt større uden for kontortid.5 I en undersøgelse af 35 patienter, hvis IOP blev registreret ved hjælp af et pneumatonometer i et søvnlaboratorium i 24 timer, blev de fleste IOP-toppe registreret om natten hos ældre glaukom-patienter sammenlignet med raske personer, uanset om de sad eller lå ned.6
For nylig har forskere, der anvender 24-timers overvågning, erfaret, at det gennemsnitlige IOP ikke kun stiger om natten, men at det faktisk stiger konstant – og mere om dagen end om natten.7 Forskere på Devers Eye Institute i Portland, Ore, brugte et telemetrisystem, der var implanteret i abens øjne, til at registrere 500 IOP-målinger pr. sekund.
De fandt ud af, at IOP svinger meget mere end tidligere antaget. “Blink og øjenbevægelser genererer store IOP-spikes, der forekommer ca. 12.000 gange i timen og udgør ca. 12 % af den samlede IOP-energi, som øjet skal absorbere i løbet af de vågne timer”, fandt forskerne. De mener, at disse data hos aberne vil være omtrent de samme hos mennesker. “IOP må nu betragtes som dynamisk og i konstant forandring, og IOP-svingninger kan vise sig at være en vigtig bidragyder til glaukom. “8
De fandt også, at døgncyklussen ikke gentager sig fra dag til dag. Derfor er der behov for kontinuerlig IOP-overvågning. De nuværende prototyper omfatter implanterede sensorer og kontaktlinsebaserede enheder.
Intelligent Implantables
Flere nystartede virksomheder har udviklet telemetriske tryksensorer, som kan implanteres under katarakt- eller glaukomoperationer. “Telemetrisk betyder, at trykmålingerne opfanges på afstand (dvs. inde fra øjet) og transmitteres trådløst til en ekstern læser”, siger Dr. Sit.
Implantérbare enheder, der i øjeblikket undersøges, omfatter:

|
|
|
Pro-IOP-sensoren er en telemetrisk enhed, der implanteres ligesom en IOL. Foto: Implandata Ophthalmic Products GmbH |
– Pro-IOP. Det tyske firma Implandata Ophthalmic Products arbejder på Pro-IOP, en trådløs intraokulær tryktransducer (WIT), der forsynes telemetrisk med strøm fra en håndholdt enhed. WIT’en ligner en lille plastikring og måler 11,3 mm i diameter.9 Den indeholder tryksensorer, en temperatursensor, en identifikationskoder, en analog-digital-kodetæller og en telemetrienhed i et enkelt mikroelektromekanisk system.9
En RFID-chip med indbygget antenne sender 24-timers IOP-målinger til en ekstern håndholdt læser. Patienten og lægen kan også med tiden få mulighed for at modtage dataene via en smartphone-app. Patienten kan også kommunikere med lægen om IOP-aflæsninger på app’en.
Enheden har endnu ikke fået CE-mærket i Europa eller FDA-godkendt i USA, men forskere i Tyskland har for nylig indsat Pro-IOP i den første menneskelige forsøgsperson, en kvinde i 60’erne; der er endnu ikke offentliggjort nogen data.9
– AcuMEMs. AcuMEMs er et implantabelt apparat under udvikling af et amerikansk firma af samme navn og fungerer på samme måde som Pro-IOP. Sensoren er en kapacitiv tryksensor, der ændrer form med udsving i IOP. “Når den ændrer form, ændres den elektriske kapacitans, og dette kan registreres eksternt med læseren”, siger Dr. Sit.
Sensoren kan implanteres i det forreste kammer som en selvstændig procedure eller som en del af en glaukomoperation; den kan også indsættes i kapselposen under en operation for grå stær.
– Mikrofluidisk IOL-implantat. Forskere fra Stanford University og Bar-Ilan University i Israel er i fællesskab ved at udvikle en mikrofluidisk sensor, der kan implanteres. IOP vil blive målt “på grundlag af en etableret grænseflade med ligevægtstryk mellem en intraokulær væske og gas”, som er indeholdt i sensorens kamre, ifølge patentet på enheden. Patienter og læger kan bruge deres smartphones eller en ekstern læser til at kontrollere deres IOP.10 Opfinderne afventer patentgodkendelse af sensoren.
Det signal, der overføres fra enheder, der er implanteret i øjet, kan i teorien være mere præcist end dem, der er fastgjort til kontaktlinser, siger Dr. Davey. Signalstyrken afhænger af, hvor meget energi enheden afgiver. “Vi implanterede begge enheder (Pro-IOP og AcuMEMs), og de fungerede ikke så godt,” siger Dr. Davey.
Både Pro-IOP- og AcuMEMs-læserne kunne potentielt set fastgøres til et par briller, og data ville blive indsamlet på samme måde, siger Dr. Sit.
Kommunikationslinser
Forskere undersøgte først kontaktlinsesensorer i 1970’erne, men de tilgængelige hårde kontaktlinser var for ubehagelige og ændrede patientens øjets strukturelle integritet, ifølge Dr. Davey.
|
|
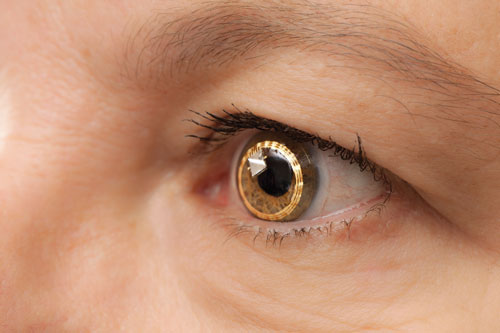
| Den Sensimed Triggerfish på øjet. Den er stadig under klinisk afprøvning i USA. |
Sensorerne var heller ikke følsomme nok. “Personen med et “blødere” øje havde mere præcise aflæsninger end en person med et mere stift øje,” siger Dr. Davey. “Teknologien var ikke god nok til at få IOP-værdier.” En tykkere hornhinde reagerer mindre let på IOP-ændringer, hvilket gør tonometri (og kontaktlinsesensorer) mindre nøjagtige.
Kontaktlinsebaserede IOP-sensorer omfatter:
– The Triggerfish (Sensimed). På universitetet i Genève i Schweiz foretog øjenlæger tidlige undersøgelser af en kontaktlinse kaldet Triggerfish, ledet af Dr. Mansouri og andre.
Triggerfish er en hydrofil blød kontaktlinse, der er udstyret med en kontaktlinsesensor (CLS). CLS’en har to belastningsmålere placeret omkring limbus, der registrerer ændringer i øjenomfanget. “Disse ændringer i okulær omkreds menes at være relateret til ændringer i IOP og intraokulært volumen, og dette er blevet bevist i enukleerede øjne,” siger Dr. Mansouri. Apparatet måler en blanding af IOP, intraokulært volumen og ændringer i biomekaniske egenskaber (en kombination af corneal og scleral hysteresis og stivhed), som korrelerer med udsving i IOP. En ekstern læser registrerer dataene over en 24-timers periode.
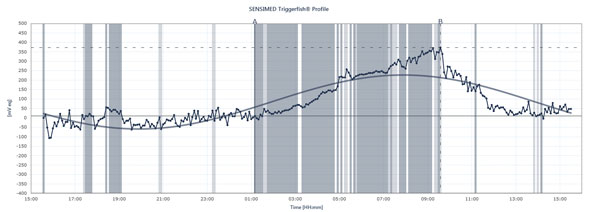
Flowdiagrammet viser toppene og lavpunkterne i IOP hos en patient, der bærer Sensimed Triggerfish over en 24-timers periode.
Triggerfish er CE-mærkningsgodkendt i Europa. FDA-godkendelse er ikke opnået i USA, og apparatet er stadig under kliniske forsøg.
|
Triggerfish sporer IOP anderledes De data, der vises på den eksterne læser, er en kombination af intraokulært tryk, intraokulært volumen og øjets biomekaniske egenskaber, forklarer Dr. Mansouri. “Det er nyttigt at give dig en idé om de kvalitative ændringer i løbet af 24 timer mere end de kvantitative ændringer, fordi vi ikke kan oversætte dem til millimeter kviksølv,” siger han. Triggerfisken giver ikke desto mindre værdifulde oplysninger. Fremtidige undersøgelser, der anvender apparatet, kan hjælpe med at forklare, hvor ustabilt eller stabilt trykket har været i løbet af 24 timer, hvornår natlige IOP-toppe forekommer, hvordan indførelse af behandling eller behandlingsændringer påvirker 24-timers IOP-mønstre, og hvordan specifikke aktiviteter påvirker 24-timers IOP-mønstre, såsom yogastillinger, koffeinindtag, stressede situationer og andre årsager til IOP-toppe, der er beskrevet ovenfor. Dr. Mansouri får også normale eller lavtspændingsglaukom-patienter til at gennemgå samtidig 24-timers blodtryks- og 24-timers IOP-overvågning, da spidser kan påvirke OPP. Men vil Triggerfish vise en sammenhæng mellem 24-timers IOP-mønstre og glaukomudvikling? Der er mange undersøgelser i gang for at besvare dette væsentlige spørgsmål.
|
– Resonanskredsløbssensorkontaktlinse. En anden intelligent CLS-anordning under udvikling er et resonanskredsløb bestående af en tyndfilmskondensator kombineret med en sensorspole, der registrerer deformation af hornhindens krumning. Den er i de tidlige udviklingsfaser under David C.C. Lam på Institut for Mekanisk og Luft- og Rumfartsteknologi ved Hong Kong University of Science and Technology.
I en undersøgelse fra september 2014 blev CLS testet på en øjenmodel af silikonegummi. Det blev konstateret, at sensoren nøjagtigt kunne spore svingende IOP.11
Ligevel som måling af glukoseniveauer én gang om dagen for patienter med diabetes eller blodtryk én gang om dagen for patienter med hjertesygdomme kan afhængighed af én IOP-måling resultere i fejlagtige IOP-data. Men måske kan du i en ikke alt for fjern fremtid med hjælpemidler lige ud af en science fiction-film – kontaktlinser og implantable sensorer – følge IOP med større forståelse og mindre besvær for dig og dine patienter.
1. Liu JH1, Gokhale PA, Loving RT, Kripke DF, Weinreb RN. Laboratorievurdering af døgn- og natlige okulære perfusionstryk hos mennesker. J Ocul Pharmacol Ther. 2003 Aug;19(4):291-7.
2. Zeimer RC, Wilensky JT, Wilensky JT, Gieser DK, Viana MA. Forbindelse mellem intraokulære trykspidser og progression af synsfelttab. Ophthalmology. 1991 Jan;98(1):64-69.
3. Konstas AG, Quaranta L, Mikropoulos DG, et al. Peak Intraocular Pressure and Glaucomatous Progression in Primary Open-Angle Glaucoma. J Ocul Pharmacol Ther. 2012 Feb;28(1):26-32.
4. Mansouri K, Weinreb RN, Medeiros FA. Er 24-timers intraokulær trykovervågning nødvendig ved glaukom? Semin Opththalmol. Maj 2013: 28(3):157-164.
5. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Clinical utility of intraocular pressure monitoring outside of normal office hours in patients with glaucoma. Arch Ophthalmol. 2006 Jun;124(6):793-7.
6. Mosaed S, Liu H, Weinreb RN. Korrelation mellem det maksimale natlige intraokulære tryk hos raske personer og glaukom-patienter. Am J Ophthalmol. 2005; Feb;139(2):320-4.
7. Downs JC, Burgoyne CF, Seigfreid WP, et al. 24-timers IOP-telemetri hos den ikke-menneskelige primat: implantatsystemets ydeevne og indledende karakterisering af IOP på flere tidsskalaer. Invest Ophthalmol Vis Sci. 2011 Sep 21;52(10):7365-75.
8. Association for Research in Vision and Ophthalmology: Nye tendenser og aktuelle emner. Præsenteret mandag den 5. maj 2014 på ARVO’s årsmøde. Tilgængelig på: www.arvo.org/About_ARVO/Press_Room/Emerging_Trends_and_hot_topics__Presented_Monday,_May_5_at_the_ARVO_Annual_Meeting. Tilgået den 19. november 2014.
9. Melki S, Todani A, Cherfan G. An Implantable Intraocular Pressure Transducer Initial Safety Outcomes. JAMA Ophthalmol. 2014 Oct 1;132(10):1221-5.
10. Mandel Y, Araci IE, Quake SR. Google Patents. Implantabel mikrofluidisk anordning til overvågning af intraokulært tryk. Tilgængelig på: www.google.com/patents/WO2014137840A1?cl=en. Tilgået den 17. oktober 2014.
11. Chen GZ, Chan IS, Leung LK, Lam DC. Blød bærbar kontaktlinsesensor til kontinuerlig overvågning af intraokulært tryk. Med Eng Phys. 2014 Sep;36(9):1134-9.
12. Mottet B, Aptel F, Romanet JP, et al. 24-timers intraokulærtryksrytme hos unge raske personer evalueret med kontinuerlig overvågning ved hjælp af en kontaktlinsesensor. JAMA Ophthalmol. 2013 Dec;131(12):1507-16.
