Læringsresultater
- Definer oktetreglen og dens rolle i kemiske bindinger
Det er ikke alle grundstoffer, der har nok elektroner til at fylde deres yderste skal, men et atom er mest stabilt, når alle elektronpositioner i den yderste skal er fyldt op. På grund af disse ledige pladser i de yderste skaller ser vi dannelsen af kemiske bindinger eller vekselvirkninger mellem to eller flere af de samme eller forskellige grundstoffer, som resulterer i dannelsen af molekyler. For at opnå større stabilitet vil atomerne have en tendens til at fylde deres yderste skaller helt op og binde sig til andre grundstoffer for at nå dette mål ved at dele elektroner, acceptere elektroner fra et andet atom eller afgive elektroner til et andet atom. Da de yderste skaller af grundstoffer med lave atomnumre (op til calcium med atomnummer 20) kan indeholde otte elektroner, kaldes dette for oktetreglen. Et grundstof kan afgive, acceptere eller dele elektroner med andre grundstoffer for at fylde sin yderste skal og opfylde oktetreglen.
En tidlig model af atomet blev udviklet i 1913 af den danske videnskabsmand Niels Bohr (1885-1962). Bohr-modellen viser atomet som en central kerne, der indeholder protoner og neutroner, med elektronerne i cirkulære elektronskaller i bestemte afstande fra kernen, svarende til planeter, der kredser om solen. Hver elektronskal har et forskelligt energiniveau, idet de elektronskaller, der er tættest på kernen, har en lavere energi end dem, der er længere væk fra kernen. Konventionelt tildeles hver skal et nummer og symbolet n – for eksempel kaldes den elektronskal, der er tættest på kernen, for 1n. For at bevæge sig mellem skallerne skal en elektron optage eller afgive en energimængde, der svarer nøjagtigt til energiforskellen mellem skallerne. Hvis en elektron f.eks. absorberer energi fra en foton, kan den blive exciteret og bevæge sig til en højere energisk skal; omvendt vil en exciteret elektron, når den falder tilbage til en lavere energisk skal, frigive energi, ofte i form af varme.
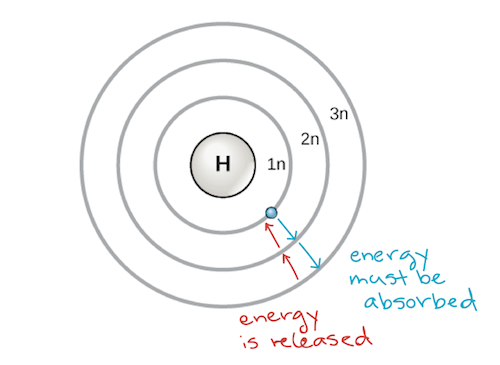
Bohr-model af et atom, der viser energiniveauer som koncentriske cirkler, der omgiver atomkernen. Der skal tilføres energi for at flytte en elektron udad til et højere energiniveau, og der frigives energi, når en elektron falder ned fra et højere energiniveau til et tættere på. Billedkredit: modificeret fra OpenStax Biology
Atomer, ligesom andre ting, der er underlagt fysikkens love, har en tendens til at antage den lavenergi- og mest stabile konfiguration, de kan. Elektronskallerne i et atom er således befolket indefra og ud, idet elektronerne fylder de lavenergiske skaller tættere på kernen, før de bevæger sig ind i de højenergiske skaller længere ude. Den skal, der er tættest på kernen, 1n, kan rumme to elektroner, mens den næste skal, 2n, kan rumme otte, og den tredje skal, 3n, kan rumme op til atten.
Tallet af elektroner i den yderste skal på et bestemt atom bestemmer dets reaktivitet, eller dets tendens til at danne kemiske bindinger med andre atomer. Denne yderste skal er kendt som valensskallen, og de elektroner, der findes i den, kaldes valenselektroner. Generelt er atomer mest stabile og mindst reaktive, når deres yderste elektronskal er fyldt. De fleste af de grundstoffer, der er vigtige i biologien, skal have otte elektroner i deres yderste skal for at være stabile, og denne tommelfingerregel er kendt som oktetreglen. Nogle atomer kan være stabile med en oktet, selv om deres valensskal er 3n-skallen, som kan indeholde op til 18 elektroner. Vi vil undersøge årsagen til dette, når vi diskuterer elektronorbitaler nedenfor.
Eksempler på nogle neutrale atomer og deres elektronkonfigurationer er vist nedenfor. I denne tabel kan du se, at helium har en fuld valensskal med to elektroner i sin første og eneste skal, 1n, med to elektroner. På samme måde har neon en komplet ydre 2n skal, der indeholder otte elektroner. Disse elektronkonfigurationer gør helium og neon meget stabile. Selv om argon teknisk set ikke har en fuld ydre skal, da 3n-skallen kan indeholde op til 18 elektroner, er det stabilt ligesom neon og helium, fordi det har otte elektroner i 3n-skallen og dermed opfylder oktetreglen. I modsætning hertil har klor kun syv elektroner i sin yderste skal, mens natrium kun har én elektron. Disse mønstre fylder ikke den yderste skal og opfylder ikke oktetreglen, hvilket gør klor og natrium reaktive, idet de er ivrige efter at få eller miste elektroner for at nå en mere stabil konfiguration.
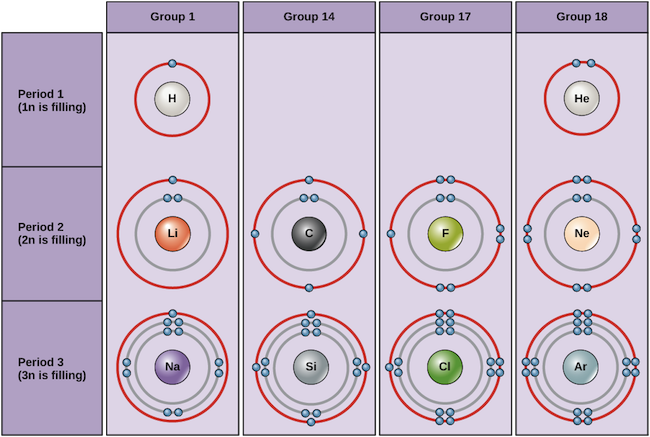
Bohr-diagrammer for forskellige grundstoffer Image credit: OpenStax Biology
Elektronkonfigurationer og det periodiske system
Elementer er placeret i rækkefølge på det periodiske system baseret på deres atomnummer, dvs. hvor mange protoner de har. I et neutralt atom vil antallet af elektroner være lig med antallet af protoner, så vi kan nemt bestemme elektronantallet ud fra atomnummeret. Desuden giver et grundstofs placering i det periodiske system – dets kolonne eller gruppe og række eller periode – nyttige oplysninger om, hvordan disse elektroner er anbragt.
Hvis vi blot betragter de første tre rækker i systemet, som omfatter de vigtigste grundstoffer, der er vigtige for livet, svarer hver række til fyldningen af en anden elektronskal: Helium og brint placerer deres elektroner i 1n-skal, mens grundstoffer i anden række som Li begynder at fylde 2n-skal, og grundstoffer i tredje række som Na fortsætter med 3n-skal. På samme måde giver et grundstofs kolonnetal oplysninger om dets antal valenselektroner og reaktivitet. Generelt er antallet af valenselektroner det samme inden for en kolonne og stiger fra venstre til højre inden for en række. Grundstoffer i gruppe 1 har kun én valenselektron, og grundstoffer i gruppe 18 har otte, bortset fra helium, som kun har to elektroner i alt. Gruppetallet er således en god forudsigelse af, hvor reaktivt hvert grundstof vil være:
- Helium (He), neon (Ne) og argon (Ar) har som grundstoffer i gruppe 18 ydre elektronskaller, der er fulde eller opfylder oktetreglen. Dette gør dem meget stabile som enkeltatomer. På grund af deres manglende reaktivitet kaldes de inaktive gasser eller ædelgasser.
- Hydrogen (H), lithium (Li) og natrium (Na) har som gruppe 1-elementer kun én elektron i deres yderste elektronskaller. De er ustabile som enkeltatomer, men kan blive stabile ved at miste eller dele deres ene valenselektron. Hvis disse grundstoffer mister en elektron helt – som Li og Na typisk gør – bliver de positivt ladede ioner: Li+, Na+.
- Fluor (F) og klor (Cl) har som gruppe 17-elementer syv elektroner i deres yderste hylstre. De har en tendens til at opnå en stabil oktet ved at tage en elektron fra andre atomer og blive negativt ladede ioner: F- og Cl-.
- Kulstof (C), som er et grundstof i gruppe 14, har fire elektroner i sin yderste skal. Kulstof deler typisk elektroner for at opnå en komplet valensskal og danner bindinger med flere andre atomer.
Så afspejler kolonnerne i det periodiske system det antal elektroner, der findes i hvert grundstofs valensskal, hvilket igen bestemmer, hvordan grundstoffet vil reagere.
Afprøv det
Bidrag!
Forbedre denne sideLær mere
