Læringsmål
- Skriv den kemiske formel for en simpel ionforbindelse.
- Kend polyatomare ioner i kemiske formler.
Vi har allerede stødt på nogle kemiske formler for simple ionforbindelser. En kemisk formel er en kortfattet liste over grundstofferne i en forbindelse og forholdet mellem disse grundstoffer. For bedre at forstå, hvad en kemisk formel betyder, må vi se på, hvordan en ionisk forbindelse er opbygget af dens ioner.
Ioniske forbindelser findes som vekslende positive og negative ioner i regelmæssige, tredimensionelle arrays kaldet krystaller (figur \(\PageIndex{1}\)). Som du kan se, er der ikke nogen individuelle NaCl-“partikler” i matrixen; i stedet er der et kontinuerligt gitter af skiftevis natrium- og kloridioner. Vi kan imidlertid bruge forholdet mellem natrium- og kloridioner, udtrykt i de lavest mulige hele tal, som en måde at beskrive forbindelsen på. I tilfældet med natriumchlorid er forholdet mellem natriumioner og chloridioner, udtrykt i de laveste hele tal, 1:1, så vi bruger NaCl (et Na-symbol og et Cl-symbol) til at repræsentere forbindelsen. NaCl er således den kemiske formel for natriumchlorid, hvilket er en kortfattet måde at beskrive det relative antal forskellige ioner i forbindelsen på. En makroskopisk prøve er sammensat af myriader af NaCl-par; hvert par kaldes en formelenhed. Selv om det er bekvemt at tro, at NaCl-krystaller er sammensat af individuelle NaCl-enheder, viser figur \(\PageIndex{1}\), at ingen enkelt ion er udelukkende forbundet med nogen anden enkelt ion. Hver ion er omgivet af ioner med modsat ladning.
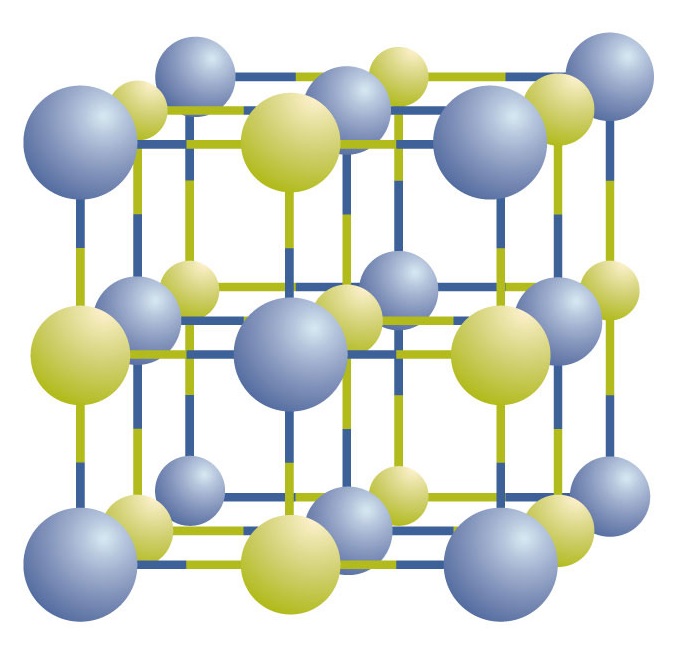
Figur \(\PageIndex{1}\) En natriumchloridkrystal. Et krystal indeholder en tredimensionel række af skiftevis positive og negative ioner. Det præcise mønster afhænger af forbindelsen. En natriumkloridkrystal, som er vist her, er en samling af skiftevis natrium- og klorioner.
Formlen for en ionisk forbindelse følger flere konventioner. For det første skrives kationen før anionen. Da de fleste metaller danner kationer og de fleste ikke-metaller danner anioner, anføres i formlerne typisk først metallet og derefter ikke-metallet. For det andet skrives ladninger ikke i en formel. Husk på, at i en ionisk forbindelse er de enkelte bestanddele ioner og ikke neutrale atomer, selv om formlen ikke indeholder ladninger. Endelig følger den korrekte formel for en ionisk forbindelse altid følgende regel: den samlede positive ladning skal være lig med den samlede negative ladning. For at bestemme den korrekte formel for en hvilken som helst kombination af ioner skal man bestemme, hvor mange af hver ion der er nødvendige for at afbalancere de samlede positive og negative ladninger i forbindelsen.
Denne regel er i sidste ende baseret på det faktum, at materien overordnet set er elektrisk neutral.
Den konventionelle antagelse er, at der kun er ét atom, hvis der ikke er en subscript. Vi bruger ikke 1 som subscript.
Hvis vi ser på den ioniske forbindelse bestående af lithiumioner og bromidioner, ser vi, at lithiumionen har en 1+ ladning og bromidionen har en 1- ladning. Der er kun brug for én ion af hver for at afbalancere disse ladninger. Formlen for lithiumbromid er LiBr.
Når en ionisk forbindelse dannes af magnesium og oxygen, har magnesiumionen en 2+ ladning, og oxygenatomet har en 2-ladning. Selv om begge disse ioner har højere ladninger end ionerne i lithiumbromid, balancerer de stadig hinanden i et 1-til-1-forhold. Derfor er den korrekte formel for denne ionforbindelse MgO.
Se nu på den ionforbindelse, der er dannet af magnesium og klor. En magnesiumion har en 2+-ladning, mens en klorion har en 1-ladning:
Mg2+ Cl-
Sammenlægning af en ion af hver af dem afbalancerer ikke fuldstændigt de positive og negative ladninger. Den nemmeste måde at afbalancere disse ladninger på er at antage tilstedeværelsen af to kloridioner for hver magnesiumion:
Mg2+ Cl- Cl- Cl-
Nu er de positive og negative ladninger afbalanceret. Vi kunne skrive den kemiske formel for denne ionforbindelse som MgClClCl, men det er konventionelt at bruge et numerisk subscript, når der er mere end én ion af en given type – MgCl2. Denne kemiske formel siger, at der er én magnesiumion og to kloridioner i denne formel. (Læs ikke “Cl2”-delen af formlen som et molekyle af det toatomige grundstof klor. Klor findes ikke som et diatomært grundstof i denne forbindelse. Det eksisterer snarere som to individuelle chloridioner). Konventionelt anvendes det laveste hele talforhold i formlerne for ionforbindelser. Formlen Mg2Cl4 har balancerede ladninger med ionerne i et forhold på 1:2, men det er ikke det laveste heltalsforhold.
Som konvention anvendes det laveste heltalsforhold mellem ionerne i ionformler. Der er undtagelser for visse ioner, f.eks. Hg22+
Eksempel \(\PageIndex{1}\)
Skriv den kemiske formel for en ionisk forbindelse, der er sammensat af hvert ionpar.
- natriumionen og svovlionen
- aluminiumionen og fluoridionen
- 3+ jernionen og oxygenionen
Løsning
- For at opnå en valensskal-oktet danner natrium en ion med en 1+ ladning, mens svovlionen har en 2-ladning. Der er behov for to natrium 1+-ioner for at udligne svovlionens 2-ladning. I stedet for at skrive formlen som NaNaS forkorter vi den efter konvention til Na2S.
- Aluminiumionen har en 3+ ladning, mens den fluoridion, der dannes af fluor, har en 1- ladning. Der er behov for tre fluor 1-ioner for at afbalancere aluminiumionens 3+-ladning. Denne kombination skrives som AlF3.
- Iron kan danne to mulige ioner, men ionen med en 3+ ladning er specificeret her. Oxygenatomet har en 2-ladning som ion. For at afbalancere de positive og negative ladninger ser vi på det mindste fælles multiplum-6: to jern 3+-ioner vil give 6+, mens tre 2- ilt-ioner vil give 6-, hvorved de samlede positive og negative ladninger balanceres. Formlen for denne ionforbindelse er således Fe2O3.
Ovelse \(\PageIndex{1}\)
Skriv den kemiske formel for en ionforbindelse, der er sammensat af hvert par af ioner.
- kalciumionen og oxygenionen
- 2+ kobberionen og svovlionen
- 1+ kobberionen og svovlionen
Polyatomære ioner
Nogle ioner består af grupper af atomer, der er bundet sammen, og som har en samlet elektrisk ladning. Fordi disse ioner indeholder mere end ét atom, kaldes de polyatomiske ioner. Polyatomiske ioner har karakteristiske formler, navne og ladninger, som bør læres udenad. NO3- er f.eks. nitrat-ionen; den har et nitrogenatom og tre oxygenatomer og en samlet ladning på 1. Tabel \(\PageIndex{1}\) indeholder en liste over de mest almindelige polyatomare ioner.
| Navn | Formel | |
|---|---|---|
| ammonium-ion | NH4+ | |
| acetat-ion | C2H3O2- | |
| carbonat-ion | CO32- | |
| hydrogencarbonat-ion (bicarbonat-ion) | HCO3- | |
| cyanidion | CN- | |
| hydroxidion | OH- | OH- |
| phosphat-ion | PO43- | |
| hydrogenphosphat-ion | HPO42- | |
| dihydrogenphosphat-ion | H2PO4- | |
| nitrat-ion | NO3- | |
| sulfit-ion | SO32- |
Reglen for opbygning af formler for ionforbindelser, der indeholder polyatomare ioner, er den samme som for formler, der indeholder monatomare (enkelt-atom) ioner: De positive og negative ladninger skal balancere. Hvis der er behov for mere end én af en bestemt polyatomisk ion for at balancere ladningen, skal hele formlen for den polyatomiske ion omsluttes af parenteser, og det numeriske subscript placeres uden for parenteserne. Dette er for at vise, at subscriptet gælder for hele den polyatomare ion. Et eksempel er Ba(NO3)2.
Eksempel \(\PageIndex{2}\)
Skriv den kemiske formel for en ionisk forbindelse, der er sammensat af hvert par af ioner.
- kalium-ionen og sulfat-ionen
- kalcium-ionen og nitrat-ionen
Løsning
- Kalium-ioner har en ladning på 1+, mens sulfat-ioner har en ladning på 2-. Vi skal bruge to kaliumioner for at udligne ladningen på sulfat-ionen, så den korrekte kemiske formel er K2SO4.
- Kalciumioner har en ladning på 2+, mens nitrat-ioner har en ladning på 1-. Vi skal bruge to nitrationer til at afbalancere ladningen på hver calciumion. Formlen for nitrat skal angives i parentes. Vi skriver således Ca(NO3)2 som formlen for denne ionforbindelse.
Ovelse \(\PageIndex{2}\)
Skriv den kemiske formel for en ionforbindelse, der er sammensat af hvert par af ioner.
- magnesiumionen og carbonat-ionen
- aluminiumionen og acetat-ionen
Opnåelse af ionforbindelser
Der er to måder at genkende ionforbindelser på. For det første er forbindelser mellem metal- og ikke-metalelementer normalt ioniske. CaBr2 indeholder f.eks. et metalelement (calcium, et metal i gruppe 2A) og et ikke-metallisk element (brom, et ikke-metal i gruppe 7A). Derfor er det højst sandsynligt en ionisk forbindelse. (Faktisk er den ionisk.) I modsætning hertil indeholder forbindelsen NO2 to grundstoffer, der begge er ikke-metaller (nitrogen, fra gruppe 5A, og oxygen, fra gruppe 6A). Det er ikke en ionisk forbindelse; den hører til den kategori af kovalente forbindelser, der er behandlet andetsteds. Bemærk også, at denne kombination af nitrogen og oxygen ikke har nogen specificeret elektrisk ladning, så det er ikke nitrit-ionen.
For det andet, hvis du genkender formlen for en polyatomisk ion i en forbindelse, er forbindelsen ionisk. Hvis du f.eks. ser formlen Ba(NO3)2, kan du genkende “NO3”-delen som nitrat-ionen, \(\rm{NO_3^-}\). (Husk, at det er konventionelt at skrive formler for ioniske forbindelser uden at medtage den ioniske ladning). Dette er et fingerpeg om, at den anden del af formlen, Ba, faktisk er Ba2+-ionen, idet 2+-ladningen udligner den samlede 2-ladning fra de to nitrationer. Denne forbindelse er således også ionisk.
Eksempel \(\PageIndex{3}\)
Identificer hver forbindelse som ionisk eller ikke ionisk.
- Na2O
- PCl3
- NH4Cl
- OF2
Løsning
- Natrium er et metal, og ilt er et ikke-metal; derfor forventes Na2O at være ionisk.
- Både fosfor og klor er ikke-metaller. Derfor er PCl3 ikke ionisk.
- NH4 i formlen repræsenterer ammoniumionen, NH4+, hvilket indikerer, at denne forbindelse er ionisk.
- Både oxygen og fluor er ikke-metaller. Derfor er OF2 ikke ionisk.
Øvelse \(\PageIndex{3}\)
Identificer hver forbindelse som ionisk eller ikke ionisk.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Se nærmere på det: Blod og havvand
Videnskaben har længe erkendt, at blod og havvand har lignende sammensætninger. Begge væsker har trods alt ionforbindelser opløst i dem. Ligheden kan være mere end blot en tilfældighed; mange forskere mener, at de første former for liv på Jorden opstod i havene. Et nærmere kig viser imidlertid, at blod og havvand er helt forskellige. En 0,9 % opløsning af natriumchlorid svarer nogenlunde til den saltkoncentration, der findes i blodet. Havvand er derimod hovedsageligt en opløsning af 3 % natriumklorid, hvilket er mere end tre gange så meget som koncentrationen i blodet. Her er en sammenligning af mængden af ioner i blod og havvand:
| Ion | Percent i havvand | Percent i blod | |
|---|---|---|---|
| Na+ | 2.36 | 0,322 | |
| Cl- | 1,94 | 0,366 | |
| Mg2+ | 0,13 | 0,002 | |
| SO42- | 0,002 | ||
| SO42- | 0.09 | – | |
| K+ | 0.04 | 0.016 | |
| Ca2+ | 0.04 | 0.0096 | |
| HCO3- | 0.002 | 0.0096 | |
| 0.165 | |||
| HPO42-, H2PO4- | – | 0,01 |
De fleste ioner er mere rigelige i havvand end de er i blod, med nogle vigtige undtagelser. Der er langt flere hydrogenkarbonat-ioner (HCO3-) i blodet end i havvand. Denne forskel er væsentlig, fordi hydrogencarbonat-ionen og nogle beslægtede ioner spiller en afgørende rolle for styringen af blodets syre-base-egenskaber. Mængden af hydrogenphosphat-ioner – HPO42- og H2PO4 – i havvand er meget lille, men de findes i større mængder i blodet, hvor de også påvirker syre-base-egenskaberne. En anden bemærkelsesværdig forskel er, at blodet ikke har betydelige mængder af sulfat-ionen (SO42-), men denne ion er til stede i havvand.
Nøglepunkter
- Den korrekte kemiske formel for ionforbindelser afbalancerer den samlede positive ladning med den samlede negative ladning.
- Grupper af atomer med en samlet ladning, kaldet polyatomiske ioner, findes også.
Bidragydere og tilskrivninger
-
Anonym
