Termín uhlovodík označuje nejzákladnější typ organických molekul. Skládají se pouze ze dvou prvků: vodíku a uhlíku, odtud název uhlovodíky. Obecně mají molekuly uhlovodíků strukturu s jedním nebo více atomy uhlíku tvořícími centrální strukturu, která je obklopena atomy vodíku. Existují čtyři hlavní typy uhlovodíků: Alkany, alkeny, alkiny a aromatické uhlovodíky.
Nejjednodušší uhlovodíky se nazývají alkany. Alkany se vyznačují jednoduchým uhlíkovým řetězcem, kde je každý atom uhlíku vázán na 2 atomy vodíku a 2 atomy uhlíku, s výjimkou uhlíků na konci řetězce, které jsou vázány na třetí vodík místo na druhý uhlík. Příklad alkanů je vidět na obrázku 1, který ukazuje, že všechny alkany jsou tvořeny jednoduchými vazbami. Geometrie uhlovodíků může být velmi složitá, jak se molekuly zvětšují a případně obsahují větve a cyklické „smyčky“ atomů uhlíku.
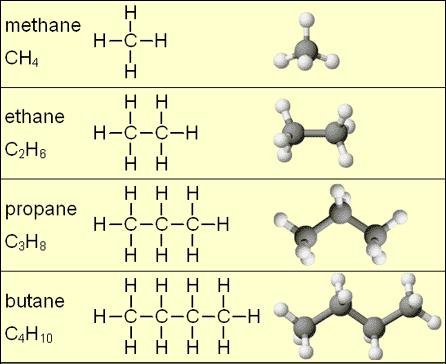
Někdy mohou v molekule uhlovodíku nahradit vodík nebo uhlík jiné prvky než vodík a uhlík. Vodík může být například nahrazen bromovým nebo hydroxidovým iontem. Existuje obrovské množství možných nečistých uhlovodíků, které obsahují jeden nebo více různých prvků. Obecně platí, že uhlovodík, který obsahuje jiné prvky než vodík a uhlík, není pravým uhlovodíkem a nazývá se derivátem uhlovodíku.
Uhlovodíky a jejich deriváty jsou hlavní složkou fosilních paliv a při spalování s kyslíkem uvolňují energii. Podrobnější popis tohoto procesu naleznete na stránce Spalování uhlovodíků.
Uhlovodíky se kromě paliv používají v mnoha dalších aplikacích. Některé uhlovodíky se vyskytují v mazacích olejích, mazivech, rozpouštědlech, palivech, vosku, asfaltech, kosmetice a plastech. Tyto uhlovodíky jsou také produkty frakční destilace. Přestože se uhlovodíky spotřebovávají především v palivech, mají pro společnost a ekonomiku velký význam i jiné než palivové aplikace uhlovodíků.
Chcete-li se o uhlovodících dozvědět více, podívejte se na UC Davis Chem Wiki.
Pro další čtení
Podívejte se na konkrétní typy uhlovodíků:
- Metan
- Etan
- Propan
- Butan
- Oktan
- Dekan
- 1,0 1,1 C. Nave. „Uhlovodíky.“ Internet: http://hyperphysics.phy-astr.gsu.edu/hbase/organic/hydrocarbon.html, .
- „Hydrocarbons – Chemistry LibreTexts“, Chem.libretexts.org, 2018. . Dostupné: : https://chem.libretexts.org/Core/Organic_Chemistry/Hydrocarbons. .
- D. Darling. „Alkany.“ Internet: http://www.daviddarling.info/encyclopedia/A/alkane.html,
- R.D. Botts, D.M. Carson a D.Coglon. „Petroleum in our live“ in Our petroleum challenge, 8. vyd. Calgary:Canadian Center for Energy Development, 2013, s. 7-15.
