Generický název: lidokain hydrochlorid
Dávkovací forma: lokální želé
Medicínsky přezkoumáno Drugs.com. Naposledy aktualizováno 1. října 2020.
- Přehled
- Nežádoucí účinky
- Dávkování
- Odborné
- Interakce
- Více
Pouze na lékařský předpis
- Popis
- KLINICKÁ FARMAKOLOGIE
- INDIKACE A POUŽITÍ
- KONTRAINDIKACE
- VAROVÁNÍ
- PŘÍPRAVEK
- Použití v těhotenství:
- Nežádoucí účinky
- PŘEDÁVKOVÁNÍ
- DÁVKOVÁNÍ A ZPŮSOB PODÁNÍ
- Maximální dávkování
- Jak se přípravek dodává
- Další informace o lidokainu pro lokální použití
- Zdroje pro spotřebitele
- Zdroje pro odborníky
- Související průvodce léčbou
Popis
Lidokain HCI 2% želé je sterilní, vodný přípravek, který obsahuje lokální anestetikum a podává se lokálně. (Specifická použití viz INDIKACE.)
Lidocaine HCI 2% Jelly obsahuje lidocaine HCI, který je chemicky označován jako acetamid, 2-(diethylamino)-N-(2,6-dimethylfenyl)-,monohydrochlorid a má následující strukturní vzorec:
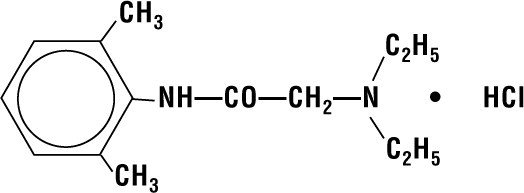
Jeho molekulární vzorec je C14H22N2O – HCI a jeho molekulová hmotnost je 270. Lidocaine HCI 2% Jelly je určen pro léčebné účely.80.
Lidokain HCI 2% želé obsahuje také hypromelosu a výsledná směs maximalizuje kontakt se sliznicí a zajišťuje lubrikaci při instrumentaci. Nespotřebovanou část je třeba po prvním použití zlikvidovat.
Složení přípravku Lidocaine HCI 2% Jelly 30 ml a 5 ml tuby: Každý ml obsahuje 20 mg lidokainu HCI. Přípravek dále obsahuje methylparaben, propylparaben, hypromelosu a hydroxid sodný a/nebo kyselinu chlorovodíkovou k úpravě pH v rozmezí 6,0 až 7,0.
KLINICKÁ FARMAKOLOGIE
Mechanismus účinku: Lidokain stabilizuje neuronální membránu inhibicí iontových toků potřebných pro iniciaci a vedení impulzů, čímž působí lokálně anesteticky.
Nástup účinku: Nástup účinku je 3 až 5 minut. Při aplikaci na neporušenou kůži je neúčinný.
Hemodynamika: Nadměrné množství krve může způsobit změny srdečního výdeje, celkového periferního odporu a středního arteriálního tlaku. Tyto změny mohou být způsobeny přímým tlumivým účinkem lokálního anestetika na různé složky kardiovaskulárního systému.
Farmakokinetika a metabolismus: Lidokain se může absorbovat po lokálním podání na sliznice, přičemž rychlost a rozsah absorpce závisí na koncentraci a celkové podané dávce, specifickém místě aplikace a délce expozice. Obecně platí, že k rychlosti absorpce lokálních anestetik po lokální aplikaci dochází nejrychleji po intratracheálním podání. Lidokain se také dobře vstřebává z gastrointestinálního traktu, ale v cirkulaci se může objevit jen málo intaktního léčiva z důvodu biotransformace v játrech.
Lidokain je rychle metabolizován játry a metabolity a nezměněné léčivo jsou vylučovány ledvinami. Biotransformace zahrnuje oxidativní N-dealkylaci, hydroxylaci kruhu, štěpení amidové vazby a konjugaci. N-dealkylace, hlavní cesta biotransformace, poskytuje metabolity monoethylglycinexylidid a glycinexylidid. Farmakologické/toxikologické účinky těchto metabolitů jsou podobné, ale méně silné než u lidokainu. Přibližně 90 % podaného lidokainu se vylučuje ve formě různých metabolitů a méně než 10 % se vylučuje v nezměněné formě. Primárním metabolitem v moči je konjugát 4-hydroxy-2,6-dimethylanilinu.
Vazba lidokainu v plazmě je závislá na koncentraci léčiva a s rostoucí koncentrací se vázaná frakce snižuje. Při koncentracích 1 až 4 mcg volné báze na ml je 60 až 80 % lidokainu vázáno na bílkoviny. Vazba je také závislá na plazmatické koncentraci alfa-I-kyselého glykoproteinu.
Lidokain prochází hematoencefalickou a placentární bariérou pravděpodobně pasivní difuzí.
Studie metabolismu lidokainu po intravenózní bolusové injekci ukázaly, že eliminační poločas této látky je obvykle 1,5 až 2,0 hodiny. Vzhledem k rychlé rychlosti, kterou je lidokain metabolizován, může jakýkoli stav, který ovlivňuje funkci jater, změnit kinetiku lidokainu. U pacientů s poruchou funkce jater může být poločas prodloužen dvojnásobně nebo více. Porucha funkce ledvin neovlivňuje kinetiku lidokainu, ale může zvýšit akumulaci metabolitů.
Faktory jako acidóza a užívání stimulancií a depresiv CNS ovlivňují hladiny lidokainu v CNS potřebné k vyvolání zjevných systémových účinků. Objektivní nežádoucí projevy jsou stále zřetelnější se zvyšující se hladinou ve venózní plazmě nad 6 mcg volné báze na ml. U opic rhesus bylo prokázáno, že hladiny v arteriální krvi 18 až 21 mcg/ml jsou prahem pro vznik konvulzivní aktivity.
INDIKACE A POUŽITÍ
Lidokain HCI 2% želé je indikován k prevenci a tlumení bolesti při zákrocích týkajících se mužské a ženské močové trubice, k lokální léčbě bolestivé uretritidy a jako anestetický lubrikant při endotracheální intubaci (orální a nazální).
KONTRAINDIKACE
Lidokain je kontraindikován u pacientů se známou anamnézou přecitlivělosti na lokální anestetika amidového typu nebo na jiné složky přípravku Lidocaine HCI 2% Jelly.
VAROVÁNÍ
VYŠŠÍ DÁVKOVÁNÍ NEBO KRÁTKÉ INTERVALY MEZI DÁVKAMI MOHOU MÍT ZA NÁSLEDEK VYSOKÉ HODNOTY PLAZMY A ZÁVažné nežádoucí účinky. PACIENTI BY MĚLI BÝT POUČENI, ABY PŘÍSNĚ DODRŽOVALI DOPORUČENÉ DÁVKOVÁNÍ A POKYNY PRO PODÁVÁNÍ, JAK JE UVEDENO V TÉTO PŘÍBALOVÉ INFORMACI. ŘEŠENÍ ZÁVAŽNÝCH NEŽÁDOUCÍCH ÚČINKŮ MŮŽE VYŽADOVAT POUŽITÍ RESUSCITAČNÍHO PŘÍSTROJE, OXYGENU A JINÝCH RESUSCITAČNÍCH LÁTEK.
Lidokain HCI 2% želé by měl být používán s maximální opatrností v případě sepse nebo těžce traumatizované sliznice v oblasti aplikace, protože za takových podmínek existuje možnost rychlé systémové absorpce.
Při použití k lubrikaci endotracheální rourky je třeba dbát na to, aby se přípravek nedostal do lumen rourky. Nepoužívejte želé k lubrikaci endotracheálních styletů. Pokud se želé dostane do vnitřního lumen, může na vnitřním povrchu zaschnout a zanechat zbytky, které mají tendenci se při ohýbání shlukovat a zužovat lumen. Byly zaznamenány vzácné případy, kdy tento zbytek způsobil ucpání lumen. (Viz také NEŽÁDOUCÍ REAKCE a Dávkování a způsob podání.)
PŘÍPRAVEK
Všeobecně: Bezpečnost a účinnost lidokainu závisí na správném dávkování, správné technice, adekvátních bezpečnostních opatřeních a připravenosti pro případ nouze. (Viz UPOZORNĚNÍ a NEŽÁDOUCÍ REAKCE.) Je třeba použít nejnižší dávku, která vede k účinné anestezii, aby se zabránilo vysokým plazmatickým hladinám a závažným nežádoucím účinkům. Opakované dávky lidokainu mohou způsobit významné zvýšení hladin v krvi s každou opakovanou dávkou z důvodu pomalé akumulace léčiva nebo jeho metabolitů. Tolerance ke zvýšeným hladinám v krvi se liší podle stavu pacienta. Oslabeným, starším pacientům, akutně nemocným pacientům a dětem by měly být podávány snížené dávky odpovídající jejich věku a fyzickému stavu. Lidokain by měl být také používán s opatrností u pacientů s těžkým šokem nebo srdeční blokádou.
Lidokain HCI 2% želé by měl být používán s opatrností u pacientů se známou citlivostí na léky. U pacientů alergických na deriváty kyseliny paraaminobenzoové (prokain, tetrakain, benzokain atd.) nebyla prokázána zkřížená citlivost na lidokain.
Mnoho léčiv používaných při provádění anestezie je považováno za potenciální spouštěče familiární maligní hypertermie. Vzhledem k tomu, že není známo, zda lokální anestetika amidového typu mohou vyvolat tuto reakci, a protože nelze předem předvídat potřebu doplňkové celkové anestezie, navrhuje se, aby byl k dispozici standardní protokol pro zvládání. Časné nevysvětlitelné příznaky tachykardie, tachypnoe, labilního krevního tlaku a metabolické acidózy mohou předcházet zvýšení teploty. Úspěšný výsledek závisí na včasné diagnóze, rychlém přerušení podezřelé vyvolávající látky (látek) a zahájení léčby, včetně léčby kyslíkem, indikovaných podpůrných opatření a dantrolenu (před použitím konzultujte příbalový leták dantrolenu sodného intravenózně).
Informace pro pacienty: Při použití lokálních anestetik v ústech by si měl být pacient vědom, že tvorba lokální anestezie může zhoršit polykání a tím zvýšit nebezpečí aspirace. Z tohoto důvodu by po dobu 60 minut po použití lokálních anestetických přípravků v ústech nebo v oblasti krku neměla být přijímána potrava. To je důležité zejména u dětí vzhledem k jejich častému příjmu potravy.
Nemoc jazyka nebo bukální sliznice může zvýšit nebezpečí neúmyslného kousnutí. Během anestezie v oblasti úst nebo krku by se nemělo užívat jídlo ani žvýkačky.
Karcinogeneze – Dlouhodobé studie na zvířatech, které by hodnotily karcinogenní potenciál lidokainu, nebyly provedeny.
Mutageneze – Mutagenní potenciál lidokainu byl testován v Amesově testu reverzní mutace Salmonella a v testu chromozomových aberací in vitro v lidských lymfocytech a v mikrojádrovém testu in vivo na myších. V těchto studiích nebyl prokázán žádný mutagenní účinek.
Narušení fertility – Vliv lidokainu na fertilitu byl zkoumán na modelu potkanů. Podání 30 mg/kg s.c. (180 mg/m2) pářícímu se páru nevedlo ke změnám fertility ani celkové reprodukční výkonnosti potkanů. Neexistují žádné studie, které by zkoumaly vliv lidokainu na parametry spermií. Nebyly zjištěny žádné důkazy o změněné fertilitě.
Použití v těhotenství:
Teratogenní účinky: Kategorie těhotenství B.
Reprodukční studie lidokainu byly provedeny na potkanech i králících. Na modelu potkanů nebylo prokázáno poškození plodu při subkutánních dávkách až 50 mg/kg lidokainu (300 mg/m2 na základě tělesného povrchu). Na králičím modelu nebylo prokázáno poškození plodu při dávce 5 mg/kg s.c. (60 mg/m2 tělesného povrchu). Při léčbě králíků dávkou 25 mg/kg (300 mg/m2) byly prokázány známky toxicity pro matku a známky opožděného vývoje plodu, včetně nevýznamného poklesu hmotnosti plodu (7 %) a nárůstu drobných skeletálních anomálií (defekt lebky a sternebrální kosti, snížená osifikace falang). Vliv lidokainu na postnatální vývoj byl zkoumán u potkanů tak, že březím samicím potkanů byly denně subkutánně podávány dávky 2, 10 a 50 mg/kg (12, 60 a 300 mg/m2) od 15. dne březosti až do 20. dne po porodu. U matek ani u mláďat nebyly pozorovány žádné známky nežádoucích účinků až do dávky 10 mg/kg (60 mg/m2) včetně; při dávce 50 mg/kg (300 mg/m2) se však počet přeživších mláďat snížil, a to jak při porodu, tak v období laktace, přičemž tento účinek byl s největší pravděpodobností sekundárně způsoben toxicitou pro matku. V této studii nebyly pozorovány žádné další účinky na velikost vrhu, hmotnost vrhu, abnormality u mláďat a fyzický vývoj mláďat.
Druhá studie zkoumala účinky lidokainu na postnatální vývoj u potkanů, která zahrnovala hodnocení mláďat od odstavu do pohlavní dospělosti. Potkanům bylo po dobu 8 měsíců podáváno 10 nebo 30 mg/kg s.c. lidokainu (60 mg/m2, resp. 180 mg/m2 na plochu povrchu těla). Toto období zahrnovalo 3 období páření. U žádného z potomků nebyl prokázán změněný postnatální vývoj, nicméně obě dávky lidokainu významně snížily průměrný počet mláďat na vrh, která přežila do odstavení potomků z prvních 2 období páření.
Neexistují však žádné adekvátní a dobře kontrolované studie u březích žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro reakci u lidí, měl by být tento přípravek používán během těhotenství pouze v případě, že je to jednoznačně nutné.
Porod a porod: Lidokain není při porodu kontraindikován. Pokud se přípravek Lidocaine HCl 2% Jelly používá současně s jinými přípravky obsahujícími lidokain, je třeba mít na paměti celkovou dávku, kterou přispívají všechny přípravky.
Kojící matky: Lidokain se vylučuje do lidského mléka. Klinický význam tohoto pozorování není znám. Při podávání lidokainu kojícím ženám je třeba dbát zvýšené opatrnosti.
Podávání dětem: Ačkoli bezpečnost a účinnost přípravku Lidocaine 2% Jelly u pediatrických pacientů nebyla stanovena, studie na 19 předčasně narozených novorozencích (gestační věk <33 týdnů) nezjistila žádnou korelaci mezi plazmatickou koncentrací lidokainu nebo monoethylglycinexylididu a tělesnou hmotností kojence, když bylo k lubrikaci intranazální i endotracheální rourky použito střední množství lidokainu (tj. 0,3 ml/kg lidokainového gelu 20 mg/ml). U žádného novorozence nebyla hladina lidokainu v plazmě vyšší než 750 mcg/l. Dávky u dětí by měly být sníženy, úměrně věku, tělesné hmotnosti a fyzické kondici. (Viz Dávkování a způsob podání.)
Nežádoucí účinky
Nežádoucí zkušenosti po podání lidokainu jsou podobné povahy jako u jiných amidových lokálních anestetik. Tyto nežádoucí zkušenosti obecně souvisejí s dávkou a mohou být důsledkem vysokých plazmatických hladin způsobených nadměrnou dávkou nebo rychlou absorpcí, nebo mohou být důsledkem přecitlivělosti, idiosynkrazie nebo snížené tolerance ze strany pacienta. Závažné nežádoucí zkušenosti jsou obecně systémové povahy. Nejčastěji jsou hlášeny následující typy:
Vzácně byly hlášeny případy ucpání endotracheální rourky spojené s přítomností zaschlých zbytků želé ve vnitřním lumen rourky. (Viz také UPOZORNĚNÍ a Dávkování a způsob podání.)
Centrální nervový systém: Projevy na CNS jsou excitační a/nebo depresivní a mohou být charakterizovány lehkou závratí, nervozitou, obavami, euforií, zmateností, závratěmi, ospalostí, hučením v uších, rozmazaným nebo dvojitým viděním, zvracením, pocity tepla, chladu nebo znecitlivění, záškuby, třesem, křečemi, bezvědomím, útlumem dýchání a zástavou dechu. Excitační projevy mohou být velmi krátké nebo se nemusí objevit vůbec, v takovém případě může být prvním projevem toxicity ospalost přecházející v bezvědomí a zástavu dechu.
Ospalost po podání lidokainu je obvykle časným příznakem vysoké hladiny léčiva v krvi a může se objevit jako důsledek rychlé absorpce.
Kardiovaskulární systém: Kardiovaskulární projevy jsou obvykle depresivní a vyznačují se bradykardií, hypotenzí a kardiovaskulárním kolapsem, který může vést až k zástavě srdce.
Alergické: Alergické reakce jsou charakterizovány kožními lézemi, kopřivkou, edémem nebo anafylaktoidními reakcemi. Alergické reakce se mohou objevit v důsledku citlivosti buď na lokální anestetikum, nebo na jiné složky přípravku. Alergické reakce v důsledku přecitlivělosti na lidokain jsou velmi vzácné, a pokud se vyskytnou, měly by být zvládnuty běžnými prostředky. Zjištění citlivosti pomocí kožních testů má pochybnou hodnotu.
PŘEDÁVKOVÁNÍ
Akutní stavy nouze způsobené lokálními anestetiky obecně souvisejí s vysokými plazmatickými hladinami, které se vyskytují při terapeutickém použití lokálních anestetik. (Viz NEŽÁDOUCÍ REAKCE, UPOZORNĚNÍ a OPATŘENÍ.)
Řízení naléhavých případů po podání lokálních anestetik: Prvním hlediskem je prevence, které se nejlépe dosáhne pečlivým a trvalým monitorováním kardiovaskulárních a respiračních vitálních funkcí a stavu vědomí pacienta po každém podání lokálního anestetika. Při prvních známkách změn by měl být podán kyslík.
První krok při zvládání křečí spočívá v okamžité pozornosti věnované udržení průchodných dýchacích cest a asistované nebo řízené ventilaci pomocí kyslíku a přívodního systému schopného umožnit okamžitý pozitivní tlak v dýchacích cestách pomocí masky. Ihned po zavedení těchto ventilačních opatření by měla být vyhodnocena adekvátnost oběhu, přičemž je třeba mít na paměti, že léky používané k léčbě křečí někdy při intravenózním podání tlumí oběh. Pokud křeče přetrvávají i přes adekvátní podporu dýchání a pokud to stav oběhu dovoluje, lze intravenózně podat malé dávky ultrakrátce působícího barbiturátu (např. thiopental nebo thiamylal) nebo benzodiazepinu (např. diazepam). Lékař by měl být před použitím lokálních anestetik seznámen s těmito antikonvulzivy. Podpůrná léčba oběhové deprese může vyžadovat podání intravenózních tekutin a v případě potřeby vazopresor podle klinické situace (např. efedrin).
Pokud nejsou křeče i kardiovaskulární deprese okamžitě léčeny, mohou vyústit v hypoxii, acidózu, bradykardii, arytmii a srdeční zástavu. Pokud dojde k zástavě srdce, je třeba zahájit standardní kardiopulmonální resuscitační opatření.
Dialýza má při léčbě akutního předávkování lidokainem zanedbatelný význam.
Perorální LD50 lidokainu HCI u samic potkanů, které nejsou na lačno, je 459 (346 až 773) mg/kg (jako sůl) a 214 (159 až 324) mg/kg (jako sůl) u samic potkanů, které jsou na lačno.
DÁVKOVÁNÍ A ZPŮSOB PODÁNÍ
Při současném použití přípravku Lidocaine HCI 2% Jelly s jinými přípravky obsahujícími lidokain je třeba mít na paměti celkovou dávku, kterou přispívají všechny přípravky.
Dávkování se liší a závisí na oblasti, která má být anestezována, vaskularitě tkání, individuální toleranci a technice anestezie. Měla by se podávat nejnižší dávka potřebná k zajištění účinné anestezie. Dávky by měly být sníženy u dětí a starších a oslabených pacientů. Ačkoli je výskyt nežádoucích účinků u přípravku Lidocaine HCI 2% Jelly poměrně nízký, je třeba dbát zvýšené opatrnosti, zejména při použití velkého množství, protože výskyt nežádoucích účinků je přímo úměrný celkové dávce podaného lokálního anestetika.
Pro povrchovou anestezii močové trubice dospělých mužů: Při použití zkumavky Lidocaine 2% Jelly 30 ml sterilizujte plastový kužel po dobu 5 minut ve vroucí vodě, ochlaďte a připevněte na zkumavku. Kužel může být podle potřeby sterilizován plynem nebo za studena. Pomalu vpravte do močové trubice přibližně 15 ml (300 mg lidokainu HCI) nebo dokud pacient nemá pocit napětí. Poté se na několik minut přiloží penilní svorka na korunku. Pro dosažení dostatečné anestezie lze instilovat další dávku nejvýše 15 ml (300 mg).
Před sondáží nebo cystoskopií by měla být na 5 až 10 minut přiložena penilní svorka, aby bylo dosaženo dostatečné anestezie. K naplnění a rozšíření mužské močové trubice je obvykle zapotřebí celková dávka 30 ml (600 mg).
Před katetrizací jsou obvykle pro lubrikaci dostatečné menší objemy 5 až 10 ml (100 až 200 mg).
Pro povrchovou anestezii močové trubice dospělých žen: Při použití zkumavky Lidocaine 2% Jelly 30 ml sterilizujte plastový kužel 5 minut ve vroucí vodě, ochlaďte a připevněte na zkumavku. Kužel může být podle potřeby sterilizován plynem nebo za studena. Pomalu vpravte 3 až 5 ml (60 až 100 mg lidokainu HCI) želé do močové trubice. V případě potřeby lze část želé nanést na vatový tampon a zavést do močové trubice. Pro dosažení dostatečné anestezie je třeba před provedením urologických výkonů počkat několik minut.
Lubrikace pro endotracheální intubaci: Krátce před použitím naneste na vnější povrch endotracheální rourky mírné množství želé. Je třeba dbát na to, aby se přípravek nedostal do lumen trubice. Nepoužívejte želé k lubrikaci endotracheálních styletů. Viz UPOZORNĚNÍ a NEŽÁDOUCÍ REAKCE týkající se vzácných hlášení o okluzi vnitřního lumen. Rovněž se doporučuje vyhnout se používání endotracheálních rourek se zaschlým želé na vnějším povrchu pro nedostatečný lubrikační účinek.
Maximální dávkování
Nemělo by být podáno více než 600 mg lidokainu HCI během 12 hodin.
Děti: Je obtížné doporučit maximální dávku jakéhokoli léku pro děti, protože se liší v závislosti na věku a hmotnosti. U dětí mladších deseti let, které mají normální štíhlou tělesnou hmotnost a normální tělesný vývoj, lze maximální dávku určit použitím některého ze standardních pediatrických lékových vzorců (např. Clarkova pravidla). Například u pětiletého dítěte vážícího 50 kg by dávka lidokain-hydrochloridu neměla při výpočtu podle Clarkova pravidla překročit 75 až 100 mg. V každém případě by maximální množství podaného lidokainu HCI nemělo překročit 4,5 mg/kg (2 mg/lb) tělesné hmotnosti.
Jak se přípravek dodává
Lidocaine HCI 2% Jelly se dodává v uvedených lékových formách.
NDC 17478-840-30 hliníková tuba o objemu 30 ml
NDC 17478-840-05 hliníková tuba o objemu 5 ml
V krabičce o objemu 30 ml je přiložen odnímatelný aplikační kužel a klíč k expresi obsahu.
Uchovávání:
PREMIERProRx®
Výrobce:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® je registrovaná ochranná známka společnosti Premier Inc., používaná na základě licence.
PLD00N Rev. 10/15
Základní text zobrazovacího panelu pro etiketu na obalu:
NDC 17478-840-05 Premier Logo
Lidocaine Hydrochloride Jelly USP, 2%
Rx only
Sterilní 5 ml

Základní text zobrazovacího panelu pro etiketu na kartonu:
NDC 17478-840-05 Sterilní 5 ml
Lidokain hydrochloridové želé USP, 2%
Pouze na lékařský předpis
Logo Premiér

| LIDOCAINE lidocaine hydrochloride jelly |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Označovatel – Akorn, Inc. (117696770)
Registrující – Akorn Operating Company LLC (117693100)
| Zařízení | |||
| Název | Adresa | ID/FEI | Provoz |
| Akorn, Inc | 117696840 | VÝROBA(17478-840), ANALÝZA(17478-840), STERILIZACE(17478-840), BALENÍ(17478-840), LABELOVÁNÍ(17478-840) | |
Další informace o lidokainu pro lokální použití
- Nežádoucí účinky
- Během těhotenství nebo kojení
- Informace o dávkování
- Lékové interakce
- Srovnání alternativ
- Cenové nabídky &Kupóny
- En Español
- 208 recenzí
- Třída léků: Anestetika pro lokální použití
- Upozornění FDA (5)
.
Zdroje pro spotřebitele
- Informace pro pacienty
- Lidokain pro lokální použití (rozšířené čtení)
Zdroje pro odborníky
- Předpisové informace
- Lidokain (lokální aplikace) (Odborné poradenství pro pacienty)
- Lidokain krém (FDA)
- Lidokain gel (FDA)
- Lidokain laryngotracheální roztok (FDA)
- … +9 dalších
Další značky Lidocaine Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 více
Související průvodce léčbou
- Svědění v ústech
- Chirurgie zažívacího traktu
- Anestezie
- Popáleniny, vnější
- … +9 více
Medicínské prohlášení
