Výsledky
Obrázek 1
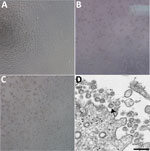
Obrázek 1. Cytopatický účinek způsobený koronavirem 2 těžkého akutního respiračního syndromu od pacienta s koronavirovým onemocněním, Spojené státy, 2020. A-C) Fázově kontrastní mikroskopie monovrstev buněk Vero po 3 dnech po inokulaci: A) Mock,…
Pacient s potvrzeným COVID-19 ve státě Washington byl identifikován 22. ledna 2020. V buňkách infikovaných mockem nebyl pozorován CPE (Obrázek 1, panel A). Hodnoty prahové hodnoty cyklu (Ct) byly 18-20 u vzorků NP a 21-22 u vzorků OP (1). Pozitivní klinické vzorky byly 22. ledna 2020 alikvotovány a znovu zamraženy a inokulovány do buněčné kultury. CPE jsme pozorovali 2 dny po inokulaci a virový lyzát jsme odebrali 3. den po inokulaci (obrázek 1, panely B, C). Použili jsme 50 μl virového lyzátu pasáže 1 pro extrakci nukleové kyseliny k potvrzení přítomnosti SARS-CoV-2 pomocí molekulárně diagnostického testu CDC (1). Hodnoty Ct 3 extrakcí nukleové kyseliny byly 16,0-17,1 pro nukleokapsidovou část 1, 15,9-17,1 pro nukleokapsidovou část 2 a 16,2-17,3 pro nukleokapsidovou část 3, což potvrdilo izolaci SARS-CoV-2 (Ct <40 se považuje za pozitivní výsledek). Testovali jsme také extrakty na dalších 33 různých respiračních patogenů pomocí testu Fast Track 33 Assay. Žádné další patogeny nebyly zjištěny. Totožnost byla navíc podpořena elektronovou mikroskopií na tenkém řezu (obrázek 1, panel D). Pozorovali jsme morfologii a morfogenezi charakteristickou pro koronaviry.
Pro sekvenování celého genomu jsme použili izoláty z první pasáže vzorku OP a NP. Genomy ze vzorku NP (GenBank accession č. MT020880) a vzorku OP (GenBank accession č. MT020881) vykazovaly vzájemnou 100% identitu. Izoláty rovněž vykazovaly 100% identitu s odpovídajícím klinickým vzorkem (GenBank accession no MN985325).
Po druhé pasáži jsme vzorky OP a NP nekultivovali zvlášť. Izolát viru jsme pasážovali ještě 2krát v buňkách Vero CCL-81 a titrovali stanovením 50% infekční dávky tkáňové kultury (TCID50). Titry byly 8,65 × 106 TCID50/ml pro třetí pasáž a 7,65 × 106 TCID50/ml pro čtvrtou pasáž.
Pasážovali jsme tento virus v nepřítomnosti trypsinu. Sekvence hrotového proteinu SARS-CoV-2 má na rozhraní S1-S2 vložený RRAR, který by mohl být štěpen furinem (16). Vysoce patogenní viry ptačí chřipky mají vysoce základní místa štěpení furinem na rozhraní hemaglutininového proteinu HA1-HA2, která umožňují intracelulární zrání virionů a účinnější replikaci viru (17). Vložka RRAR v SARS-CoV-2 by mohla plnit podobnou funkci.
Obrázek 2
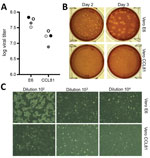
Obrázek 2. Šíření viru a kvantifikace koronaviru 2 těžkého akutního respiračního syndromu od pacienta s koronavirovým onemocněním, Spojené státy, 2020. A) Dvě zásoby viru ve 4. pasáži (černé a šedé kruhy) byly kvantifikovány…
Následně jsme vytvořili zásobu SARS-CoV-2 ve 4. pasáži na buňkách VeroE6, další buněčné linii fetálních ledvin opice rhesus. Sekvenovali jsme virovou RNA ze zásoby SARS-CoV-2 4. pasáže a potvrdili, že neobsahuje žádné nukleotidové mutace ve srovnání s původní referenční sekvencí (GenBank accession no. MN985325). Bylo zjištěno, že SARS-CoV dobře roste na buňkách VeroE6 a MERS-CoV na buňkách Vero CCL81 (18,19). Abychom vytvořili plakový test a určili preferovaný typ buněk Vero pro kvantifikaci, titrovali jsme naši zásobu pasáže 4 na buňkách VeroE6 a VeroCCL81. Po infekci sérií ředění se SARS-CoV-2 replikoval v obou typech buněk Vero; titry viru však byly o něco vyšší v buňkách VeroE6 než v buňkách VeroCCL81 (obrázek 2, panel A). Kromě toho byly plaky na buňkách Vero E6 výraznější a viditelnější (obrázek 2, panel B). Již 2 dny po inokulaci vytvářely buňky VeroE6 zřetelné plaky viditelné při barvení neutrální červení. Naproti tomu buňky Vero CCL81 vytvářely méně zřetelné plaky a nejsnáze je bylo možné kvantifikovat barvením neutrální červení 3 dny po inokulaci. Na jednotlivých monovrstvách plaků vytvářela infekce SARS-CoV-2 buněk Vero E6 CPE s oblastmi vyčištěných buněk (obrázek 2, panel C). Naproti tomu buňky Vero CCL81 měly oblasti mrtvých buněk, které se spojily a vytvořily plaky, ale buňky se nevyčistily. Tyto výsledky společně naznačují, že buňky VeroE6 by mohly být nejlepší volbou pro amplifikaci a kvantifikaci, ale oba typy buněk Vero podporují amplifikaci a replikaci SARS-CoV-2.
Obr. 3
Obr. 3. Buněčné linie od pacienta s koronavirovým onemocněním, Spojené státy, 2020, citlivé na koronavirus SARS 2 (SARS-CoV-2). Buněčné linie byly infikovány s vysokou multiplicitou infekce (>5), po adsorpci promyty a…
Vzhledem k tomu, že byl zahájen výzkum zaměřený na studium a reakci na SARS-CoV-2, jsou potřebné informace o buněčných liniích a typech citlivých na infekci. Proto jsme zkoumali schopnost SARS-CoV-2 infikovat a replikovat se v několika běžných buněčných liniích primátů a lidí, včetně buněk lidského adenokarcinomu (A549), lidských jaterních buněk (HUH7.0) a buněk lidských embryonálních ledvin (HEK-293T), kromě buněk Vero E6 a Vero CCL81. Zkoumali jsme také dostupnou buněčnou linii ledvin netopýra velkého (EFK3B) z hlediska schopnosti replikace SARS-CoV-2. Každá buněčná linie byla inokulována při vysoké multiplicitě infekce a vyšetřena 24 hodin po infekci (obrázek 3, panel A). U žádné z buněčných linií nebyla pozorována CPE s výjimkou buněk Vero, u nichž došlo k nárůstu na >107 PFU po 24 h po infekci. Naproti tomu buňky HUH7.0 a 293T vykazovaly pouze mírnou virovou replikaci a buňky A549 byly s infekcí SARS-CoV-2 neslučitelné. Tyto výsledky jsou v souladu s předchozími zjištěními citlivosti na SARS-CoV a naznačují, že jiné běžné kultivační systémy, včetně buněk MDCK, HeLa, HEP-2, MRC-5 a embryonálních vajíček, pravděpodobně nepodporují replikaci SARS-CoV-2 (20-22). Kromě toho se SARS-CoV-2 nereplikoval v buňkách EFK3B netopýrů, které jsou citlivé na MERS-CoV. Výsledky společně naznačují, že SARS-CoV-2 si zachovává podobný profil jako SARS-CoV, pokud jde o vnímavé buněčné linie.
Poté, co jsme prokázali robustní infekci SARS-CoV-2 v několika typech buněk, jsme dále hodnotili zkříženou reaktivitu protilátek proti SARS-CoV-2. Buněčné lyzáty z infikovaných buněčných linií byly podrobeny sondám pro analýzu proteinů; zjistili jsme, že polyklonální séra proti proteinu hrotu SARS-CoV a nukleokapsidovým proteinům rozpoznávají SARS-CoV-2 (obr. 3, panely B, C). Nukleokapsidový protein, který je vysoce konzervovaný napříč rodinou skupiny 2B, si mezi SARS-CoV a SARS-CoV-2 zachovává >90% aminokyselinovou identitu. V souladu s výsledky replikace (obr. 3, panel A) vykazoval SARS-CoV-2 robustní nukleokapsidový protein v obou typech buněk Vero, méně proteinu v buňkách HUH7.0 a 293T a minimální protein v buňkách A549 a EFK3B (obr. 3, panel B). Protilátka proti SARS-CoV spike proteinu rozpoznala také SARS-CoV-2 spike protein, což ukazuje na zkříženou reaktivitu (obrázek 3, panel C). V souladu se SARS CoV bylo pozorováno několik štěpených a neštěpených forem SARS-CoV-2 spike proteinu. Vzor štěpení pozitivní kontroly SARS spike z buněk Calu3, respirační buněčné linie, se mírně liší a mohl by naznačovat rozdíly mezi proteolytickým štěpením proteinů spike mezi těmito dvěma viry kvůli předpokládanému vložení štěpného místa furinu do SARS-CoV-2 (16). Rozdíly v buněčném typu a podmínkách však tuto interpretaci komplikují a naznačují potřebu dalšího studia v ekvivalentních systémech. Celkově lze říci, že údaje o expresi proteinů z protilátek proti nukleokapsidovým a hrotovým proteinům SARS-CoV rekapitulují výsledky replikace a naznačují, že činidla SARS-CoV lze použít k charakterizaci infekce SARS-CoV-2.
Obrázek 4
Obrázek 4. Vícestupňová růstová křivka pro koronavirus těžkého akutního respiračního syndromu 2 od pacienta s koronavirovým onemocněním, Spojené státy, 2020. Buňky Vero CCL81 (černá) a HUH7.0 (zelená) byly infikovány při násobnosti…
Nakonec jsme vyhodnotili kinetiku replikace SARS-CoV-2 na vícestupňové růstové křivce. Stručně řečeno, infikovali jsme buňky Vero CCL-81 a HUH7.0 virem SARS-CoV-2 při nízké multiplicitě infekce (0,1) a vyhodnocovali jsme replikaci viru každých 6 h po dobu 72 h po inokulaci, s oddělenými sběry v buněčném a supernatantním kompartmentu (obr. 4). Podobně jako SARS-CoV se SARS-CoV-2 po počáteční fázi zatmění rychle replikoval v buňkách Vero, přičemž do 24 h po infekci dosáhl 105 TCID50/ml a vrcholu >106 TCID50/ml. Pozorovali jsme podobné titry v kompartmentech asociovaných s buňkami a v supernatantu, což svědčí o účinném úniku. Navzdory vrcholu virových titrů do 48 h po inokulaci byl hlavní CPE pozorován až po 60 h po inokulaci a vrcholu dosáhl po 72 h po inokulaci, což naznačuje, že infikované monovrstvy by měly být sklizeny před pozorováním vrcholu CPE. Replikace v buňkách HUH7.0 se po počáteční fázi zatmění také rychle zvýšila, ale do 24 h po inokulaci dosáhla v intracelulárním kompartmentu hodnoty 2 × 103 TCID50/ml a po 66 h po inokulaci poklesla. Virus nebyl v supernatantu infikovaných buněk HUH7 detekován do 36 h po inokulaci a vykazoval nižší titry ve všech časových bodech (obrázek 4). U buněk HUH7.0 nebyla nikdy pozorována významná CPE. Tyto výsledky jsou v souladu s předchozími zprávami o SARS-CoV a MERS-CoV, které naznačují podobnou dynamiku replikace mezi zoonotickými kmeny CoV (23,24).
.
