Lékaři jsou již dlouho frustrováni neúměrnou rolí, kterou hraje nitrooční tlak (IOP) v péči o glaukom. Jako jediný faktor, který podléhá lékařskému nebo chirurgickému zásahu, je jeho role zásadní. Přesto je tonometrie ze své podstaty omezená: Jediný odečet provedený jednou za několik měsíců nedokáže zobrazit denní příliv a odliv IOP. Dokonce ani to, že pacienti přijdou na několik tonometrických měření, neposkytuje ideální představu o charakteristikách IOP pacienta.

|
|
| Tento implantovatelný mikrofluidní senzor pro 24hodinové monitorování IOP je v současné době ve vývoji na Stanfordově univerzitě. Foto: Ishmail E. Araci |
Experti věří, že pacientům časem nasadíte malý senzor umístěný na kontaktní čočce nebo brýlích, nebo je pošlete k očnímu lékaři, aby jim ho implantoval do oka. Ten by nepřetržitě měřil IOP, čímž by se exponenciálně zvýšilo množství – a doufejme, že i hodnota – získaných údajů. Jestliže současný přístup k dokumentaci IOP je jako pořizování snímků, nepřetržité 24hodinové monitorování IOP se podobá spíše pořizování videozáznamu, který zaznamenává změny v čase, než aby poskytoval pouze jeden statický údaj.
Tyto pomůcky jsou stále ve vývoji. Jsou připraveny na hlavní vysílací čas? Podívejme se na to, jak IOP kolísá, na klinické problémy, které z toho vyplývají, a na současné nejmodernější technologie, které se snaží lépe sledovat IOP a umožnit tak lepší klinické porozumění.
Pohyblivý cíl
Nastavení léčebného plánu na základě dosažení cílové IOP je složité, když se samotný cíl pohybuje. IOP kolísá v průběhu dne – hodinu po hodině, minutu po minutě, dokonce i vteřinu po vteřině – na základě různých endogenních a exogenních faktorů.
V rámci očního systému může IOP záviset na rovnováze produkce vodního moku, odtokové možnosti (jak snadno vodní mok opouští oko), episklerálním žilním tlaku (tlak v žilách na povrchu oka) a uveosklerálním odtoku (sekundární cesta, kterou vodní mok opouští oko).
Například zvýšení odtokového zařízení nebo snížení produkce vodnatého humoru by snížilo IOP, říká doktor Arthur J. Sit, výzkumník glaukomu na Mayo Clinic v Rochesteru v Minnesotě. Ke krátkodobým skokům IOP může dojít také v důsledku tlaku na oko při mrkání nebo tření oka nebo dokonce při pohybu oka či pulzacích krevního tlaku.
Intraokulární tlak kolísá také kvůli poloze těla, denní době (vrcholy v noci, poklesy během dne), krevnímu tlaku a souvisejícímu pojmu oční perfuzní tlak (OPP), úrovni stresu nebo bolesti, konzumaci vody a kofeinu.
Podle doktora Kaweha Mansouriho, oftalmologa z Ženevské univerzity a Coloradské univerzity v Denveru, může navíc intenzivní aktivita a stres způsobit, že krevní tlak, IOP a OPP dosáhnou vrcholu. Měření krevního tlaku ve spojení s IOP má význam pro určení, jak krevní tlak ovlivňuje IOP, říká Dr. Mansouri. Výzkumníci v současné době používají zařízení pro 24hodinové monitorování IOP ke zkoumání těchto vlivů na progresi glaukomu.
|
Dos and Don’t of IOP Measurement Nediagnostikujte ani neléčte pouze po jednom měření. Dr. Sowka doporučuje optometristům nezahajovat léčbu okamžitě, pokud není tlak nadměrně vysoký nebo pokud již nejsou zrakové nervy vážně poškozené a zranitelné; namísto toho změřte tlak několikrát. Je také dobré po zahájení léčby provést několik měření tlaku, aby se zjistilo, zda léky fungují, říká Dr. Sowka. Jeden údaj IOP po zahájení léčby opravdu nestačí k posouzení skutečné účinnosti. Řekněte pacientům, aby se uvolnili. Jak již bylo zmíněno, pacienti se mohou při tonometrii napínat nebo zadržovat dech. Pravidelně jim říkejte, aby se během procesu uvolnili a normálně dýchali, nabádá doktor Mansouri. Neopouštějte své podezření. Pokud se zdá, že měření IOP pacienta neodpovídá vašemu hodnocení zorného pole a zrakového nervu, může se s IOP pacienta dít více, než jste si uvědomovali, říká Dr. Hartwick. Ať se vrátí a změří si IOP v jinou denní dobu, dodává. U vybraných pacientů zvažte denní křivku. Zaznamenávat denní křivku tonometricky je pro většinu pacientů nepraktické a zdlouhavé. Pokud se však výše IOP a rozsah poškození zdají být nesourodé – například při podezření na glaukom s normálním napětím – zvažte tuto možnost, říká Dr. Davey. Pokud s tím pacient souhlasí, přiveďte ho brzy ráno a zaznamenávejte IOP každou hodinu po dobu osmi až deseti hodin. „Tím získáte ordinační denní křivku, která nemusí být plně reprezentativní pro denní/noční hodnoty, ale alespoň vám poskytne více než jedno měření,“ říká. |
Takto tyto proměnné ovlivňují IOP:
– Poloha těla. V závislosti na poloze pacienta na křesle se může tlak zvyšovat nebo snižovat. Například IOP je nejnižší, když pacient sedí v neutrální poloze. „Téměř cokoli jiného způsobuje zvýšení IOP, včetně ohýbání krku dopředu, zaklánění hlavy dozadu, otáčení hlavy na stranu, ležení, předklonu, mrkání nebo tření očí,“ říká doktor Sit.
– Spotřeba vody. Vypití velkého množství vody způsobí, že se pacientovi na krátkou dobu zvětší objem krve. Při konzumaci většího množství vody se zvyšuje i žilní tlak. „Stačí, aby zkonzumovali 16 až 32 oz, což je jedna nebo dvě malé láhve vody, a během pěti minut se tlak zvýší o 6 mm Hg,“ říká Pinakin Gunvant Davey, PhD, OD, profesor a odborník na glaukom na College of Optometry na Western University of Health Sciences v Pomoně v Kalifornii.
– Denní doba. Z literatury vyplývá, že vrchol IOP nastává v noci u dvou třetin pacientů. Důvod: vodní sekret je v noci nedostatečně vylučován, říká Joseph Sowka, OD, profesor optometrie na Nova Southeastern University College of Optometry ve Ft Lauderdale, Fla.
Například Dr. Mansouri pozoroval pacienty po dobu 24 hodin ve spánkových laboratořích a zjistil, že nejvyšší IOP jsou v noci. I když vaši pacienti nebudou podrobeni spánkovým studiím, mohou přijít do vaší ordinace večer – pokud ano, očekávejte zvýšené hodnoty IOP oproti jiným denním dobám.
– Krevní tlak. Výchozí IOP vychází ze srdečního cyklu, systolického a diastolického krevního tlaku. Síla, kterou se krev dostává do oka, je oční perfuzní tlak, vysvětluje James L. Fanelli, OD, z Cape Fear Eye Institute ve Wilmingtonu v Severní Karolíně.
Je-li krevní tlak nízký, je menší síla, která „tlačí“ krev do oka, a proto je menší perfuzní tlak do oka. Faktory, které způsobují zvýšení IOP, budou mít vliv na snížení perfuzního tlaku a faktory, které snižují krevní tlak, budou mít také za následek snížení perfuzního tlaku – nebo může hrát roli kombinace kteréhokoli z těchto faktorů, říká Dr. Fanelli. Krevní tlak má tendenci se snižovat během spánku v časných ranních hodinách, což je také denní doba, kdy bývá IOP nejvyšší.1 Tyto dva protichůdné faktory mohou mít duplicitní účinek na snížení OPP během nočních hodin, což může umožnit zvýšené poškození hlavice očního nervu.
– Stres. Zvýšení nebo snížení stresu způsobuje hormonální změny, které zvyšují nebo snižují hladinu IOP. U jedné z pacientek Dr. Mansouriho – studované pomocí 24hodinového senzoru pro sledování IOP na kontaktní čočce – docházelo k nárůstům tlaku vždy, když měl její pes v noci epileptický záchvat.
– Obecné „nervy“. Je možné, že u některých pacientů může stres ze samotného očního vyšetření – například pokud se obávají, že jim bude diagnostikován glaukom – způsobit zvýšení IOP, říká Andrew Hartwick, OD, PhD, docent na Ohio State University College of Optometry v Columbusu. Mohou si například stisknout oči, protože jsou ve stresu z vyšetření, a hodnoty IOP se zvýší.
– Bolest také způsobuje prudké zvýšení IOP, protože vyvolává stres. Jedna z pacientek doktora Mansouriho se na parkovišti ošklivě praštila do nohy. Podle údajů z 24hodinového monitorování došlo k prudkému nárůstu hladiny IOP přesně v okamžiku, kdy si vzpomněla, že se jí nehoda stala.
Důsledky nepřesných hodnot IOP
Studie naznačily, že špičky IOP mohou přispívat k progresi glaukomu.2,3 Pokud však pacienta vyšetříte v době, kdy je IOP nejnižší nebo nejvyšší, můžete nadhodnotit nebo podhodnotit diagnózu glaukomu nebo léčbu, kterou pacient potřebuje.
„Pokud pacienta zastihneme v období koryta, kdy je IOP nejnižší, může nás to odvést od úvahy o glaukomu,“ zejména pokud se hodnota pohybuje ve statisticky normálním rozmezí, říká Dr. Sowka. „Jindy je můžeme zastihnout na vrcholu IOP, kde je trochu nad normálem – scénář, který má tendenci lékaře zbytečně znepokojovat.“
|
|
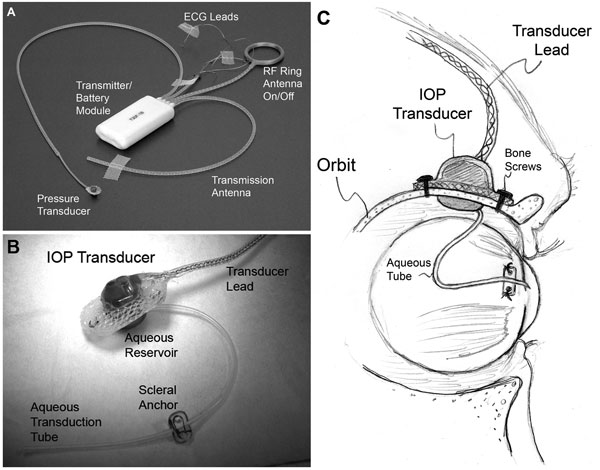
| (A) Typický systém celkového implantátu T30F (Konigsberg Instruments). (B) Extraorbitální povrch vlastního pouzdra snímače IOP. (C) Silikonová hadička o průměru 23 mm přivádí vodu z přední komory do zásobníku tekutiny na intraorbitální straně snímače (částečně skrytá z pohledu v B); Hadička (s příslušnou vůlí umožňující pohyb oka) byla zastřižena a vložena do přední komory. |
Zaznamenávání rozsahu IOP by potenciálně umožnilo zlepšit diagnostiku a léčbu glaukomu. „Pokud by se vědcům podařilo prokázat, že specifické 24hodinové vzorce IOP souvisejí s progresí glaukomu, pak existuje naděje, že by odhalení těchto vzorců mohlo pomoci identifikovat pacienty se zvýšeným rizikem progrese a umožnit nám odpovídajícím způsobem přizpůsobit jejich léčbu,“ říká Dr. Mansouri.
Glaukom by mohl být identifikován dříve, což by umožnilo rychlejší zahájení operace nebo léčby, dodává. Oční lékaři by také mohli zjistit, zda jsou léky snižující IOP účinné v noci nebo při určitých činnostech, které IOP zvyšují.
Stanovení skutečného rozsahu IOP by vyžadovalo nepřetržité 24hodinové sledování IOP. To je problém, protože jediné měření IOP získané během běžných ordinačních hodin nezachytí rozsah IOP pacienta, jeho vrcholy ani změny během dne.4
V současné době je stanovení rozsahu IOP možné pomocí Goldmanovy aplanační tonometrie (GAT) prostřednictvím denní křivky napětí (DTC), kdy jsou hodnoty IOP zachyceny v různých časových bodech během ordinačních hodin. To je však problematické jak pro lékaře, tak pro pacienta. Noční křivky se nezaznamenávají a méně než 1 % pacientů podstoupí DTC nebo sledování IOP ve spánkové laboratoři.4
Vědci měřili IOP po dobu 24 hodin a zdokumentovali nejen to, že IOP dosahuje vrcholu v nočních hodinách, ale i to, že kolísání IOP je mnohem větší v mimopracovních hodinách.5 Ve studii 35 pacientů, jejichž IOP bylo zaznamenáno pomocí pneumatonometru ve spánkové laboratoři po dobu 24 hodin, bylo u starších pacientů s glaukomem zaznamenáno nejvíce vrcholů IOP v noci ve srovnání se zdravými lidmi, ať už vsedě nebo vleže.6
Nejnověji badatelé využívající 24hodinové monitorování zjistili, že průměrná hodnota IOP nejen stoupá v noci, ale ve skutečnosti se zvyšuje neustále – a to více během dne než v noci.7 Výzkumníci z Devers Eye Institute v Portlandu ve státě Ore použili telemetrický systém implantovaný do očí opic, který zaznamenával 500 měření IOP za sekundu.
Zjistili, že IOP kolísá mnohem více, než se dříve předpokládalo. „Mrkání a pohyby očí vytvářejí velké výkyvy IOP, které se vyskytují asi 12 000krát za hodinu a představují asi 12 % celkové energie IOP, kterou musí oko absorbovat během bdělého stavu,“ zjistili vědci. Domnívají se, že tyto údaje u opic budou přibližně stejné i u lidí. „Na IOP je nyní třeba pohlížet jako na dynamický a neustále se měnící a kolísání IOP se může ukázat jako důležitý faktor přispívající ke vzniku glaukomu. „8
Zjistili také, že denní cyklus se neopakuje ze dne na den. Z toho vyplývá potřeba nepřetržitého sledování IOP. Současné prototypy zahrnují implantované senzory a zařízení na bázi kontaktních čoček.
Intelligent Implantables
Několik začínajících společností vyvíjí telemetrické snímače tlaku, které lze implantovat během operace katarakty nebo glaukomu. „Telemetrické znamená, že údaje o tlaku jsou snímány na dálku (tj. zevnitř oka) a bezdrátově přenášeny do externí čtečky,“ říká Dr. Sit.
Mezi implantabilní zařízení, která se v současné době zkoumají, patří:

|
|
|
Senzor Pro-IOP je telemetrické zařízení, které se implantuje jako IOL. Foto: Implandata Ophthalmic Products GmbH |
– Pro-IOP. Německá společnost Implandata Ophthalmic Products pracuje na bezdrátovém snímači nitroočního tlaku (WIT) Pro-IOP, který je napájen telemetricky pomocí ručního zařízení. WIT, připomínající malý plastový kroužek, měří v průměru 11,3 mm.9 Obsahuje snímače tlaku, snímač teploty, identifikační snímač, analogově-digitální snímač a telemetrickou jednotku v jediném mikroelektromechanickém systému.9
Čip RFID s vestavěnou anténou vysílá 24hodinové údaje o IOP do externí ruční čtečky. Pacient a lékař mohou mít časem také možnost přijímat údaje prostřednictvím aplikace v chytrém telefonu. Pacient by také mohl v aplikaci komunikovat s lékařem o naměřených hodnotách IOP.9
Zařízení zatím nezískalo označení CE v Evropě ani schválení FDA v USA, ale vědci v Německu nedávno vložili přístroj Pro-IOP prvnímu člověku, ženě ve věku 60 let; žádné údaje zatím nebyly zveřejněny.9
– AcuMEMs. Implantát AcuMEMs, který vyvíjí stejnojmenná americká společnost, funguje podobně jako Pro-IOP. Jedná se o kapacitní snímač tlaku, který mění tvar s kolísáním IOP. „Když změní tvar, změní se elektrická kapacita, což lze zjistit externě pomocí čtečky,“ říká Dr. Sit.
Senzor lze implantovat do přední komory jako samostatný zákrok nebo jako součást operace glaukomu; lze jej také vložit do kapsulárního vaku při operaci katarakty.
– Mikrofluidní implantát IOL. Výzkumníci ze Stanfordovy univerzity a Bar-Ilanovy univerzity v Izraeli společně vyvíjejí implantovatelný mikrofluidní senzor. Podle patentu by se IOP měřil „na základě stanoveného rovnovážného tlakového rozhraní mezi nitrooční kapalinou a plynem“ obsaženým v komorách senzoru. Pacienti a lékaři by mohli ke kontrole IOP používat své chytré telefony nebo externí čtečku.10 Vynálezci čekají na schválení patentu na senzor.
Signál vysílaný ze zařízení implantovaných do oka může být teoreticky přesnější než ze zařízení připevněných ke kontaktním čočkám, říká Dr. Davey. Síla signálu závisí na tom, kolik energie zařízení vydává. „Implantovali jsme obě zařízení (Pro-IOP a AcuMEM) a nefungovala tak dobře,“ říká Dr. Davey.
Obě čidla Pro-IOP a AcuMEMs by potenciálně mohla být připojena k brýlím a data by se sbírala stejným způsobem, říká Dr. Sit.
Chytré kontaktní čočky
Výzkumníci poprvé zkoumali senzory v kontaktních čočkách v 70. letech 20. století, ale dostupné tvrdé kontaktní čočky byly podle Dr. Daveyho příliš nepohodlné a měnily strukturální integritu pacientova oka.
|
|
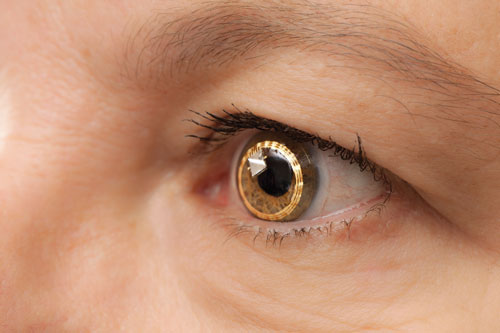
| Sensimed Triggerfish na oku. V USA stále probíhají jeho klinické zkoušky. |
Senzory také nebyly dostatečně citlivé. „Osoba s „měkčím“ okem měla přesnější údaje než osoba s tužším okem,“ říká Dr. Davey. „Technologie nebyla dostatečně dobrá, aby bylo možné získat hodnoty IOP.“ Silnější rohovka reaguje na změny IOP méně ochotně, takže tonometrie (a senzory na kontaktních čočkách) jsou méně přesné.
Mezi senzory IOP na bázi kontaktních čoček patří:
– Triggerfish (Sensimed). Na Ženevské univerzitě ve Švýcarsku prováděli oftalmologové pod vedením Dr. Mansouriho a dalších první výzkumy kontaktní čočky nazvané Triggerfish.
The Triggerfish je hydrofilní měkká kontaktní čočka vybavená senzorem kontaktní čočky (CLS). CLS má dva tenzometry umístěné kolem limbu, které detekují změny v obvodu oka. „Předpokládá se, že tyto změny očního obvodu souvisejí se změnami IOP a nitroočního objemu, což bylo prokázáno na enukleovaných očích,“ říká Dr. Mansouri. Přístroj měří směs IOP, nitroočního objemu a změn biomechanických vlastností (kombinace rohovkové a sklerální hystereze a rigidity), které korelují s kolísáním IOP. Externí čtečka zaznamenává údaje po dobu 24 hodin.
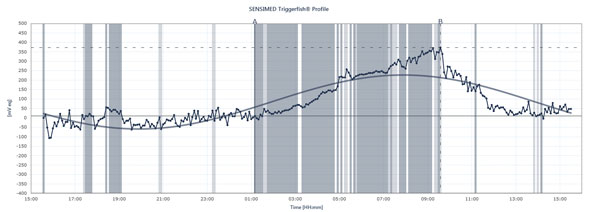
Vývojový diagram ukazuje vrcholy a poklesy IOP u pacienta, který nosí Sensimed Triggerfish v průběhu 24 hodin.
Senzor Triggerfish je v Evropě schválen značkou CE. V USA nebylo dosaženo schválení FDA a zařízení stále prochází klinickými zkouškami.
|
Triggerfish sleduje IOP odlišně Údaje zobrazené na externí čtečce jsou kombinací nitroočního tlaku, nitroočního objemu a biomechanických vlastností oka, vysvětluje Dr. Mansouri. „Je to užitečné spíše pro představu o kvalitativních změnách v průběhu 24 hodin než o kvantitativních změnách, protože je nemůžeme převést na milimetry rtuti,“ říká. Triggerfish přesto poskytuje cenné informace. Budoucí studie využívající tento přístroj by mohly pomoci vysvětlit, jak nestabilní nebo stabilní byl tlak v průběhu 24 hodin, kdy dochází k nočním vrcholům IOP, jak zavedení léčby nebo změny léčby ovlivňují 24hodinový průběh IOP a jak specifické činnosti ovlivňují 24hodinový průběh IOP, například polohy při józe, příjem kofeinu, stresové situace a další výše popsané příčiny vzestupu IOP. Dr. Mansouri také nechává pacienty s glaukomem s normálním nebo nízkým napětím současně monitorovat 24hodinový krevní tlak a 24hodinový IOP, protože špičky mohou ovlivnit OPP. Prokáže však Triggerfish korelaci mezi 24hodinovými vzorci IOP a progresí glaukomu? Na tuto zásadní otázku se snaží odpovědět řada studií.
|
– Kontaktní čočka se senzorem rezonančního obvodu. Dalším vyvíjeným inteligentním zařízením CLS je rezonanční obvod tvořený tenkovrstvým kondenzátorem v kombinaci se snímací cívkou, která detekuje deformaci zakřivení rohovky. Je v rané fázi vývoje pod vedením Davida C. C. Lama na katedře strojního a leteckého inženýrství na Hongkongské univerzitě vědy a technologie.
Ve studii ze září 2014 byl CLS testován na modelu oka ze silikonové gumy. Bylo zjištěno, že senzor přesně sleduje kolísání IOP.11
Stejně jako měření hladiny glukózy jednou denně u pacientů s cukrovkou nebo měření krevního tlaku jednou denně u pacientů se srdečními chorobami by spoléhání se na jedno měření IOP mohlo vést k chybným údajům o IOP. Možná však, že v nepříliš vzdálené budoucnosti vám zařízení jako ze sci-fi filmu – kontaktní čočky a implantabilní senzory – umožní sledovat IOP s větším porozuměním a méně starostí pro vás i vaše pacienty.
1. Liu JH1, Gokhale PA, Loving RT, Kripke DF, Weinreb RN. Laboratorní hodnocení denního a nočního očního perfuzního tlaku u lidí. J Ocul Pharmacol Ther. 2003 Aug;19(4):291-7.
2. Zeimer RC, Wilensky JT, Gieser DK, Viana MA. Asociace mezi vrcholy nitroočního tlaku a progresí ztráty zorného pole. Ophthalmology. 1991 Jan;98(1):64-69.
3. Konstas AG, Quaranta L, Mikropoulos DG, et al. Peak Intraocular Pressure and Glaucomatous Progression in Primary Open-Angle Glaucoma. J Ocul Pharmacol Ther. 2012 Feb;28(1):26-32.
4. Mansouri K, Weinreb RN, Medeiros FA. Je u glaukomu nutné 24hodinové monitorování nitroočního tlaku? Semin Opthalmol. May 2013: 28(3):157-164.
5. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Clinical utility of intraocular pressure monitoring outside of normal office hours in patients with glaucoma. Arch Ophthalmol. 2006 Jun;124(6):793-7.
6. Mosaed S, Liu H, Weinreb RN. Korelace mezi maximálními nočními nitroočními tlaky u zdravých osob a pacientů s glaukomem. Am J Ophthalmol. 2005; Feb;139(2):320-4.
7. Downs JC, Burgoyne CF, Seigfreid WP, et al. 24-hour IOP telemetry in the nonhuman primate: implant system performance and initial characterization of IOP at multiple timescales. Invest Ophthalmol Vis Sci. 2011 Sep 21;52(10):7365-75.
8. Association for Research in Vision and Ophthalmology: Emerging trends and hot topics (Nové trendy a žhavá témata). Předneseno v pondělí 5. května 2014 na výročním zasedání ARVO. Dostupné na: www.arvo.org/About_ARVO/Press_Room/Emerging_Trends_and_hot_topics__Presented_Monday,_May_5_at_the_ARVO_Annual_Meeting. Přístupné 19. listopadu 2014.
9. Melki S, Todani A, Cherfan G. An Implantable Intraocular Pressure Transducer Initial Safety Outcomes (Implantovatelný snímač nitroočního tlaku – počáteční výsledky bezpečnosti). JAMA Ophthalmol. 2014 Oct 1;132(10):1221-5.
10. Mandel Y, Araci IE, Quake SR. Patenty Google. Implantovatelné mikrofluidní zařízení pro monitorování nitroočního tlaku. Dostupné na: www.google.com/patents/WO2014137840A1?cl=en. Přístup 17. října 2014.
11. Chen GZ, Chan IS, Leung LK, Lam DC. Měkký nositelný senzor kontaktních čoček pro kontinuální monitorování nitroočního tlaku. Med Eng Phys. 2014 Sep;36(9):1134-9.
12. Mottet B, Aptel F, Romanet JP, et al. 24hodinový rytmus nitroočního tlaku u mladých zdravých osob hodnocený pomocí kontinuálního monitorování pomocí senzoru kontaktních čoček. JAMA Ophthalmol. 2013 Dec;131(12):1507-16.
